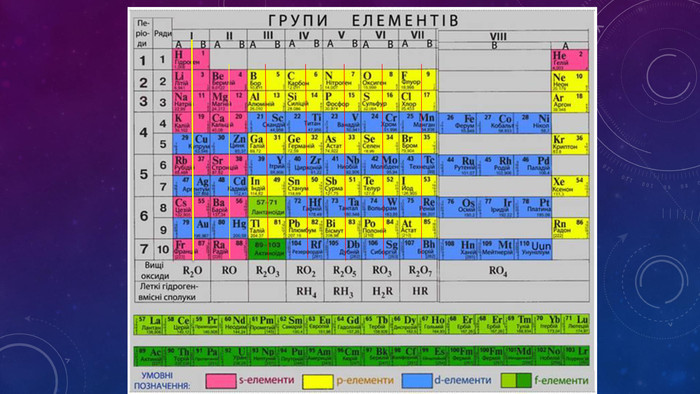
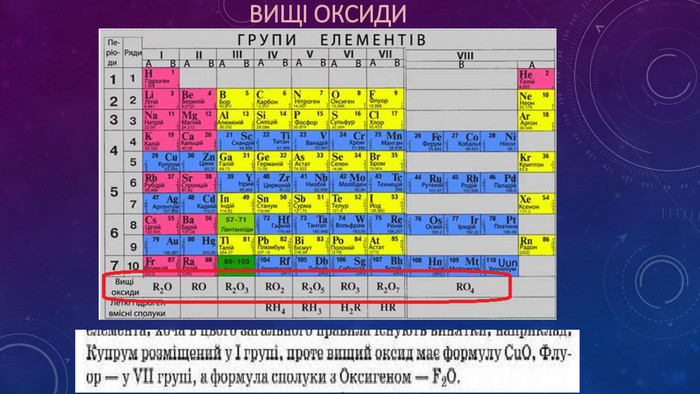
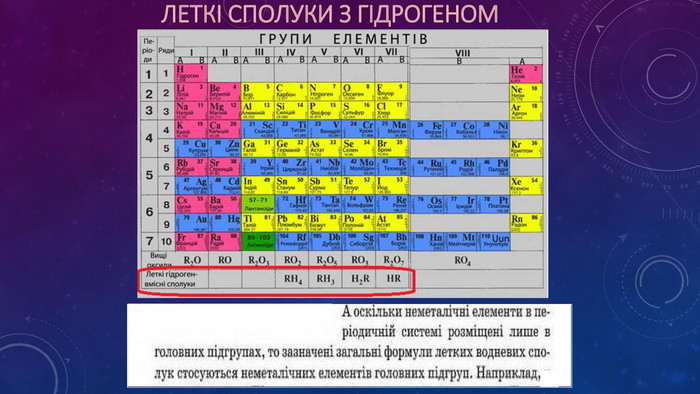
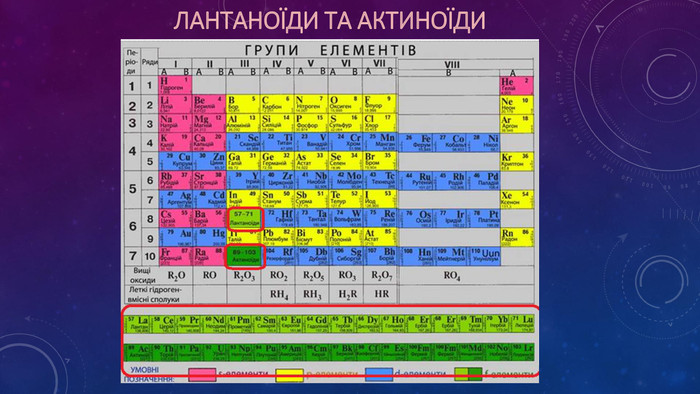
Презентація "Періодичний закон Д.І. Менделєєва. Структура періодичної системи"
Про матеріал
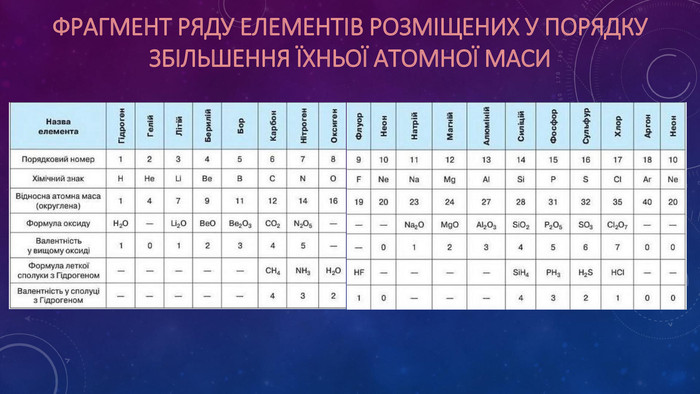
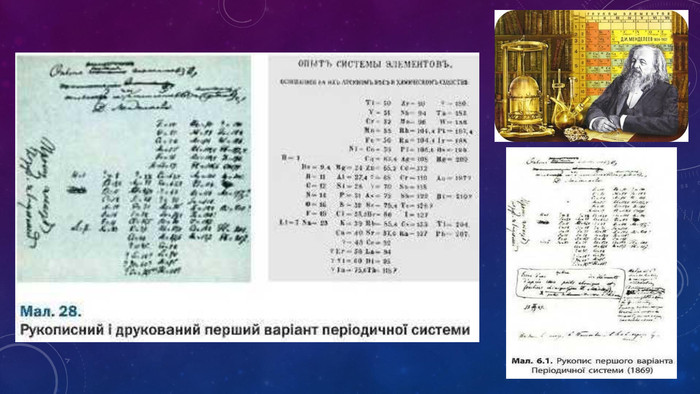
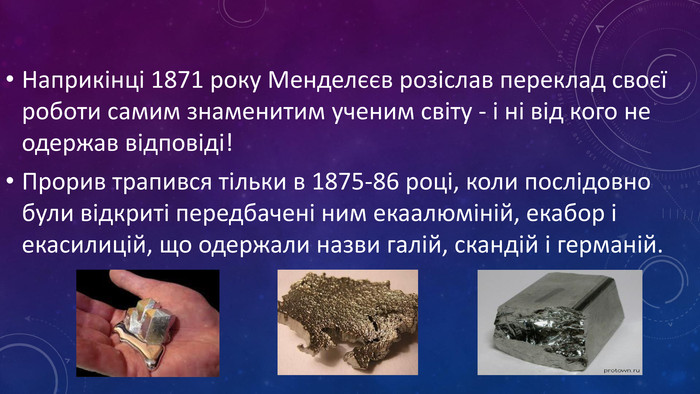
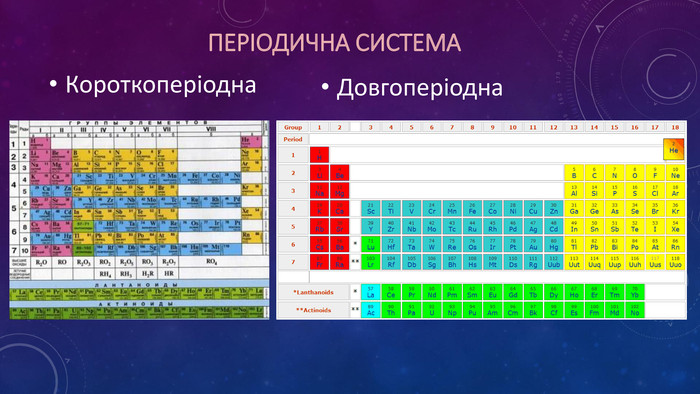
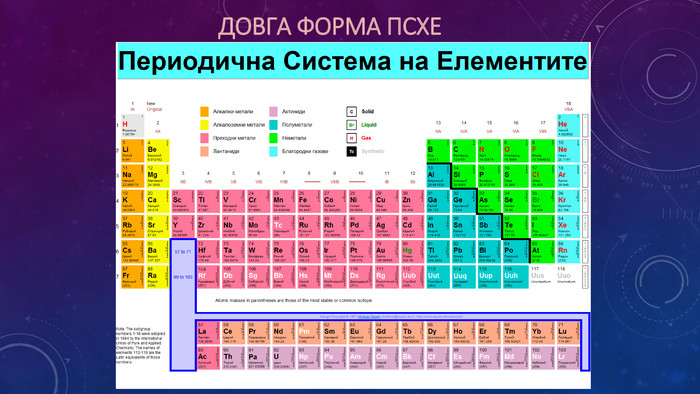
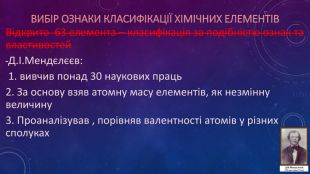
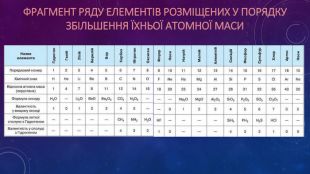
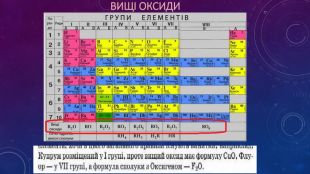
Презентація ознайомлює учнів з Періодичним законом Д.І. Менделєєва та структурою періодичної системи. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Чудова розробка !
-


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку