Конспект уроку з хімії для 8 класу "Закон Авогадро. Молярний об'єм газів. Розрахунки за хімічними формулами"
8 клас (загальноосвітня програма)
ЗАКОН АВОГАДРО. МОЛЯРНИЙ ОБ’ЄМ ГАЗІВ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ
Мета: З’ясувати суть закону Авогадро, ввести поняття молярного об’єму
газу, розглянути взаємозв’язок між фізичними величинами – кількістю
речовини, молярним об’ємом, масою, кількістю структурних частинок.
Розвивати пізнавальний інтерес, логічне мислення, пам’ять, формувати науковий світогляд.
Виховувати творчу, допитливу особистість, почуття гідності, бережливості, вміння працювати в колективі, взаємодопомогу.
Тип уроку: вивчення нового матеріалу.
Форми роботи: розповідь учителя, бесіда.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва.
Хід уроку.
І. Організаційний етап уроку.
ІІ. Актуалізація опорних знань.
Бесіда.
- В яких агрегатних станах можуть перебувати речовини?
- Що можна сказати про відстані між структурними частинками речовини в різних агрегатних станах?
- Від чого, на вашу думку, залежатиме об’єм речовини?
- Охарактеризуйте газоподібний стан речовини.
- Як впливає на фізичний стан газів зміна температури та тиску?
Усний розв’язок задач
|
Формула речовини |
Молярна маса, г/моль |
Маса, г |
Кількість речовини, моль |
|
H2SO4 |
98 |
49 |
|
|
CaO |
56 |
|
2 |
|
CO2 |
44 |
4,4 |
|
|
H2O |
18 |
|
0,5 |
Мотивація навчальної діяльності.
На попередніх уроках ми навчилися знаходити кількість речовини, кількість структурних частинок в певній кількості речовини, переходити від кількості речовини до маси, адже нам легше зважити певну масу речовини, ніж порахувати певну кількість структурних частинок. Але, чи зручно нам зважувати газуваті речовини? Якою фізичною величиною зручніше користуватись, коли мова йде про газуваті речовини? Краще користуватись об’ємом.
Щоб розрахувати об’єм будь-якої речовини необхідно знати масу та густину:
ρ = ![]() ; [ρ] = г\см3;
; [ρ] = г\см3;
V = ![]() [V] = см3, л.
[V] = см3, л.
Вивченням газоподібних речовин займалося безліч учених. Значний внесок у вивчення цього питання зробили французький хімік Жозеф Луї Гей-Люссак та англійський фізик Роберт Бойль, які сформулювали низку фізичних закономірностей, що описують стан газів.
 Ро́берт Бойль (*25 січня 1627 — †30 грудня 1691) — англійський хімік, фізик і філософ, один із засновників Лондонського королівського товариства.
Ро́берт Бойль (*25 січня 1627 — †30 грудня 1691) — англійський хімік, фізик і філософ, один із засновників Лондонського королівського товариства.
Поклав початок новому напрямові у хімії, в основі якого була вимога вивчення складу речовин експериментальним методом. Уперше запровадив наукове поняття про хімічний елемент. Бойль — один із засновників якісного хімічного аналізу. У 1662 р ірландський хімік Роберт Бойль вивчав зв’язок між тиском газу Р і його об’ємом V в посудині, при постійній температурі. Бойль виявив, що добуток тиску на об’єм залишається практично завжди постійним: PV = const; довів неможливість життя й горіння в пустоті, досліджував теплові, електричні й акустичні явища.
Які з цих закономірностей ти знаєш?
Усі гази однаково стискаються, мають однаковий термічний коефіцієнт розширення. Об’єми газів залежать не від розмірів окремих молекул, а від відстані між молекулами. Відстані між молекулами залежать від швидкості їхнього руху, енергії та температури.
Ж.Л.Гей-Люссак, досліджуючи гази, виявив, що під час хімічних реакцій їхні об’єми відносяться між собою як невеликі цілі числа. Ці числа відповідають коефіцієнтам, поставленим у рівняннях реакцій. Цей закон називається законом об’ємних відношень або законом Гей-Люссака. Учений довів, що цей закон є справедливим за умови, коли об’єми газів виміряні за однакових температур і тиску.


 Жозе́ф-Луї́ Гей-Люсса́к — (рос. Joseph Louis Gay-Lussac; *6 грудня 1778 — †9 травня 1850) — французький хімік іфізик, член Французької академії наук (1806), чужоземний почесний член Петербурзької АН (1826); його ім'я внесено до списку найвидатніших науковців Франції, розміщеного на першому поверсі Ейфелевої вежі. Відкрив газові закони, названі його ім'ям. Закон об'ємних відношень, за яким при постійних температурі і тиску об'єми газів, які вступають у реакцію, відносяться між собою і до об'ємів газоподібних продуктів реакції, як невеликі прості числа. Здійснив фундаментальні дослідження у галузі фізичної, органічної та неорганічної хімії.
Жозе́ф-Луї́ Гей-Люсса́к — (рос. Joseph Louis Gay-Lussac; *6 грудня 1778 — †9 травня 1850) — французький хімік іфізик, член Французької академії наук (1806), чужоземний почесний член Петербурзької АН (1826); його ім'я внесено до списку найвидатніших науковців Франції, розміщеного на першому поверсі Ейфелевої вежі. Відкрив газові закони, названі його ім'ям. Закон об'ємних відношень, за яким при постійних температурі і тиску об'єми газів, які вступають у реакцію, відносяться між собою і до об'ємів газоподібних продуктів реакції, як невеликі прості числа. Здійснив фундаментальні дослідження у галузі фізичної, органічної та неорганічної хімії.
Розрахуємо об’єми речовин з урахуванням нормальних умов.
Нормальні умови (скорочено н. у.) - стандартні набори умов для експериментальних вимірювань які створені для порівняння різних даних. Найбільш використовувані стандарти, належать Міжнародному союзу фундаментальної і прикладної хімії (IUPAC) і Національному інституту стандартів і технологій (NIST), хоча вони не є загальноприйнятими стандартами.
За IUPAC нормальні умови:
- температура 273,15 К (0°С, 32°F);
- абсолютний тиск 100,00 кПа (14,504 фунтів на квадратний дюйм, 0,987 атм, 1,000 бар).
|
Речовина |
Агрегатний стан |
Маса, г |
Густина, г\л |
Об’єм, л |
|
NaCl |
т. |
58,5 |
2160 |
0,027 |
|
H2O |
р. |
18 |
1000 |
0,018 |
|
O2 |
г. |
32 |
1,43 |
22,4 |
|
CO2 |
г. |
44 |
1,96 |
22,4 |
|
SO2 |
г. |
64 |
2,86 |
22,4 |
Ми розраховували об’єми речовин кількістю 1 моль. Знайшли закономірність: об’єми газів однакові.
За однакових умов рівні кількості різних газів займають рівні об’єми. За нормальних умов будь-який газ, близький за властивостями до ідеального газу (у газах розмірами молекул можна знехтувати, оскільки їх розміри незначні порівняно з міжмолекулярними відстанями) й кількість якого дорівнює один моль, займає об’єм 22,4 л .
Тобто, відношення ![]() для кожної газоподібної речовини – постійне і дорівнює 22,4. Це відношення названо молярним об’ємом:
для кожної газоподібної речовини – постійне і дорівнює 22,4. Це відношення названо молярним об’ємом:
Vm = ![]() = 22,4 л\моль; [Vm] = л\моль.
= 22,4 л\моль; [Vm] = л\моль.
Vm = ![]() =
= ![]() =
= ![]() = 22,4 л\моль.
= 22,4 л\моль.
Молярний об'єм ідеального газу за нормальних умов (273,15 К, 101325 Па) Vm = 22,41383(70)·10−3 м3/моль. У СІ молярний об'єм виражається в метрах кубічних на моль (м3/моль). У практичному використанні зручнішими одиницями є дециметри кубічні (літри) на моль (дм3/моль) для газів та сантиметри кубічні на моль для рідин та твердих тіл (см3/моль).
На підставі законів і своїх досліджень італійський учений Амедео Авогадро сформулював закон: В однакових об’ємах різних газів міститься однакова кількість молекул. На основі цього закону справедливим буде обернене твердження: Однакова кількість молекул різних газів за однакових умов займатиме однаковий об’єм.
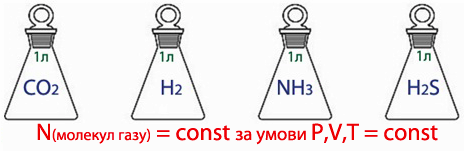
Знаючи молярний об’єм газу, можна визначати кількість речовини, об’єм будь-якої кількості речовини, масу та кількість структурних частинок в певному об’ємі газу.
З формули Vm=V/n → n=V/Vm, або n=V/22,4.
Знаючи, що N= NA∙n, можемо записати: N= NA∙V/22,4.
Окільки, 1) n=V/22,4, то m=M·V/22,4.
2) V=22,4·n і n=m/M, то V=m·22,4/M.
III. Формування вмінь і навичок
Приклад 1. Визначити за нормальних умов: а) кількість речовини SO2, що міститься в 3 л сірчистого газу; б) число молекул СО2, що міститься в 11,2 л вуглекислого газу; в) об’єм, що займає 32 г метану СН4; г) масу одного літра кисню.
Для розрахунків потрібно скористатися законом Авогадро, молярним об’ємом газів та сталою Авогадро, згідно яких маємо:

IV.Підведення підсумків уроку.
Газуваті речовини, як і рідини не мають власної форми, а набувають форми посудини, в яку їх помістили.
За різних температури і тиску 1 моль газуватої речовини займає різний об’єм.
За температури 0˚С і тиску 101,3кПа порція будь-якої газуватої речовини кількістю речовини 1 моль займає об’єм 22,4л. Ці умови дістали назву нормальних умов (н.у.), а об’єм – молярного об’єму
Vm = V/ n
Для обчислення об’єму порції газуватої речовини потрібно кількість речовини в цій порції помножити на молярний об’єм:
V = n ∙Vm
Закінчити речення:
- В однакових об’ємах різних газів міститься …
- Цей закон відкрив …
- Однакова кількість молекул різних газів займає …
- Один моль будь-якого газу за нормальних умов займає об’єм …
- Цей об’єм називають …
V. Домашнє завдання


про публікацію авторської розробки
Додати розробку
