Презентація: "Періодичний закон і електронна будова атома"
Про матеріал
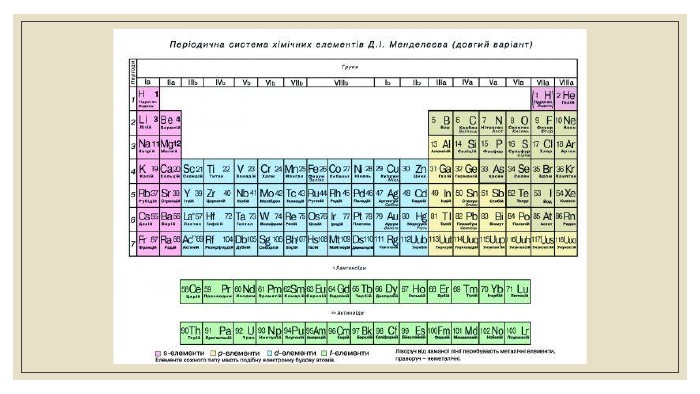
Історія розвитку уявлень про будову атома. Ядро атома. Протони, нейтрони.
Весь навколишній світ складається із речовин. У природі речовини бувають прості
та складні. Прості речовини складаються із однорідних атомів якого-небудь елемента.
Атомом називається найменша частка хімічного елемента, яка зберігає його
властивості. Всі речовини складаються із атомів, але атом не є найменшою неподільною
складовою частиною речовини, а складається із великої кількості більш дрібних, так
званих елементарних частинок, які мають різну природу та властивості.
Найбільш важливими із декількох сотен відомих елементарних частинок, які
визначають властивість елемента, є протони, нейтрони, електрони та позитрони.
Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку