Презентація по темі: "Галогени. Хлор"
Презентація по темі: "Галогени. Хлор".
Містить детальну інформацію щодо властивостей хлору за матеріалами підручника О.В. Григоровича

















{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Тип кристалічних граток. Характеристика Тип зв’язку Приклади речовин. Фізичні властивостіМолекулярна У вузлах кристалічних граток знаходяться полярні або неполярні молекули, зв’язані між собою слабкими силами електростатичного притягання Ковалентний Вода, амоніак, більшість органічних сполук. Невисокі температури плавлення й кипіння, нетверді, діелектрики, розчинні (з полярним типом зв’язку) і нерозчинні (з неполярним типом зв’язку), гази або рідини за кімнатної температури Атомна. У вузлах атомних кристалічних граток розміщені атоми, зв’язані між собою спільними електронними парами. Ковалентний неполярний. Алмаз, кремній, силіцій Високі температури плавлення й кипіння, тверді, крихкі, діелектрики або напівпровідники, нерозчинніЙонна У вузлах йонних кристалічних граток почергово розташовані позитивно й негативно заряджені йони. Йонний Більшість солей, оксидів, основ. Високі температури плавлення й кипіння, тверді, крихкі, діелектрики, у водних розчинах і розплавах – провідники, розчинніМеталічна. У вузлах металічних кристалічних граток поряд із нейтральними атомами розміщаються заряджені йони металів. Металічний Метали, сплави. Різні температури плавлення й кипіння, переважно високі, тверді, пластичні, провідники, нерозчинні у воді
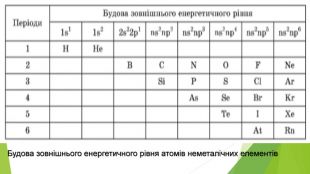
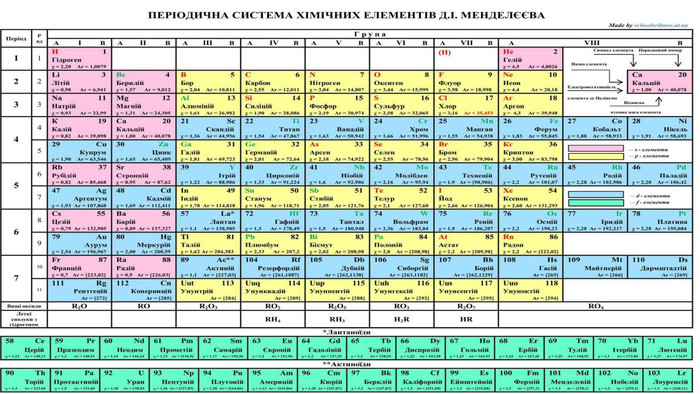
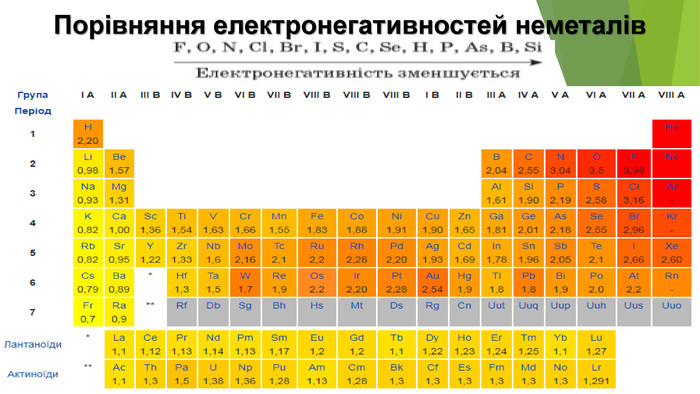
1. Загальна характеристика галогенів Галогенами називають хімічні елементи VIIA групи Періодичної системи — Флуор F, Хлор СІ, Бром Вг, Йод І і Астат At. Слово «галогени» утворено від грецьких слів галос — «сіль» і генос — «народжую» і означає «ті, що народжують солі». У XIX ст. Хлор так і називали — «солерод», підкреслюючи його здатність реагувати з металами з утворенням хлоридів — солей хлоридної кислоти. Аналогічні властивості характерні й для інших галогенів. У Флуору найбільша електронегативність, тому для нього характерні лише два ступені окиснення: 0 (у F2) і -1 (в усіх сполуках). Інші галогени виявляють різні ступені окиснення: як негативний -1 (із металічними елементами і Гідрогеном), так і позитивні ступені окиснення + 1, +3, +5, +7 (із Флуором і Оксигеном).
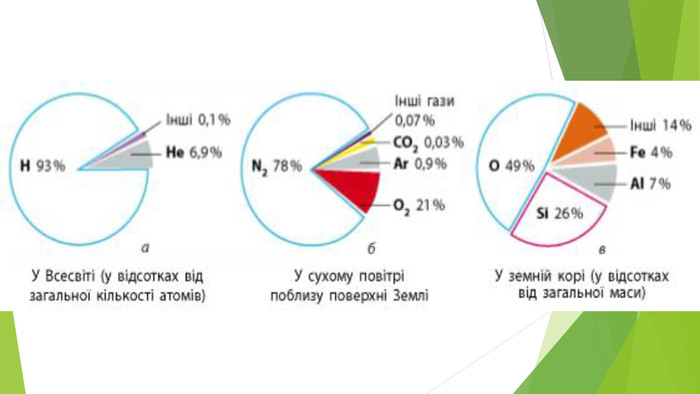
2. Фізичні властивості хлору за звичайних умов — зеленувато-жовтий газ (у перекладі з грецької його назва означає «зеленувато-жовтий»); має характерний різкий задушливий запах, що нагадує запах «хлорки»; за охолодження до -34°С хлор перетворюється на жовто-зелену рідину, а за -101°С переходить у твердий стан; приблизно у 2,5 разу важчий за повітря; за температури 20°С і нормального тиску в 1 об’ємі води розчиняється 3 об’єми хлору. Водний розчин хлору називають хлорною водою; отруйний, навіть у невеликих концентраціях подразнює слизову оболонку дихальних шляхів і спричиняє кашель. У випадку отруєння хлором слід вдихати випари суміші однакових об’ємів спирту й 10%-го розчину амоніаку.
3. Хімічні властивості хлору- Взаємодія з металами. Хлор — сильний окисник і підтримує горіння багатьох простих і складних речовин. Деякі речовини спалахують під час занурення в посудину з хлором. Активні метали, зокрема лужні, реагують із хлором без нагрівання: 2 К + Сl2 = 2 КСl Для реакції з хлором магній необхідно нагріти в полум’ї пальника. У хлорі він загоряється (хоча й не так блискуче, як на повітрі) з утворенням білого диму магній хлориду: Mg + Сl2 = Mg. Cl2 Залізо активно взаємодіє з хлором, якщо його заздалегідь розжарити, і окиснюється до ступеня окиснення +3. У посудині з хлором розжарені частинки заліза ще сильніше розігріваються, і в результаті реакції утворюється коричневий дим із дрібних кристаликів ферум(ІІІ) хлориду: 2 Fe + ЗСl2 = 2 Fe. Cl3 Хлор окиснює також і малоактивні метали, зокрема мідь. Розпечений до червоного мідний дріт у хлорі ще більше розжарюється та згоряє, наповнюючи колбу бурим димом, що складається з частинок купрум(ІІ) хлориду: Сu + Сl2 = Сu. Сl2
3. Хімічні властивості хлору- Взаємодія з неметалами Хлор активно взаємодіє з більшістю неметалів. Наприклад, фосфор займається у хлорі без нагрівання і згоряє сліпучим полум’ям. На стінках посудини утворюються безбарвні краплі фосфор(ІІІ) хлориду РСl3, які в надлишку хлору частково перетворюються на кристали вищого хлориду РСl5: 2 Р + ЗСl2 = 2 РСl3 РСl3 + Сl2 = РСl5 Водень на повітрі горить майже безбарвним полум’ям. Якщо газовідвідну трубку з воднем опустити в склянку з хлором, водень продовжує горіти, але полум’я змінює забарвлення на біле з ледь помітним зеленуватим відтінком. Поступово посудина наповнюється гідроген хлоридом, про утворення якого свідчить поява туману з отвору склянки: Н2 + Сl2 = 2 НСl Цікаво, що вугілля, яке швидко згоряє в кисні, із хлором не реагує. Хлор також не взаємодіє з киснем і азотом.
4. Застосування хлору Щорічно у світі виробляється близько 30 млн. тон хлору. Більша частина хлору йде на одержання гідроген хлориду і хлоридної кислоти. Багато хлору використовують для хлорування органічних речовин. Методом хлорування одержують різноманітні пластмаси, засоби захисту рослин, барвники, ліки, розчинники. Хлор використовують у виробництві хлорного вапна, хлораміну, для вибілювання лляних і бавовняних тканин, паперу. Навіть у невеликих кількостях хлор знищує хвороботворні бактерії, тому його нарівні з хлораміном і озоном застосовують для знезараження питної води. Перед подачею до водогону питну воду хлорують — розчиняють у ній певну кількість хлору (не більше 0,002 г на літр). Перш ніж хлорована вода потрапить до споживачів, увесь хлор встигає перетворитися на хлоридну кислоту. Її концентрація у водопровідній воді настільки мала, що вона не відчутна на смак і не шкідлива для організму. В Україні рідкий хлор виробляє підприємство AT «Дніпро. Азот».
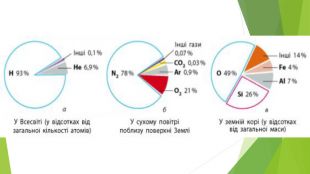
5. Біологічне значення галогенів. Флуор є життєво необхідним для організму людини елементом. В організмі людини Флуор міститься переважно в зубній емалі у складі флуорапатиту Ca5(PО4)3 F. За нестачі Флуору (<0,5 мг/л у питній воді) зубна емаль руйнується внаслідок вимивання Флуору з флуорапатиту, що є причиною карієсу. Надлишок Флуору (>1 мг/л у питній воді) спричиняє флюороз — захворювання зубів і кісток. Хлор — один із найважливіших біогенних елементів, він міститься у складі всіх живих організмів. У тварин і людини хлорид-йони беруть участь у гомеостазі — підтримці сталого складу біологічних рідин організмів. У шлунку людини хлорид-йони створюють сприятливе середовище для дії ферментів шлункового соку. Хлор — життєво важливий елемент для рослин. Він необхідний для утворення кисню в процесі фотосинтезу, поглинання коренями кисню, сполук Калію, Кальцію, Магнію. Але надмірна концентрація хлорид-йонів у рослинах, що виникає в разі засоленого ґрунту, знижує вміст хлорофілу та активність фотосинтезу, сповільнює ріст і розвиток рослин. Бром у вигляді простої речовини дуже шкідливий. Уже за вмісту випарів брому в повітрі близько 0,001% (за об’ємом) відбувається подразнення слизових оболонок, запаморочення, а за більших концентрацій — судоми м’язів горла. Рідкий бром у разі потрапляння на шкіру спричиняє хворобливі опіки. Сполуки Брому мають заспокійливу дію, їх використовують для виготовлення спеціальних лікарських препаратів. Йод міститься в усіх живих організмах. Його вміст у рослинах залежить від умісту сполук Йоду в ґрунті й воді. Деякі морські водорості (морська капуста, або ламінарія, фукус тощо) накопичують до 1% Йоду. У тварин і людини Йод міститься у складі тиреоїдних гормонів щитоподібної залози — тироксину і трийодтироніну, які мають багатобічну дію на ріст, розвиток і обмін речовин організмів.
1. Схарактеризуйте місце елементів-галогенів у Періодичній системі та їхні загальні властивості. 2. Чому для Флуору можливі лише два ступені окиснення? 3. Який із галогенів є найсильнішим окисником? 4. Схарактеризуйте фізичні й хімічні властивості та застосування хлору.5. Схарактеризуйте біологічне значення галогенів. 6. Порівняйте хімічну активність хлору з активністю інших галогенів.7. Для рівняння реакції хлору з воднем складіть електронний баланс, укажіть окисник і відновник. 8. Зобразіть розподіл електронів на зовнішньому енергетичному рівні атомів Хлору в основному та збудженому станах. Схарактеризуйте можливі валентні стани та ступені окиснення Хлору. 9. Визначте ступені окиснення Хлору в сполуках: СІ2, НСІ, Na. CI, АІСІ3, РСІ5, CIF3, СІ2 О, КСІО3, НСІО2, Мg(СІО4)2. 10. Складіть електронний баланс для реакцій. Укажіть окисник і відновник: а) КСІО3 + НСІ -> КСІ + СІ2 + Н2 О; б) РЬО2 + НСІ -> РЬСІ2 + СІ2 + Н2 О; в) КМn. О4 + НСІ -> Мn. СІ2 + СІ2 + КСІ + Н2 О. 11. Силіцій реагує з хлором, утворюючи вищий хлорид. Складіть рівняння реакції, електронний баланс для неї, укажіть окисник і відновник. 12. Етин в атмосфері хлору горить кіптявим полум'ям. Складіть рівняння цієї реакції.
13. У скільки разів хлор важчий за повітря? Обчисліть густину хлору за нормальних умов. 14. Густина хлору за температури 20°С становить 2,96 г/л. За цих умов в одному об'ємі води максимально розчиняється три об'єми хлору. Обчисліть масову частку хлору в насиченому розчині. 15. Хлор добре розчиняється в органічних розчинниках, наприклад, у тетрахлорометані: у 100 мл розчинника за температури 20°С розчиняється 5480 мл хлору. Обчисліть масову частку хлору в цьому розчині, якщо відомо, що густина тетрахлорометану дорівнює 1,63 г/мл, а хлору — 2,96 г/л. 16. Який об'єм хлору необхідний для реакції з воднем об'ємом 25 л? Який об'єм хлороводню утвориться?17. Під час взаємодії фосфору з хлором одержали фосфор(ІІІ) хлорид масою 13,75 г. Обчисліть об'єм витраченого хлору (н. у.), якщо відносний вихід продукту реакції становить 75%. 18. Гідроген хлорид, одержаний спалюванням водню об'ємом 10 л (н.у.) у хлорі, розчинили у воді об'ємом 1 л. Обчисліть масову частку кислоти в отриманому розчині. 19. Обчисліть об'єм хлору (н. у.), що утвориться під час взаємодії хлоридної кислоти з манган(І\/) оксидом масою 17,4 г, якщо відносний вихід продукту реакції становить 80%. Взаємодія відбувається за схемою: НСІ + Мп. О2 -> Мп. СІ2 + СІ2 + Н2 О. 20. Хлоровмісні суміші часто застосовують для вибілювання бавовни, паперу та інших матеріалів вуглеводної природи. Але вони непридатні для відбілювання вовни й шовку. Запропонуйте пояснення цього факту. 21. Карл Шеєлє, який відкрив хлор 1774 року, писав про нього так: «Комахи в ньому негайно гинуть», «Синій лакмусовий папір стає майже білим, усі червоні, сині квіти й навіть зелені рослини жовтіють», «Ані луги, ані кислоти вже не відновлюють первісного забарвлення квітів і листя». Які властивості хлору описав Шеєлє?
Міні-проекти1. У додаткових джерелах знайдіть інформацію щодо способів знезараження питної води без використання хлору та сполук Хлору. Порівняйте їх із хлоруванням води. Визначте переваги та недоліки цих методів. 2. Дослідіть властивості будь-якого комерційно доступного хлоровмісного побутового засобу для вибілювання. Дотримуйтеся правил безпеки: • працювати необхідно обов'язково в гумових рукавичках; • у разі потрапляння засобу на шкіру необхідно негайно змити речовину під струменем води; • уникайте потрапляння засобу на металеві поверхні. Приготуйте розчин вибілювача згідно з рекомендаціями в інструкції до цього засобу. Випробуйте дію приготованого розчину (кімнатної температури та теплого) на кольорових тканинах, кольоровому папері, пелюстках квіток. На невеликих аркушах білого паперу зробіть написи кольоровими ручками, олівцями й фломастерами різних типів. Перевірте дію на них вибілюючого засобу. Після перебування всіх предметів у вибілюючому розчині ретельно промийте їх під струменем води. Поясніть свої спостереження.
-
 Derkachova Anna 20.11.2022 в 12:29Загальна:4.7Структурованість5.0Оригінальність викладу4.0Відповідність темі5.0
Derkachova Anna 20.11.2022 в 12:29Загальна:4.7Структурованість5.0Оригінальність викладу4.0Відповідність темі5.0

про публікацію авторської розробки
Додати розробку