Презентація по темі: "Металічний зв'язок"
Про матеріал
Презентація по темі: "Металічний зв'язок".
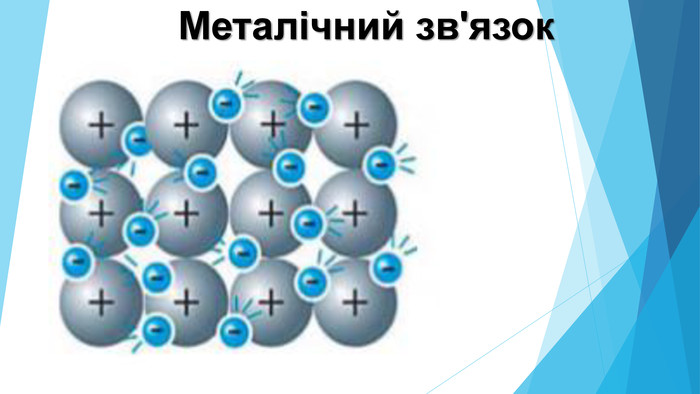
Механізм утворення та особливості металічного зв'язку. Перегляд файлу
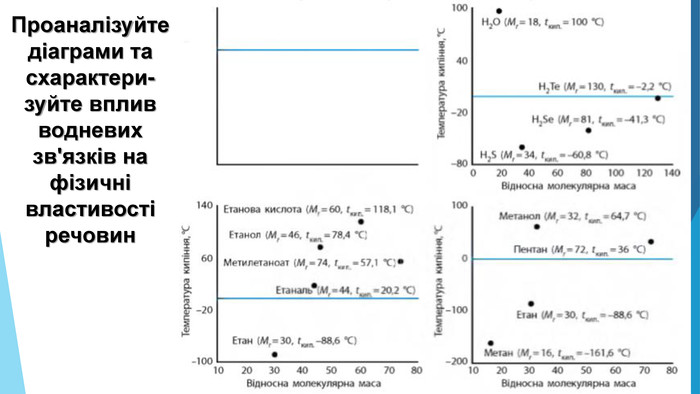
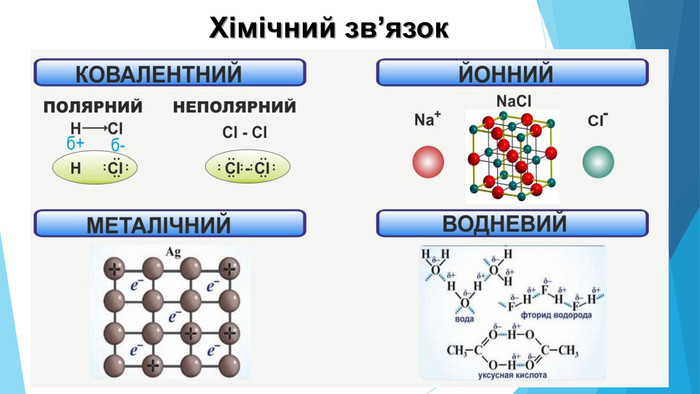
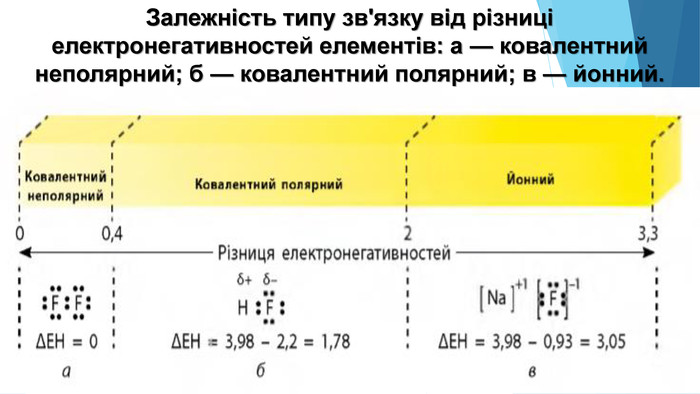
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку


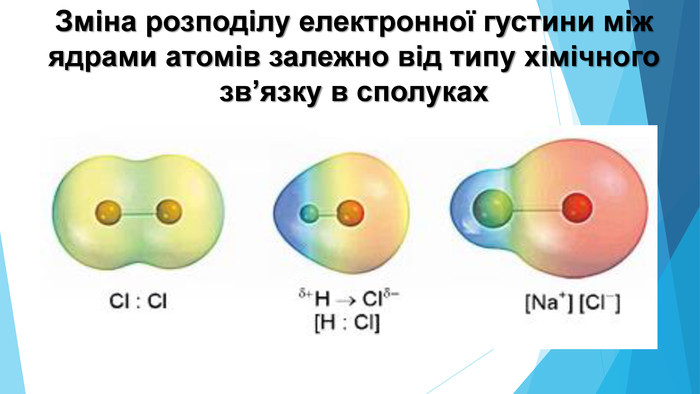
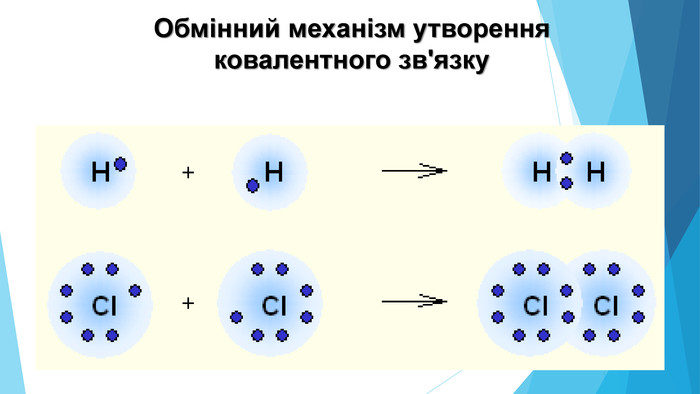
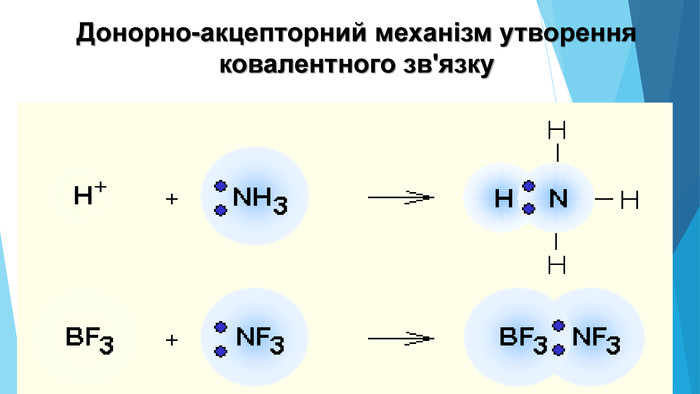


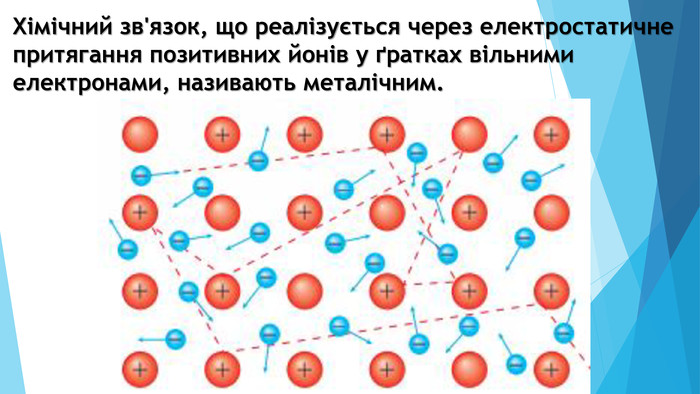
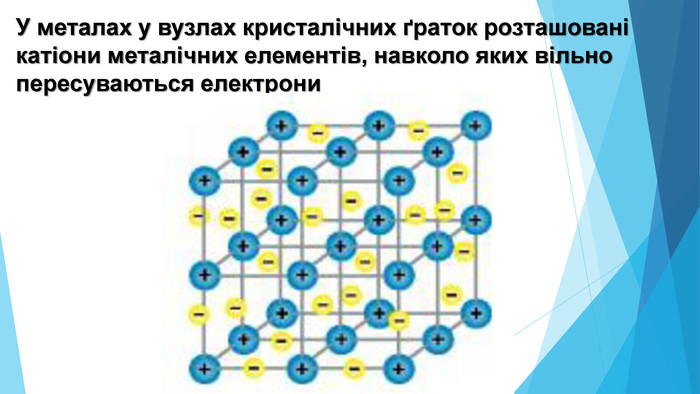



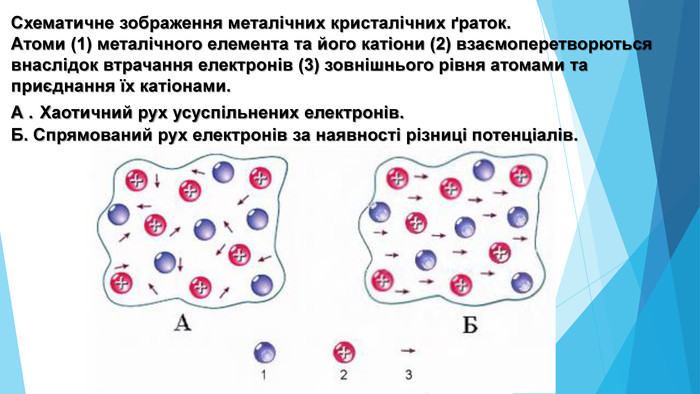

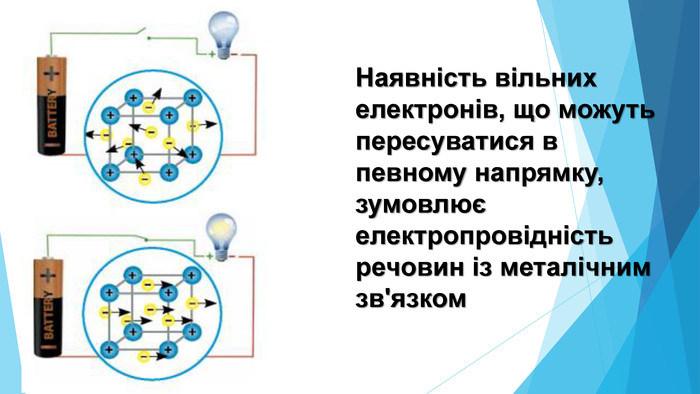



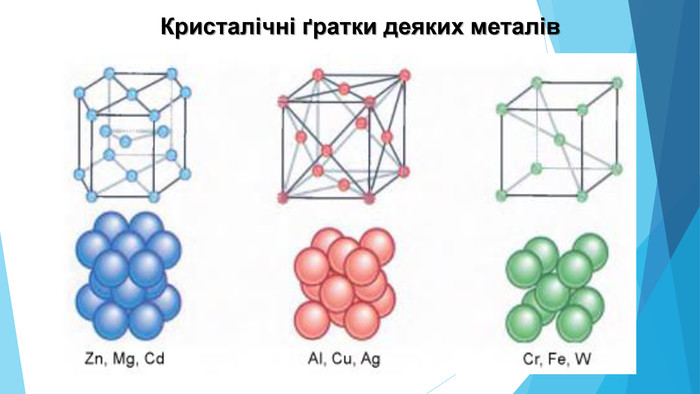
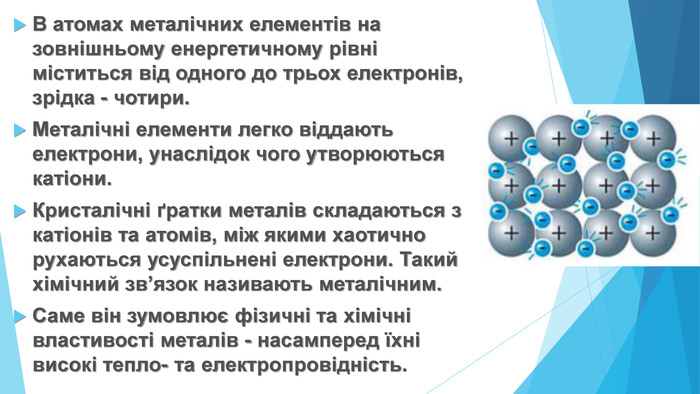

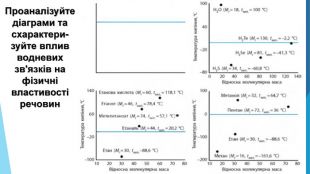
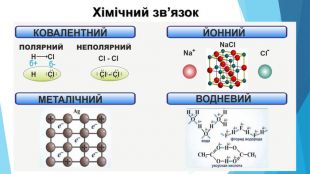


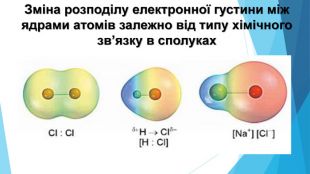
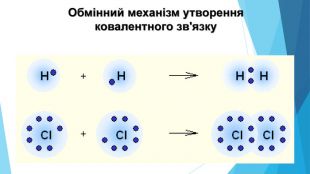
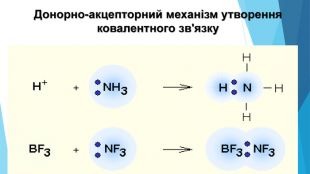
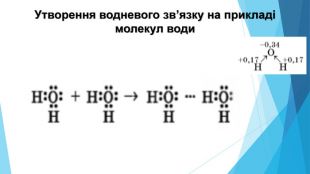
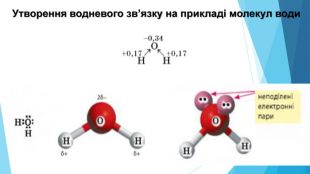
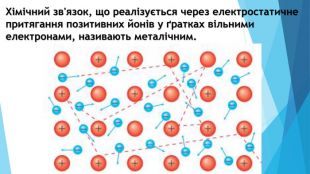
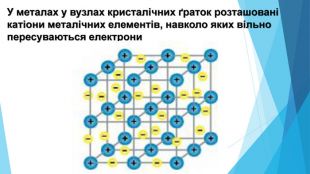



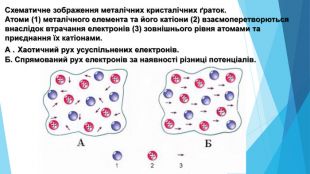
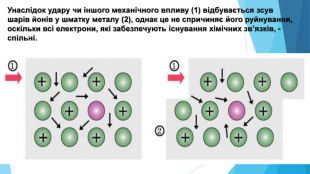
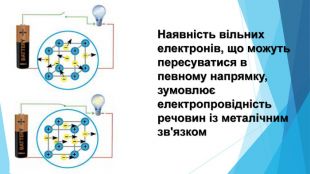
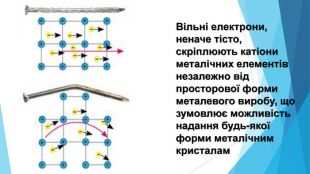


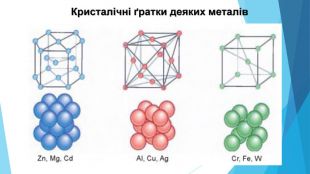

-

Жорняк Антоніна
22.11.2024 в 09:30
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Д'яченко Галина Володимирівна
08.10.2024 в 21:57
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Остаповець Юрій
08.10.2023 в 19:34
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Бузницька Ольга Миколаївна
10.09.2023 в 14:59
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Бабицька Валентина Петрівна
11.10.2022 в 17:24
Загальна:
4.0
Структурованість
4.0
Оригінальність викладу
4.0
Відповідність темі
4.0
-

Шевченко Світлана Василівна
11.10.2022 в 10:57
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Марышев Сергей
07.10.2022 в 06:10
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Мараренко Валентина Миколаївна
06.10.2022 в 08:32
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Каній Марія Антонівна
01.11.2021 в 20:09
Загальна:
4.7
Структурованість
4.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Степаненко Тетяна Іванівна
30.10.2020 в 18:36
Загальна:
4.7
Структурованість
4.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Куделя Григорий Павлович
08.11.2019 в 18:19
Загальна:
4.3
Структурованість
4.0
Оригінальність викладу
5.0
Відповідність темі
4.0
Показати ще 8 відгуків