Презентація по темі: "Окисні та відновні властивості неметалів" (2 год)
Презентація по темі: "Окисні та відновні властивості неметалів" (2 год).
За підручником Ярошенко О.Г.





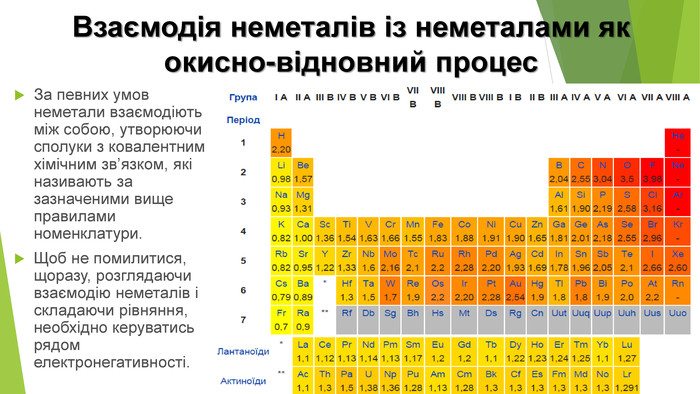












Складання формул бінарних сполук. Формули та назви бінарних сполук складають за такими загальними правилами номенклатури: ♦ зазвичай першим пишуть символ менш електронегативного елемента (з позитивним ступенем окиснення), а після нього — більш електронегативного (з негативним ступенем окиснення); ♦ першим називають у називному відмінку менш електронегативний елемент (елемент з позитивним ступенем окиснення); ♦ якщо елемент проявляє змінну валентність, її зазначають у назві римською цифрою; ♦ другою зазначають у називному відмінку назву більш електронегативного елемента (з негативним ступенем окиснення), тобто неметалічного, додаючи при цьому суфікси -ид або -ід.
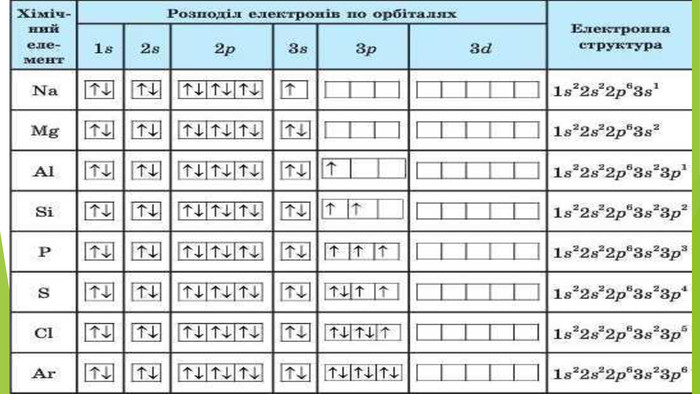
А як змінилася будова електронних оболонок атомів Магнію та Оксигену в утвореній сполуці? Як бачимо, зовнішні енергетичні рівні обох атомів набули завершеної конфігурації: Магнію — за рахунок віддавання двох електронів, Оксигену — за рахунок їх приєднання. Окисно-відновні процеси в інших наведених рівняннях взаємодії неметалів із металами розгляньте, попрацювавши групами.
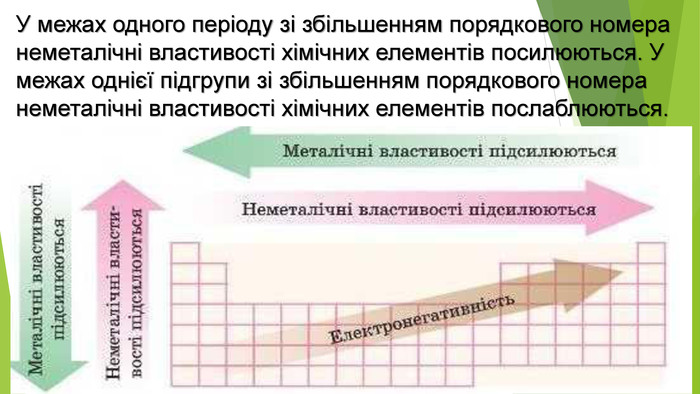
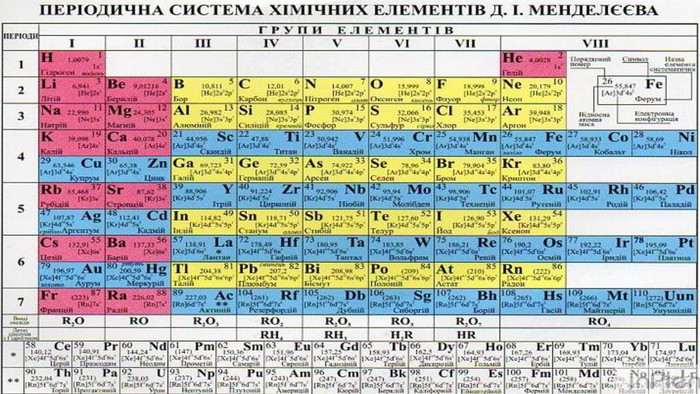
Взаємодія неметалів із неметалами як окисно-відновний процес. За певних умов неметали взаємодіють між собою, утворюючи сполуки з ковалентним хімічним зв’язком, які називають за зазначеними вище правилами номенклатури. Щоб не помилитися, щоразу, розглядаючи взаємодію неметалів і складаючи рівняння, необхідно керуватись рядом електронегативності.
Взаємодія із воднем. В атома Сульфуру до завершення зовнішнього енергетичного рівня не вистачає двох електронів, а в атома Гідрогену — одного. За рахунок утворення Сульфуром двох спільних електронних пар із двома атомами Гідрогену зовнішній енергетичний рівень електронної оболонки атома Сульфуру стає завершеним. Оскільки Сульфур більш електронегативний, то спільні електронні пари зміщуються в бік його атома і зв’язок, що утворився, є ковалентним полярним:
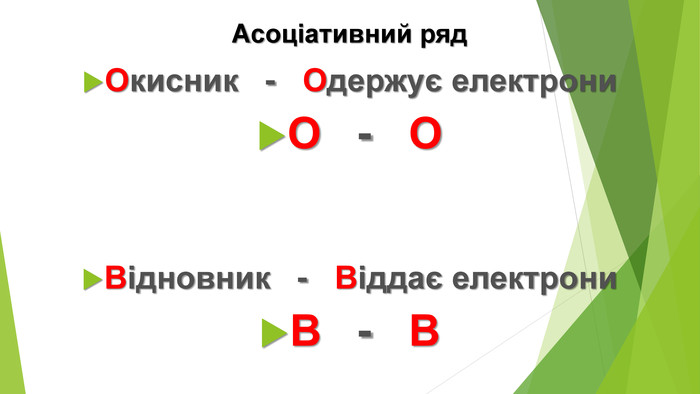
Розв’язування вправ:1. Складіть електронні баланси до рівнянь реакцій:2. Установіть, який елемент е окисником, а який — відновником. Зазначте процеси окиснення і відновлення. 3. До якого з відомих вам типів хімічних реакцій, крім окисно-відновних, належать реакції металів із неметалами?
7. Наведіть приклад реакції, у якій сірка виявляє: а) окисні властивості; б) відновні властивості.8. Як дізнатись, у якого неметалічного елемента бінарної сполуки ступінь окиснення є позитивним, а у якого — негативним? 9. Пригадайте з 10 класу, які неметали використовують для перетворення каучуку на гуму та під час виготовлення автомобільних шин.10. Складіть таблицю з такими рубриками: назва неметалу; застосування; властивість, що зумовлює застосування.11. Окисні чи відновні властивості виявляє азоту реакції з киснем, продуктом якої є нітроген(ІІ) оксид? Відповідь підтвердьте рівнянням реакції та електронним балансом.12. Обґрунтуйте, чому неметали в реакціях з металами виявляють окисні властивості.
13. Обчисліть, яку масу міді можна відновити вуглецем (коксом) з купрум(І) оксиду кількістю речовини 8 моль. Обчисліть, чи вистачить 112л водню (н. у.) для відновлення цинку із цинк оксиду масою 225 г.14. Який неметал у хімічних реакціях є лише окисником? Чи існують неметали, яким притаманні тільки відновні властивості? Відповіді обґрунтуйте. 115. Допишіть схеми реакцій і перетворіть їх на хімічні рівняння:
16. Сірка вступає в реакції з воднем і киснем. Напишіть відповідні хімічні рівняння, складіть схеми окиснення й відновлення. Яку роль виконує Сульфур у кожній реакції?17. Складіть рівняння реакції фтору з водою, врахувавши, що одним із продуктів є проста речовина, поширена в атмосфері. 18. Вуглець за високої температури реагує з водяною парою. Які речовини мають бути продуктами цієї реакції — СО і Н2 чи СН4 і О2? Відповідь обґрунтуйте, наведіть відповідне хімічне рівняння. 19. Складіть рівняння реакцій хлору з калієм, цинком, алюмінієм, силіцієм, фосфором. Зважте на те, що Силіцій і Фосфор у продуктах відповідних реакцій мають найвищі ступені окиснення. 20. Запишіть замість крапок відповідні цифри і слова:
21. Перетворіть схеми реакцій на хімічні методом електронного балансу:22. Між двома найактивнішими галогенами можуть відбуватися реакції з утворенням сполук АБ, АБ3 і АБ5. Розшифруйте формули сполук, записавши в них символи елементів. Візьміть до уваги, що кожна літера відповідає певному галогену. Поясніть свій вибір.23. Обчисліть об’єм (м3) (н. у.) сульфур(ІV) оксиду, який утвориться внаслідок спалювання на ТЕЦ вугілля масою 1 т, масова частка сірки в якому становить 1,6 %. 24. Обчисліть: а) масу (г) продукту реакції, для проведення якої було взято залізо масою 5,6 г і хлор об’ємом 2,24 л (н. у.); б) відносний вихід (%) реакції синтезу амоніаку, якщо з азоту об’ємом 2000 м3 було добуто амоніак об’ємом 1500 м3 (об’єми газів виміряно за однакових умов); в) масу (г) нітроген(ІІ) оксиду, який утвориться внаслідок реакції між азотом масою 560 г і киснем такої самої маси, якщо вихід продукту реакції становить 5 % від теоретичного.
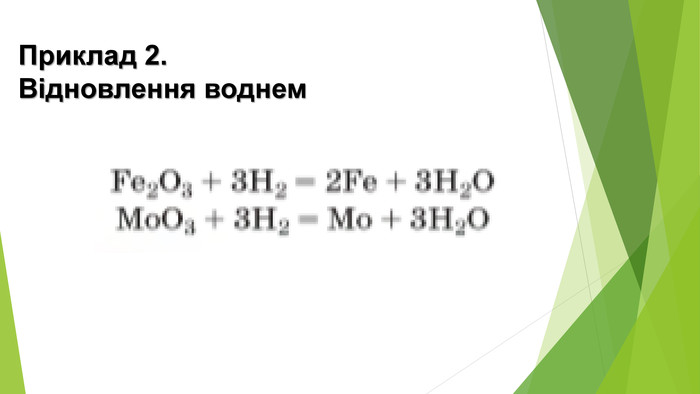
25. Доберіть коефіцієнти методом електронного балансу. Укажіть окисник і відновник.26. Складіть рівняння реакцій відновлення воднем плюмбум(ІІ) оксиду, купрум(ІІ) оксиду, нітроген(ІУ) оксиду до простих речовин. Доберіть до них коефіцієнти методом електронного балансу. Назвіть окисники й відновники.


про публікацію авторської розробки
Додати розробку























-

Половинка Юлія
21.10.2023 в 16:25
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Переверзева Інна Євгенівна
27.11.2022 в 22:44
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Арсенюк Наталія
23.11.2022 в 22:37
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Лисенко Надія Ол.
14.12.2021 в 00:05
Загальна:
4.3
Структурованість
4.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Мішина Лілія Михайлівна
12.04.2020 в 10:52
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
4.0
Показати ще 2 відгука