Презентація "Поняття про кристалогідрати."










![Мал. Природні кристалогідрати: а - гіпс; б - лимонна кислота; в - мідний купорос; г - залізний купорос. Кристалогідрати солей Купруму(ІІ) зазвичай мають блакитний або зелений колір, безводні солі - білий. Більшість сполук Хрому(ІІІ) утворюють кристалогідрати зеленого кольору. Однак трапляються винятки. Кристалогідрати хром(ІІІ) хлориду, загальна формула яких Сr. Сl3 · 7 Н2 О, мають різне забарвлення. Хромово-калієвий галун KCr(SO4)2 · 12 Н2 О фіолетовий. Жовта кров’яна сіль K4[Fe(CN)6] · 12 Н2 О забарвлена в жовтий колір. Безводні солі Кобальту(ІІ) - речовини синього кольору, їхні кристалогідрати - рожевого або червоного. Сульфат Нікелю(ІІ) кристалізується з водного розчину із сімома молекулами води, кристалогідрат Ni. SO4 · 7 Н2 О - смарагдово-зелені кристали, добре розчинні у воді, безводний нікель(ІІ) сульфат має значно світліше забарвлення. Мал. Природні кристалогідрати: а - гіпс; б - лимонна кислота; в - мідний купорос; г - залізний купорос. Кристалогідрати солей Купруму(ІІ) зазвичай мають блакитний або зелений колір, безводні солі - білий. Більшість сполук Хрому(ІІІ) утворюють кристалогідрати зеленого кольору. Однак трапляються винятки. Кристалогідрати хром(ІІІ) хлориду, загальна формула яких Сr. Сl3 · 7 Н2 О, мають різне забарвлення. Хромово-калієвий галун KCr(SO4)2 · 12 Н2 О фіолетовий. Жовта кров’яна сіль K4[Fe(CN)6] · 12 Н2 О забарвлена в жовтий колір. Безводні солі Кобальту(ІІ) - речовини синього кольору, їхні кристалогідрати - рожевого або червоного. Сульфат Нікелю(ІІ) кристалізується з водного розчину із сімома молекулами води, кристалогідрат Ni. SO4 · 7 Н2 О - смарагдово-зелені кристали, добре розчинні у воді, безводний нікель(ІІ) сульфат має значно світліше забарвлення.](/uploads/files/1463499/307492/334227_images/12.jpg)


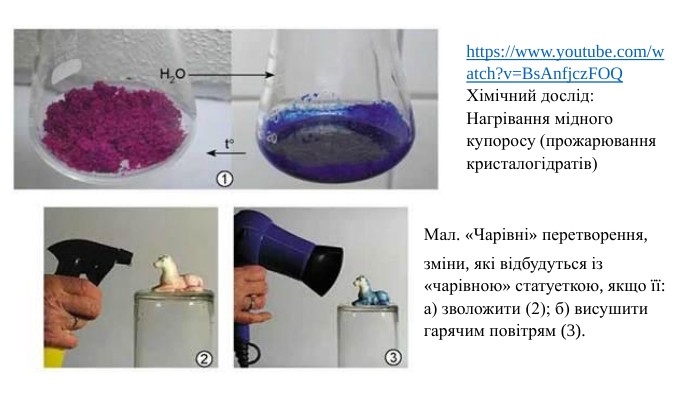




Тема заняття.1. Повторення навчальної інформації за § 6. «Розчинність речовин, її залежність від різних чинників». Підручник з Хімії. 9 клас. Григорович О. В. - Нова програма. https://uahistory.co/pidruchniki/grygorovich-chemistry-9-class-2017/7.php та частково ( до масова частка розчиненої речовини) за § 7. «Характеристики розчинів». Підручник з Хімії. 9 клас. Григорович О. В. - Нова програма. https://uahistory.co/pidruchniki/grygorovich-chemistry-9-class-2017/8.php 2. Ознайомлення з навчальною інформацією (частково) за § 4. «Будова молекули води. Розчинення речовин у воді. Кристалогідрати». Підручник з Хімії. 9 клас. Григорович О. В. - Нова програма. https://uahistory.co/pidruchniki/grygorovich-chemistry-9-class-2022-reissue/5.php https://www.youtube.com/watch?v=Bs. Anfjcz. FOQ Хімічний дослід: Нагрівання мідного купоросу (прожарювання кристалогідратів)3. Ознайомлення з умовами домашнього завдання.
Домашнє завдання.1. Повторити навчальну інформацію за § 6. «Розчинність речовин, її залежність від різних чинників». Підручник з Хімії. 9 клас. Григорович О. В. - Нова програма. https://uahistory.co/pidruchniki/grygorovich-chemistry-9-class-2017/7.php 2. Вивчити (частково) навчальну інформацію за § 4. «Будова молекули води. Розчинення речовин у воді. Кристалогідрати». Підручник з Хімії. 9 клас. Григорович О. В. - Нова програма. https://uahistory.co/pidruchniki/grygorovich-chemistry-9-class-2022-reissue/5.php 3. Виконати письмові завдання домашньої роботи.
Повторення навчальної інформації. Основні поняття. Розчинність речовин. Класифікація речовин за розчинністю у воді. Межі розчинності речовин. Таблиця розчинності кислот, солей і гідроксидів у воді. Необмежено розчинні у воді речовини. Осад. Чинники, від яких залежить розчинність речовин у воді. - Наведіть приклади розчинних і нерозчинних у воді кислот.- Наведіть приклади нерозчинних, малорозчинних та розчинних солей. Які ви знаєте рідини й гази, що добре розчиняються у воді?Наведіть приклади речовин, розчинність яких у разі нагрівання: а) збільшується; б) зменшується; - Один з головних принципів від алхіміків, що визначає розчинність речовин. У воду випадково потрапив бензин. Як його можна виокремити від води? Чи буде вода мати запах бензину, якщо розділення проводити шляхом: а) відстоювання; б) дистиляції?Які з наведених газів - кисень, гідроген хлорид, азот, амоніак, гелій - можна збирати: а) над водою; б) тільки витісненням повітря? Чому?Чому акваріуми не можна наповнювати кип'яченою водою?
При кип’ятінні розчинність газів у воді зменшується. Тому кип’ячена вода містить мало кисню. Риби можуть загинути від нестачі кисню для дихання. Воду і бензин можна розділити відстоюванням. Оскільки бензин є легшим за воду, через деякий час він збирається у вигляді тонкої плівки на поверхні води. Після цього рідини можна відокремити за допомогою ділильної лійки. Але при цьому вода може мати деякі домішки бензину і - відповідно - його запах. За дистиляції відокремлення бензину і води буде більш повним. Запаху бензину у води після дистиляції бути не повинно. Витісненням повітря можна збирати ті гази, відносна молекулярна маса яких більша за середню відносну молекулярну масу газів, що входять до складу повітря (Мr(пов.) = 29). З переліку в умові це кисень (Мr(О2) = 32), гідроген хлорид (Мr(НСl) = 36,5) та вуглекислий газ (Мr(СО2) = 44). Амоніак (Mr(NH3) = 17), азот (Mr(N2) = 28) та гелій (Мr(Не) = 4), як більш легкі за повітря гази, слід збирати над водою. Підказки.
Основні поняття. Концентровані й розбавлені розчини. Насичені й ненасичені розчини. Чим відрізняються розведений і концентрований розчини? Який розчин називають насиченим? Ненасиченим? Пересиченим? Як приготувати насичений розчин; ненасичений розчин. Чи завжди розведений розчин є ненасиченим, а концентрований - насиченим? Як зробити насичений розчин ненасиченим, і навпаки?Чи можна приготувати розчин, що є одночасно і насиченим, і розбавленим? і концентрованим, і ненасиченим? Наведіть приклади.
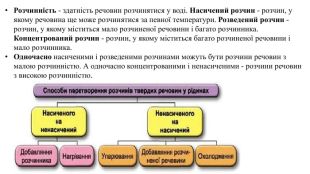
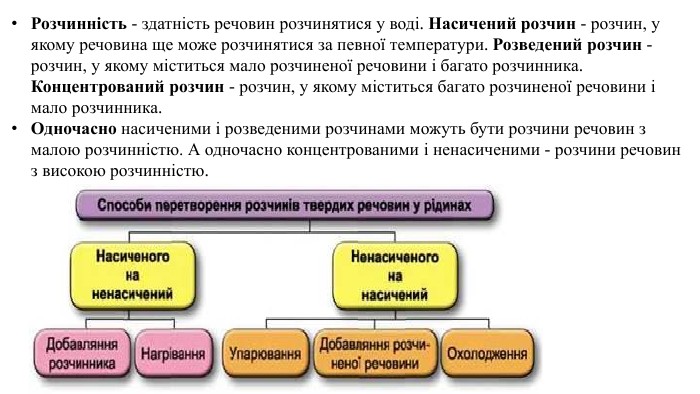
Розчинність - здатність речовин розчинятися у воді. Насичений розчин - розчин, у якому речовина ще може розчинятися за певної температури. Розведений розчин - розчин, у якому міститься мало розчиненої речовини і багато розчинника. Концентрований розчин - розчин, у якому міститься багато розчиненої речовини і мало розчинника. Одночасно насиченими і розведеними розчинами можуть бути розчини речовин з малою розчинністю. А одночасно концентрованими і ненасиченими - розчини речовин з високою розчинністю.
Кристалогідрати. У складі деяких солей іноді містяться молекули води. Речовин, у складі яких, крім солей, міститься вода, існує доволі багато, усі вони мають кристалічну будову, їх називають кристалогідратами. Воду, що міститься у складі кристалогідратів, називають кристалізаційною. Cu. SO4 · 5 H2 Oмідний купорос. Кристалогідрати - це нестійкі кристалічні речовини, що складаються із солі та кристалізаційної води в певному стехіометричному співвідношенні. Наприклад, мідний купорос - це кристалічна речовина, що складається з купрум(ІІ) сульфату й води. Але на відміну від розчину купрум(ІІ) сульфату, у якому співвідношення солі й води може бути будь-яким, у мідному купоросі на кожну формульну одиницю купрум(ІІ) сульфату припадає п’ять молекул води. Це істотно відрізняє мідний купорос від розчину купрум(ІІ) сульфату. Отже, мідний купорос - це індивідуальна хімічна сполука з певною хімічною формулою, а не механічна суміш двох речовин.
Кристалогідрати утворюються за умови, коли в кристалічних ґратках між катіонами й молекулами води виникає міцніший зв’язок, ніж зв’язок між катіонами й аніонами в кристалі безводної солі. За низьких температур молекули води в кристалогідратах можуть бути сполучені як із катіонами, так і з аніонами. Багато які солі, кислоти й основи кристалізуються з водних розчинів у формі кристалогідратів. Є сполуки, які можуть існувати лише у формі кристалогідрату. Віддаючи кристалізаційну воду, вони розкладаються. Відомо багато кристалогідратів. Серед них - гіпс Ca. SO4 • 2 Н2 О або кальцій сульфат дигідрат, залізний купорос Fe. SO4 • 7 Н2 О або ферум(II) сульфат гептагідрат, гірка сіль Mg. SO4 • 7 Н2 О або магній сульфат гептагідрат, кристалічна сода Na2 CO3 • 10 Н2 О або натрій карбонат декагідрат. карналіт Mg. Cl2 · КСl · 6 Н2 О тощо. Деякі з них добувають у лабораторіях. Чимало солей, які виготовляють на хімічних заводах і постачають у хімічні лабораторії, є кристалогідратами. Серед реактивів, що зберігаються в шкільному хімічному кабінеті, ви не знайдете безводних барій хлориду, магній сульфату, алюміній нітрату та багатьох інших розчинних солей. На етикетках упаковок із речовинами побачите формули Ва. Сl2 • 2 Н2 О, Mg. SO4 • 7 Н2 О, Al(NO3)3 • 9 Н2 О. Знак «·» у формулах кристалогідратів не є знаком множення.
У назвах кристалогідратів використовують грецькі назви числівників: один - моно-, два - ди-, три - три-, чотири - тетра-, п’ять - пента-, шість - гекса-, сім - гепта-, вісім - окта-, дев’ять - нано-, десять - дека-. Приклади назв та формул. Cu. SO4 • 5 Н2 О (вимовляємо: купрум-ес-о-чотири-на-п’ять-аш-два-о). Тривіальна назва сполуки мідний купорос.(Сполуку використовують у сільському господарстві для боротьби зі шкідниками та хворобами рослин), а хімічна - купрум(II) сульфат пентагідрат. У назвах таких речовин до слова «гідрат» додають префікс, що походить від грецьких числівників: моно- (1), ди- (2), три- (3), тетра- (4), пента- (5), гекса- (6), гепта- (7), окта- (8), нона- (9) (Префікс «нона» походить від латинської назви числівника) , дека- (10) і т. д. Крапка в хімічній формулі означає, що мідний купорос - це сполука купрум(II) сульфату і води, а не суміш цих речовин чи водний розчин купрум(ІІ) сульфату. У сполуці на кожну пару йонів - Сu2+ і SO42- припадає п’ять молекул води. Кристалогідратами є багато природних мінералів. Трапляються кристалогідрати, у яких на одну формульну одиницю речовини припадає від 1 до 12 молекул води, проте найбільш поширені кристалогідрати з 2, 4, 6, 8 молекулами води.
Мал. Природні кристалогідрати: а - гіпс; б - лимонна кислота; в - мідний купорос; г - залізний купорос. Кристалогідрати солей Купруму(ІІ) зазвичай мають блакитний або зелений колір, безводні солі - білий. Більшість сполук Хрому(ІІІ) утворюють кристалогідрати зеленого кольору. Однак трапляються винятки. Кристалогідрати хром(ІІІ) хлориду, загальна формула яких Сr. Сl3 · 7 Н2 О, мають різне забарвлення. Хромово-калієвий галун KCr(SO4)2 · 12 Н2 О фіолетовий. Жовта кров’яна сіль K4[Fe(CN)6] · 12 Н2 О забарвлена в жовтий колір. Безводні солі Кобальту(ІІ) - речовини синього кольору, їхні кристалогідрати - рожевого або червоного. Сульфат Нікелю(ІІ) кристалізується з водного розчину із сімома молекулами води, кристалогідрат Ni. SO4 · 7 Н2 О - смарагдово-зелені кристали, добре розчинні у воді, безводний нікель(ІІ) сульфат має значно світліше забарвлення.
Мал. Веселковий розмай кристалогідратів. 1. Мідний купорос - купрум(ІІ) сульфат пентагідрат. 2. Купрум(ІІ) хлорид дигідрат. 3. Кристалогідрати хром(ІІІ) хлориду. Склад і будова мають значення! 4. Хромово-калієвий галун. 5. Жовта кров’яна сіль. 6. Безводний кобальт(ІІ) хлорид (а) і кобальт(ІІ) хлорид гексагідрат (б). 7. Нікель(ІІ) сульфат гептагідрат (а) і безводний нікель(ІІ) сульфат (б)
Склад кристалогідратів описують формулами, що показують, яку кількість кристалізаційної води містить кристалогідрат. Цифри у формулах кристалогідратів перед молекулами води можуть бути різними, і в назві їх указують за допомогою префіксів, утворених в основному від грецьких числівників (іноді від латинських). Префікси, утворені з коренів грецьких (і деяких латинських) числівників. Назвіть кристалогідрат, формула якого: а) K2 SO3 · 2 Н2 О: б) Zn. SO4 · 7 Н2 О; в) Al(NO3)3 · 9 Н2 О; г)Mg. Cl2 · 6 Н2 О; ґ) Ba(NO3)2 · Н2 О; д) Ca(NO3)2 · 4 Н2 О. Складіть формули: а) кристалогідрату берилій нітрату, в якому на кожний катіон припадає чотири молекули води; Be(NO3)2*4 H2 O; б) кристалогідрату магній хлориду, якщо молекул води у сполуці удвічі більше, ніж усіх йонів. Mg. Cl2 * 6 H2 O;
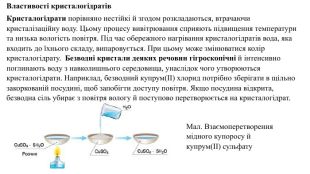
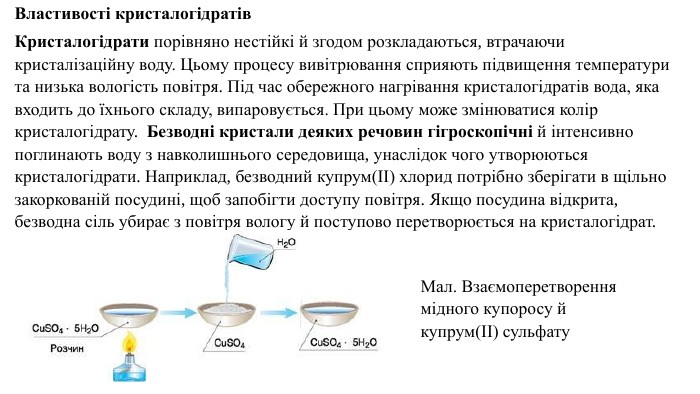
Властивості кристалогідратів. Кристалогідрати порівняно нестійкі й згодом розкладаються, втрачаючи кристалізаційну воду. Цьому процесу вивітрювання сприяють підвищення температури та низька вологість повітря. Під час обережного нагрівання кристалогідратів вода, яка входить до їхнього складу, випаровується. При цьому може змінюватися колір кристалогідрату. Безводні кристали деяких речовин гігроскопічні й інтенсивно поглинають воду з навколишнього середовища, унаслідок чого утворюються кристалогідрати. Наприклад, безводний купрум(ІІ) хлорид потрібно зберігати в щільно закоркованій посудині, щоб запобігти доступу повітря. Якщо посудина відкрита, безводна сіль убирає з повітря вологу й поступово перетворюється на кристалогідрат. Мал. Взаємоперетворення мідного купоросу й купрум(ІІ) сульфату
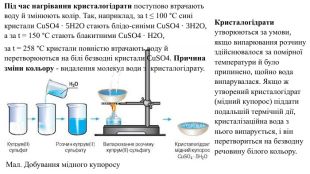
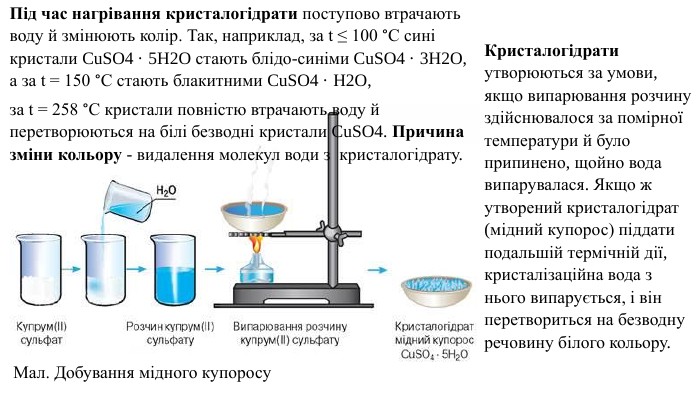
Кристалогідрати утворюються за умови, якщо випарювання розчину здійснювалося за помірної температури й було припинено, щойно вода випарувалася. Якщо ж утворений кристалогідрат (мідний купорос) піддати подальшій термічній дії, кристалізаційна вода з нього випарується, і він перетвориться на безводну речовину білого кольору. Мал. Добування мідного купоросу. Під час нагрівання кристалогідрати поступово втрачають воду й змінюють колір. Так, наприклад, за t ≤ 100 °С сині кристали Cu. SO4 · 5 H2 O стають блідо-синіми Cu. SO4 · 3 H2 O, а за t = 150 °С стають блакитними Cu. SO4 · H2 O, за t = 258 °С кристали повністю втрачають воду й перетворюються на білі безводні кристали Cu. SO4. Причина зміни кольору - видалення молекул води з кристалогідрату.
Чимало кристалогідратів мають практичне значення, їх застосовують у будівництві, медицині, сільському господарстві, хімічній промисловості. До них належать мідний і залізний Fe. SO4 · 7 H2 O купороси, гіпс Ca. SO4 · 2 H2 O, кристалічна сода Na2 CO3 · 10 H2 O, глауберова сіль Na2 SO4 · 10 H2 O, гірка сіль Mg. SO4 · 7 H2 O та ін. Розгляньмо найважливіші кристалогідрати, які широко використовують у повсякденному житті. Мідний купорос1 Cu. SO4 · 5 Н2 О запобігає розвитку пліснявих грибів, тому входить до складу численних сумішей, які використовують у будівництві та ремонті квартир. Також він ефективний у боротьбі зі шкідниками рослин і як мікродобриво. Із цією самою метою застосовують інший кристалогідрат - ферум(ІІ) сульфат гептагідрат - залізний купорос Fe. SO4 · 7 Н2 О. Натрій сульфат декагідрат Na2 SO4 · 10 Н2 О - глауберова сіль - перевірений часом послаблювальний засіб у медицині й ветеринарії. Натрій карбонат декагідрат Na2 CO3 · 10 Н2 О - пральна сода. Цю сполуку застосовують, зокрема, у виробництві засобів для миття та чищення. Мінерал трона - складник пральних порошків нового покоління, що не містять фосфатів.
Мідний купорос - купрум(ІІ) сульфат пентагідрат, речовина яскраво-синього кольору. У сільському господарстві широко застосовують бордоську рідину (1-3-відсотковий розчин мідного купоросу й зависі кальцій гідроксиду) для протруювання зерна та боротьби з шкідниками плодових дерев і кущів, а 0,2-відсотковий її розчин — для оброблення насіння помідорів перед сівбою. У будівництві розчином мідного купоросу обробляють поверхні, ушкоджені цвіллю, профілактично покривають стіни та стелі перед тим, як їх білити, для запобігання появі грибкової плісняви. Крім того, ним протруюють деревину, застосовують його під час вичинки шкіри в шкіряно-взуттєвій промисловості. Також мідний купорос використовують у медицині, а в хімічних лабораторіях — для добування інших солей Купруму. Залізний купорос - ферум(ІІ) сульфат гептагідрат, утворює блакитно-зелені кристали. У сільському господарстві його, як і мідний купорос, застосовують для боротьби з шкідниками та хворобами рослин, для протруювання деревини, виробництва фарб. Кристалічна сода - натрій карбонат декагідрат, біла кристалічна речовина. Застосовують для чищення та миття ванн, умивальників та інших забруднених поверхонь, виробництва мийних засобів.
Гіпс - кальцій сульфат дигідрат, прозорий, безбарвний, м'який мінерал. Під час нагрівання частина кристалізаційної води випаровується й утворюється алебастр — кальцій сульфат моногідрат, мінерал складу 2 Ca. SO4 · H2 O або Ca. SO4 · 0,5 H2 O. Гіпс застосовують у будівництві як в'яжучий матеріал, у процесі виробництва цементу, добрив. У медицині — для фіксації кісток під час переломів (гіпсові пов'язки). Скульптори використовують гіпс для створення гіпсових оригіналів скульптурних композицій, макетів тощо. Глауберова сіль (названа на честь німецького хіміка та лікаря Й. Глаубера, який уперше її добув) — натрій сульфат декагідрат, прозорі безбарвні кристали, гіркі на смак. Природний мінерал цієї солі називають мірабілітом. Застосовують у медицині як проносний засіб. Гірка сіль - магній сульфат гептагідрат, мінерал, добре розчинний у воді, гірко-солоний на смак. Набув широкого застосування у фармації та медицині, хімічній, текстильній і паперовій промисловості, а також у виробництві цукру. Галун. Галуном називають калій-алюміній сульфат додекагідрат KAl(SO4)2 · 12 H2 O. У давнину в Україні для знежирювання і протравлювання поверхні яйця перед розписуванням його фарбами користувалися алюмокалієвим галуном, звідси давня назва писанок на Поділлі — галунки. Галуни застосовують у медицині та косметології як дезінфікуючий і бактерицидний засіб, вони входять до складу масок і лосьйонів для жирної та пористої шкіри. Можна застосовувати тверді кристали, трошки змочені у воді, як дезодоранти.
Стисло про основне.• Кристалогідрати можна розглядати як продукти хімічної взаємодії розчиненої речовини з водою, виділені з розчину помірним випарюванням.• Кристалізаційною називають воду, яка входить до складу кристалів твердої речовини.• Внаслідок нагрівання кристалогідрату кристалізаційна вода випаровується, а залишається безводна сполука.• У розчині солі, виготовленому з кристалогідрату, розчиненою речовиною вважається безводна сіль. Кристалізаційна вода поповнює масу розчинника. Розчини кристалогідратів набули широкого використання в народному господарстві. У цьому полягає їх цінність і практичне застосування.
-
 Степанчук Віталій 29.09.2024 в 23:55Загальна:1.3Структурованість1.0Оригінальність викладу1.0Відповідність темі2.0
Степанчук Віталій 29.09.2024 в 23:55Загальна:1.3Структурованість1.0Оригінальність викладу1.0Відповідність темі2.0


про публікацію авторської розробки
Додати розробку