Презентація "Родини хімічних елементів"


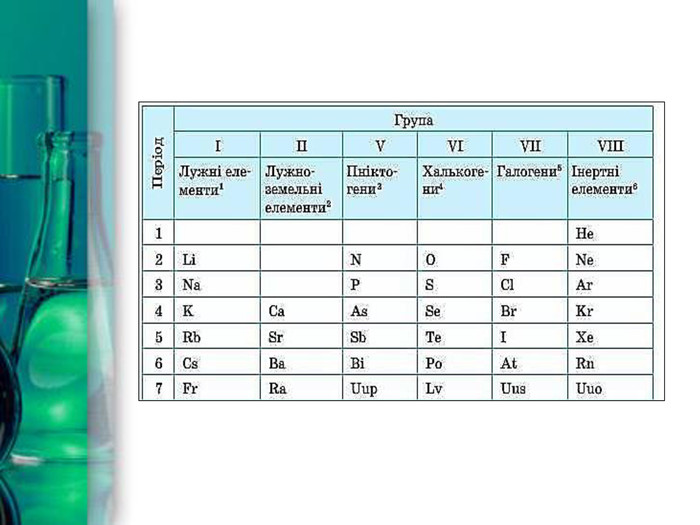
































Електронна будова атомів. На зовнішньому енергетичному рівні атоми лужних металів мають один електрон s1 . Тому для всіх металів групи IA характерний ступінь окиснення +1 та валентність І. Цим пояснюється схожість властивостей усіх лужних металів. Для них (зверху вниз по групі) є характерним:збільшення радіуса атомів;зменшення електронегативності;посилення відновних, металічних властивостей.
Поширення у природіЗ лужних металів найпоширенішими у природі є Натрій і Калій. Проте, через високу хімічну активність вони зустрічаються лише у вигляді сполук. Основними джерелами Натрію і Калію є:кам'яна сіль (натрій хлорид) Na. Cl,глауберова сіль, або мірабіліт – натрій сульфат декагідрат Na2 SO4⋅10 H2 O,сильвін – калій хлорид KCl,сильвініт – калій-натрій хлорид KCl⋅Na. Cl та інші. Сполуки Літію, Рубідію і Цезію в природі зустрічаються значно рідше, тому їх відносять до числа рідкісних і розсіяних.
У твердому агрегатному стані атоми зв'язані металічним зв'язком. Наявність металічного зв'язку обумовлює загальні фізичні властивості простих речовин – металів: металічний блиск, ковкість, пластичність, високу тепло- і електропровідність. У вільному вигляді прості речовини, утворені елементами IA групи — це легкоплавкі метали сріблясто-білого (літій, натрій, калій, рубідій) або золотисто-жовтого (цезій) кольору, що мають високу м'якість і пластичність. Фізичні властивості
Електронна будова атомів. На зовнішньому енергетичному рівні атоми металів IIA групи мають два електрона. Тому для всіх лужноземельних металів характерний ступінь окиснення +2 та валентність ІІ. Цим пояснюється подібність їх властивостей. Для металів IIA групи (згори до низу) характерно:збільшення радіусу атомів;зменшення електронегативності;посилення відновлювальних, металічних властивостей.
Поширення у природіЗ лужноземельних металів кальцій є найпоширенішим у природі, а радіоактивний радій — найменше. Усі лужноземельні метали мають високу хімічну активність, тому зустрічаються у природі лише у вигляді сполук. Основними джерелами кальцію є його карбонати Ca. CO3 (крейда, мармур, вапняк). У вільному вигляді прості речовини є типовими металами сірого або сріблястого кольору.
У твердому агрегатному стані атоми сполучаються металічним зв'язком. Це обумовлює загальні фізичні властивості простих речовин металів: металічний блиск, ковкість, пластичність, високу тепло- і електропровідність. Проте, метали IIA групи мають різні значення температури плавлення, густини та інших фізичних властивостей. Фізичні властивості
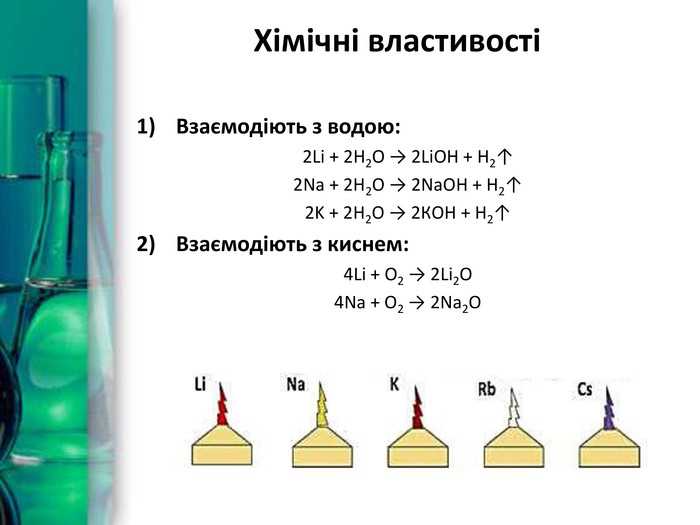
Хімічні властивостіВзаємодіють з водою: Ba + 2 H2 O → Ba(OH)2 + H2↑Ca + 2 H2 O → Ca(OH)2 + H2↑Sr + 2 H2 O → Sr(OH)2 + H2↑Взаємодіють з кислотами: Ba + 2 HCl → Ba. Cl2 + H2↑Ca + H2 SO4 → Ca. SO4 + H2↑4 Sr + 10 HNO3 → 4 Sr(NO3)2 + NH4 NO3 + 3 H2 OВзаємодіють з солями: Ba + Cu. Cl2 → Ba. Cl2 + Cu↓Ca + Fe. SO4 → Ca. SO4 + Fe↓Sr + 2 Ag. NO3 → Sr(NO3)2 + 2 Ag↓
Електронна будова атомів. В атомах галогенів на зовнішньому енергетичному рівні міститься по 7 електронів:Із зростанням порядкового номера від Флуору до Йоду збільшуються радіуси атомів, знижується їх електронегативність. До завершення зовнішнього електронного шару атомам галогенів не вистачає лише одного електрона, тому для них найбільш характерними є ступінь окиснення -1 і валентність І. У Флуору електронегативність більша, ніж у інших елементів, і тому ступінь окиснення -1 — його єдиний можливий ступінь окиснення у сполуках.
Фтор. Фтор – газ ясно-зеленого кольору, дуже отруйний. Найбільш активний неметал (у флуорі навіть вода горить). Фтор дуже корисний для зубів, саме тому його додають в зубні пасти. Застосування лікувальних і профілактичних засобів, у складі яких присутній хімічний елемент фтор, запобігає появі карієсу.
Хлор – важкий газ жовто-зеленого кольору з різким запахом, отруйний, використовувався у Першу світову війну, як хімічна зброя. Хлор використовують для отримання хлоридної кислоти, яка незамінна в промисловості та медицині. Хлор використовують для виготовлення каучуку, пластмаси, розчинників, барвників, а також синтетичних волокон. Сполуки хлору використовують у сільському господарстві для боротьби з шкідниками. Хлор використовують також для відбілювання паперу і тканин. Хлор
Хімічні властивостіВзаємодіють з металами: Ca + F2 → Ca. F22 Au + 3 F2 → 2 Au. F32 Fe + 3 Cl2 → 2 Fe. Cl3 Cu + Br2 → Cu. Br22 Al + 3 I2 → 2 Al. I3 Взаємодіють з воднем: F2 + H2 → 2 HFCl2 + H2→ 2 HCl. Br2 + H2→ 2 HBr. I2 + H2 → 2 HIВодні розчини галогеноводневих сполук є кислотами: HF – фторидна (фтороводнева) / плавикова. HCl – хлоридна (хлороводнева) / соляна. HBr – бромідна (бромоводнева)HI – йодидна (йодоводнева)tttt
Електронна будова атомів. Причина інертності (благородності) благородних газів в будові атомів. Дослідження показали, що у них максимально заповнені енергетичні рівні. Гелій позначається як 1s2-елемент. Він має найміцнішу структуру атома серед усіх хімічних елементів. Решта благородних газів – це p-елементи. Електронна будова атома визначає багато властивостей цих газів. Їх молекули одноатомні. Низька спорідненість до електрона.
Прості речовини цих елементів – одноатомні гази, що не мають запаху і кольору. Особливим є Оганесон, який при нормальних умовах є твердою речовиною. Оганесон та радон є радіоактивними. Якщо через благородні гази пропустити електричний струм, то вони будуть світитись. Фізичні властивості
Неон. Неон відкрили у 1898 році. Якщо крізь розріджені інертні гази пропускати електричний струм, то вони випромінюють світло різного забарвлення. Їх використовують для світлових реклам і в маяках. Неоном наповнюють трубки для світлових реклам, при цьому вони світяться оранжево-червоним кольором.
Аргон. Аргон у 1894 р. Релей виявив у звичайному повітрі у вигляді, домішок, які не вступали у хімічні реакції. Аргон, зважаючи на свою неактивність і низьку теплопровідність, використовується в суміші з азотом для наповнення електричних ламп. Аргоном наповнюють трубки для світлових реклам, при цьому вони світяться блакитним кольором. В інертному середовищі аргону здійснюють електрозварювання металів, що легко окислюються.
-
 Тесля Надiя Аркадiiвна 07.11.2022 в 09:28Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Тесля Надiя Аркадiiвна 07.11.2022 в 09:28Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0


про публікацію авторської розробки
Додати розробку