Презентація «Розв'язування розрахункових задач «Обчислення об'ємних відношень газів за хімічними рівняннями»




















Закон об’ємних відношень газів. Значна частина вуглеводнів за нормальних умов — це гази. Серед них — вуглеводні, які ми вже знаємо: метан, етен, етин, а також етан, пропан, бутан. У газах, на відміну від твердих чи рідких речовин, відстань між молекулами дуже велика. Тому порції різних газів, що містять однакову кількість молекул, займають однаковий об’єм за незмінних тиску та температури.
На початку XIX ст. італійський фізик і хімік Амедео Авогадро сформулював закон, який назвали його іменем — закон Авогадро: Рівні об’єми різних газів за однакових умов містять однакову кількість молекул. Це означає, що в 1 л метану СН4 міститься стільки ж молекул, скільки їх є в 1 л ацетилену С2 Н2 чи в 1 л етилену С2 Н4.
Відкриттю закону Авогадро передували численні досліди з газами французького хіміка і фізика Жозефа-Луї Гей-Люссака. Так, досліджуючи реакцію водню з хлором, він використовував однакові об’єми газів, а одержав продукт реакції — гідроген хлорид, об’єм якого був удвічі більшим: Експериментуючи з воднем (під час його взаємодії з киснем), учений зауважив, що на реакцію з одним об'ємом кисню витрачається два об'єми водню:
За результатами дослідів він установив, що невеликі цілі числа, якими виражається відношення об’ємів газоподібних речовин, збігаються з коефіцієнтами перед формулами цих речовин у рівнянні реакції. Ж.-Л. Гей-Люссак 1808 року сформулював закон об'ємних відношень газів: Об'єми газів, що вступають у реакцію, а також утворюються в результаті реакції, відносяться як невеликі цілі числа. Ці числа збігаються з коефіцієнтами в рівнянні реакції. Закон Гей-Люссака поширюється на всі газоподібні речовини (органічні та неорганічні).
Запишемо рівняння реакції горіння етану:2 С2 Н6 + 7 О2 → 4 СО2 + 6 Н2 ОЯк видно з рівняння, дві молекули етану реагують із сімома молекулами кисню, утворюючи чотири молекули вуглекислого газу і шість молекул води. Отже, можна стверджувати, що на згоряння двох моль етану потрібно сім моль кисню. При цьому утвориться чотири моль карбон(IV) оксиду й шість моль води. Тобто:n(С2 Н6) : n(О2) : n(СО2) : n(Н2 О) = 2 : 7 : 4 : 6 Оскільки вода за температури горіння етану є газоподібною, то, зважаючи на закон об’ємних відношень газів, можна записати так: V(C2 H6) : V(O2) : V(CO2) : V(H2 O) = 2 : 7 : 4 : 6
Задача 4. Для спалювання насиченого вуглеводню використано п’ятикратний об’єм кисню. Встановіть формулу насиченого вуглеводню. Дано: V(Сn. Н2n+2) : V (O2) = 1 : 5 Сn. Н2n+2 – ? Розв’язання Згідно з законом об’ємних відношень об’єми газів реагуючих речовин відносяться як стехіометричні коефіцієнти. Запишемо рівняння горіння насиченого вуглеводню у загальному вигляді: 1 л 5 л Сn. Н2n+2 + 2 n3 +1 O2 = n. СО2 + (n+1) Н2 О 1 л 2 n3 +1 л 0,5(3n + 1) = 5 n = 3 С3 Н8 Відповідь: С3 Н8
Завдання 7. Обчисліть об’єм кисню, що потрібен для спалювання 40 л суміші, яка містить 20 % метану, 40 % етану й 40 % етену. Записуємо рівняння рекацій спалювання метану, етану, етену. Відповідно зо загону об’ємних відношень газів знаходимо об’єми складових газової суміші. Відповідь: 104 л кисню.
Задача 8. Знайти формулу газуватого вуглеводню, якщо при повному згорянні 100 мл цієї сполуки утворюється 300 мл вуглекислого газу і 400 мл водяної пари (об’єми відповідають однаковим умовам). Дано: V(Cх. Hy) = 100 мл. V(CО2) = 300 мл. V(Н2 О) = 400 мл. Cх. Hy– ? Розв’язання:100 мл 300 мл 400 мл. Cх. Hy + O2 = CO2 + H2 O 1 мл 3 мл 4 мл. Cх. Hy + 5 O2 = 3 CO2 + 4 H2 O C3 H8 Відповідь: С3 Н8
Задача 9. Газова суміш складається з водню, метану і карбон(ІІ) оксиду, має густину 0,857 г/л. Для повного спалювання 1 л такої суміші витратили 4,75 л повітря. Визначити склад вихідної суміші газів в літрах. Вважати об'ємну частку кисню у повітрі 0,2. Дано: ρ(суміші) = 0,857 г/л. V(суміші) = 1 л V(повітря) = 4,75 л ϕ(О2) = 0,2 V(H2) – ? V(CH4) – ? V(CО) – ? Розв’язання V(О2) = V(повітря) · ϕ(О2); V(О2) = 4,75 л · 0,2 = 0,95 л 2 СО + О2 = 2 СО2 V(CO): V(O2) = 2 : 1 V(CO i H2) : V(O2) = 2 : 12 Н2 + О2 = 2 Н2 О V(H2): V(O2) = 2 : 1 V(CO i H2) = х л V(CH4) = (1 - x) л Згідно з рівнянням V1(O2) = 0,5х (1-х) л 2(1-х) л CH4 + 2 О2 = СО2 + 2 Н2 О V2(O2) = 2(1 – х); 1 л 2 л V(O2) = V1(O2) + V2(O2) 0,95 = 0,5х + 2(1– х) 0,95 = 0,5х + 2 – 2х 1,5х = 1,05 х = 0,7 (л) V(CO i H2) = 0,7 л V(CH4) = 1 л – 0,7 л = 0,3 л
М= ρ · Vm; Mсер.= 0,857 г/л · 22,4 л/моль = 19,2 г/моль Мr cер = Мсер. Мr сер. = Мr1 · φ1 + Мr2 · φ2 + Мr3 · φ3; φ1 = φ(СН4) = 0,3; φ2 = φ(СО) = х; φ3 = φ(Н2) = 0,7–х 19,2 = 0,3 ·16 + х · 28 + (0,7 – х) ·2; х = 0,5 φ(СО) = 0,5; φ(Н2) = 0,2; V(CО) = 1 л · 0,5 = 0,5 л V(Н2) = 1 л · 0,2 = 0,2 л Відповідь: 0,2 л Н2, 0,3 л СН4, 0,5 л СО
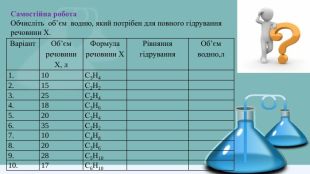
Самостійна робота. Обчисліть об’єм водню, який потрібен для повного гідрування речовини Х. Варіант. Об’єм речовини Х, л. Формула речовини ХРівняння гідрування. Об’єм водню,л1.10 С3 Н4 2.15 С2 Н2 3.25 С2 Н4 4.18 С3 Н6 5.20 С3 Н4 6.35 С2 Н2 7.10 С4 Н8 8.20 С3 Н6 9.28 С5 Н10 10.17 С6 Н10
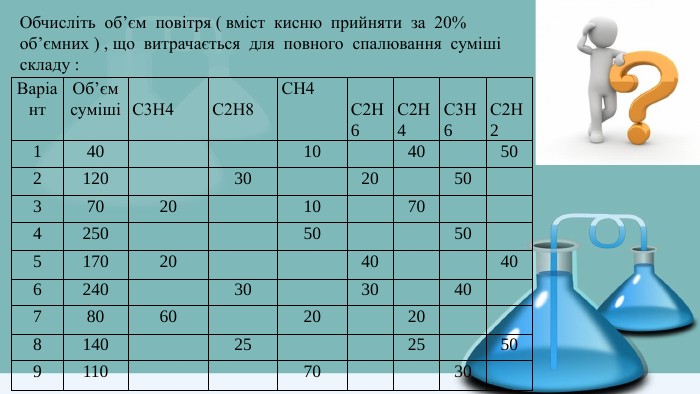
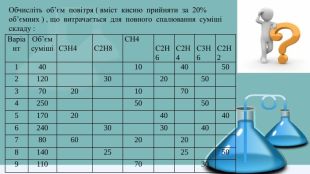
Обчисліть об’єм повітря ( вміст кисню прийняти за 20% об’ємних ) , що витрачається для повного спалювання суміші складу : Варіант. Об’єм суміші С3 Н4 С2 Н8 СН4 С2 Н6 С2 Н4 С3 Н6 С2 Н2140 10 40 502120 30 20 50 37020 10 70 4250 50 50 517020 40 406240 30 30 40 78060 20 20 8140 25 25 509110 70 30
І варіант1. Спалили етан об’ємом 50м3. Який об’єм кисню витратився?2. Який об’єм кисню витратиться на згорання 5 моль етину?3. Обчисліть об’єм вихідних речовин в реакції бромування етилену якщо утворився дибромоетан об’ємом 90л?4. При спалюванні бутану утворився вуглекислий газ об’ємом 86л. Якій кількості речовини відповідає такий об’єм? Які об’єми вихідних речовин прореагували?5. При горінні етену утворився вуглекислий газ об’ємом 500м3. Який об’єм та кількість речовини етену Та кисню прореагувало?
ІІ варіант1. Спалили бутан об’ємом 50м3. Який об’єм кисню витратився?2. Який об’єм кисню витратиться на згорання 5 моль пропену?3. Обчисліть об’єм вихідних речовин в реакції повного хлорування ацетилену якщо утворився тетрахлороетан об’ємом 90л?4. При спалюванні пропану утворився вуглекислий газ об’ємом 86л. Якій кількості речовини відповідає такий об’єм? Які об’єми вихідних речовин прореагували?5. При горінні етину утворився вуглекислий газ об’ємом 500м3. Який об’єм та кількість речовини етину та кисню прореагувало?
1. Для спалювання 1 л насиченого вуглеводню використано 16,7 л повітря. Встановіть формулу насиченого вуглеводню. Об’єми газів виміряні за однакових умов. 2. При пропусканні 2,8 л (н.у.) газової суміші, що складається з пропену, бутену і бутану через бромну воду прореагувало 6 г брому. Визначити об’єми кисню і повітря необхідні для спалювання 20 л (н.у.) цієї суміші, якщо її густина за воднем становить 26,1.


про публікацію авторської розробки
Додати розробку





















-

Грейцер Ірина Миколаївна
28.02.2024 в 18:22
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Котюк Тетяна Валеріївна
23.01.2024 в 09:00
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Котюк Тетяна Валеріївна
23.01.2024 в 09:00
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Підкалюк Любов Петрівна
08.05.2023 в 22:13
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Воронівська Наталья Гуріївна
07.02.2023 в 12:40
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 2 відгука