Презентація «Розвязування експериментальних задач» 9 клас
Про матеріал
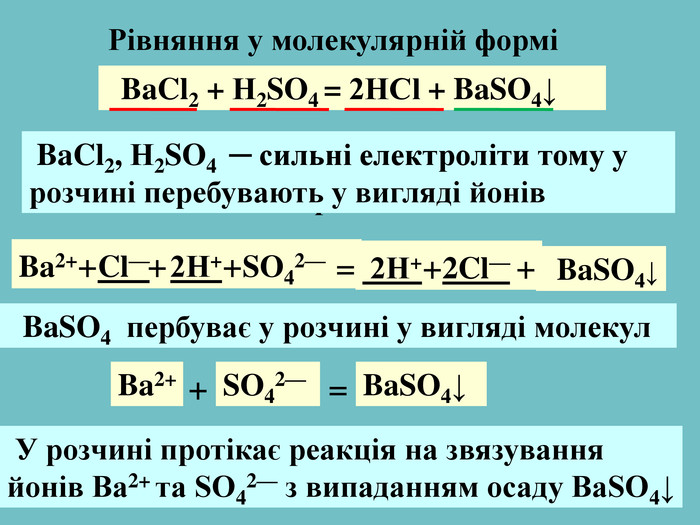
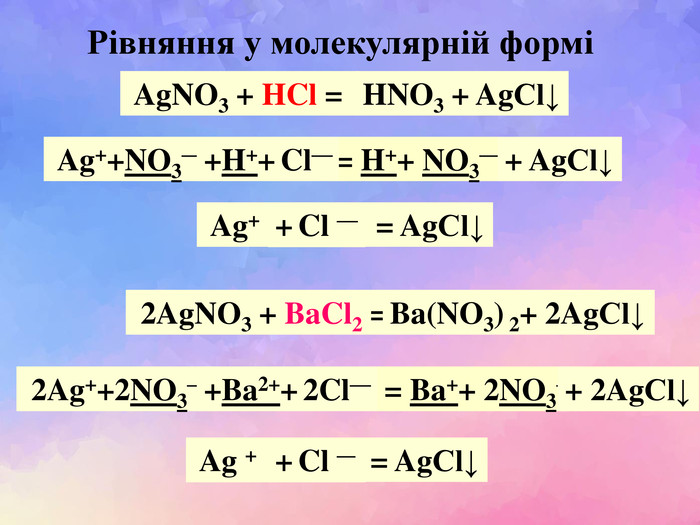
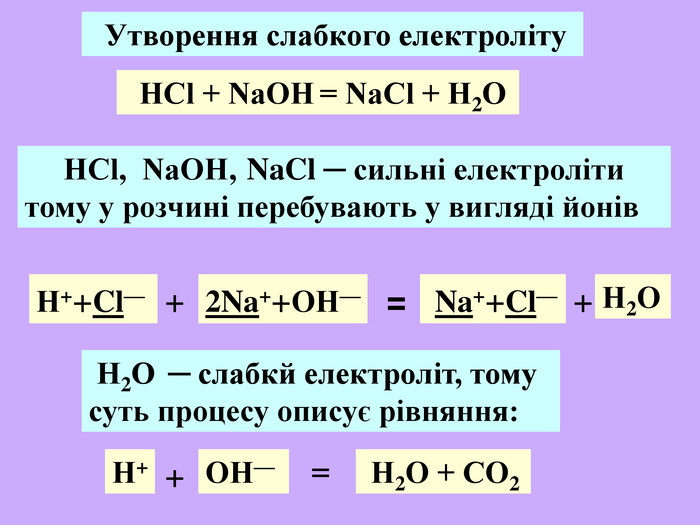
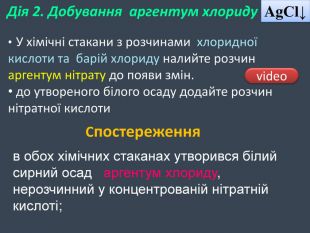
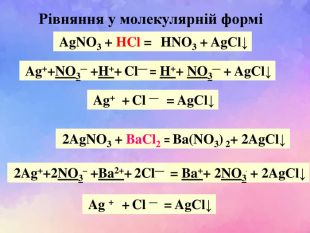
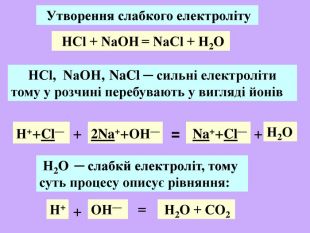
| Презентація допоможе учням та вчителю при проведенні Практичної роботи №2: «Розв'язування експериментальних задач.» де в поєднанні відеофайлів віртуальної лабораторії з'ясують сутність реакцій добування барій сульфату, аргентум хлориду та натрій хлориду. |
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
хороша допомога при розв'язуванні експериментальних задач
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку