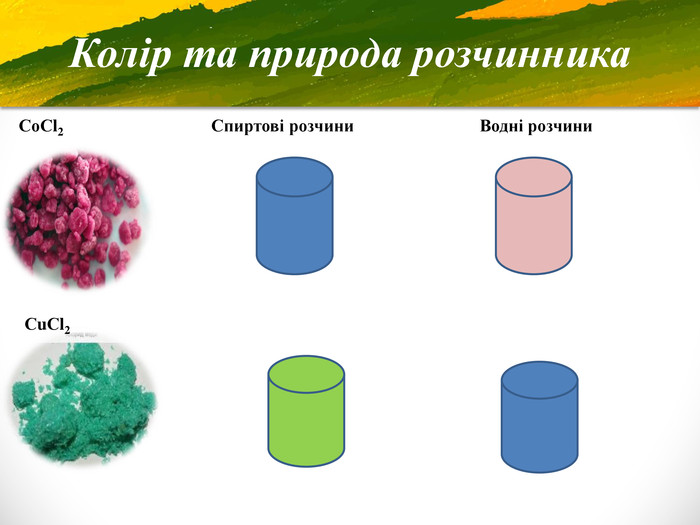
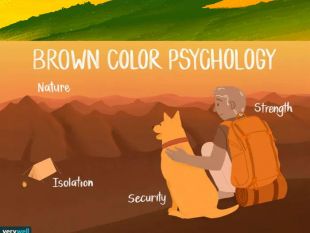
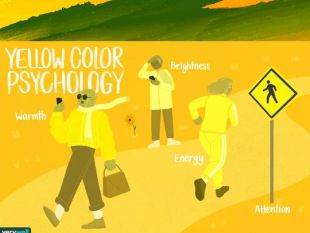
Презентація "Таємниці кольору"
Про матеріал
Методична розробка для вчителів та здобувачів освіти загальноосвітніх навчальних закладів при організації позакласної роботи з хімії, фізики, біології, англійської мови. Робота містить пізнавальний інтегрований матеріал для зацікавлення процесом отримання знань про утворення та властивості кольору,
Для учителів хімії, фізики, біології, англійської мови , учнів 8-11 класів навчальних закладів.
Перегляд файлу
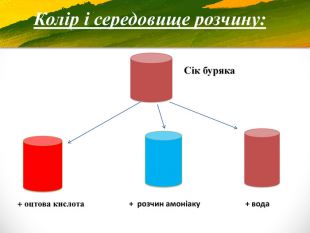
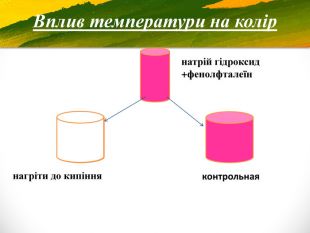
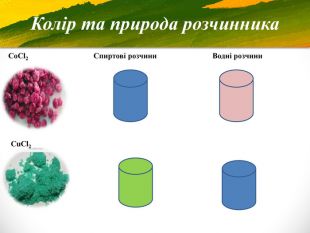
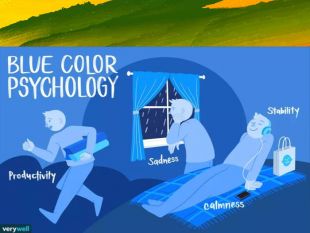
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку