Презентація "Тема уроку: Добування кисню в лабораторії ( на прикладі гідроген пероксиду і води) та промисловості. Реакція розкладу. Поняття про каталізатор. Способи збирання кис "
Про матеріал
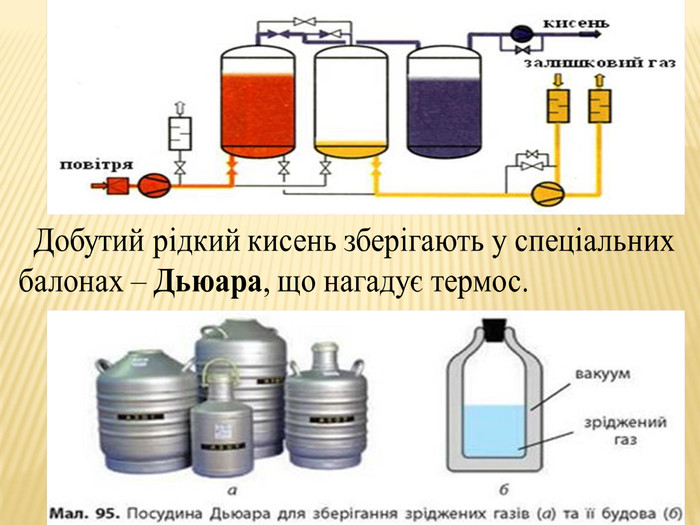
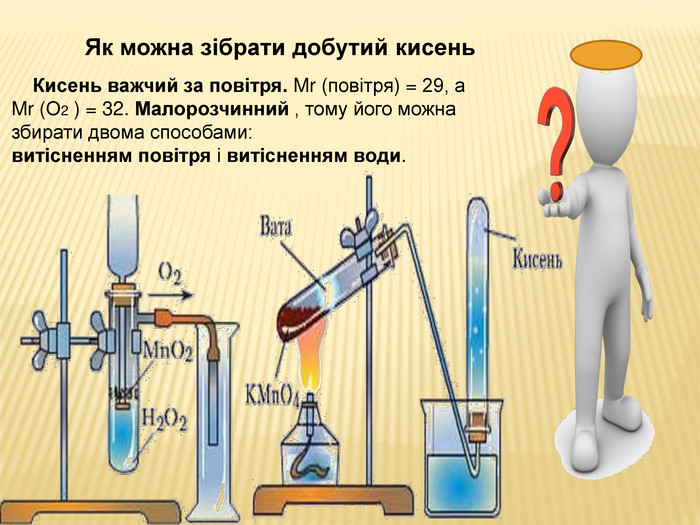
Тема уроку: Добування кисню в лабораторії ( на прикладі гідроген пероксиду і води)
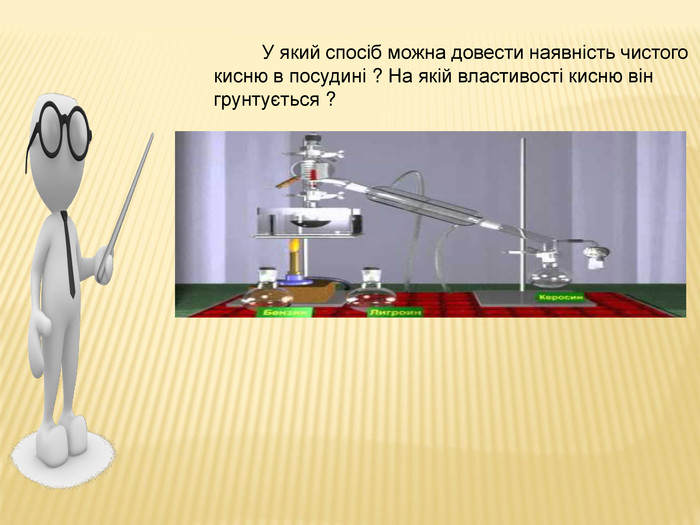
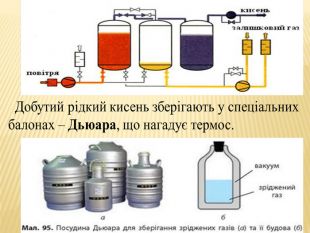
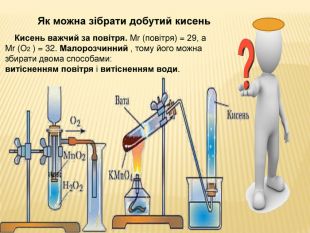
та промисловості. Реакція розкладу. Поняття про каталізатор. Способи збирання кисню. Доведення наявності кисню.
Цілі: поглибити знання про просту речовину кисень, його фізичні властивості; сформувати уявлення про реакції розкладу та каталізатори на прикладі реакції одержання кисню в лабораторії; підготувати учнів до практичної роботи з вивчення кисню.
Тип уроку: засвоєння нових знань.
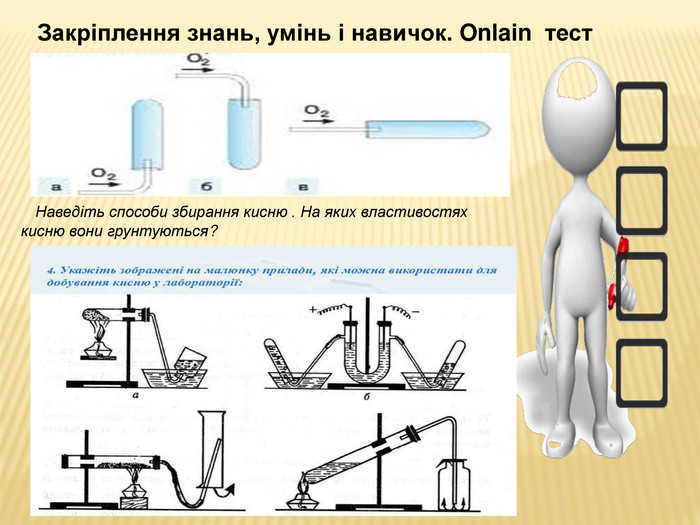
Форми роботи: демонстраційний експеримент, робота з опорною схемою, самостійна робота у вигляді onlain тестів. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую за презентацію.
-
-

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку