Презентація "Типи хімічних реакцій. Окисно-відновні реакції"


Явище хімічна під час реакція це якого перетворення на одних речовини інші
відбувається
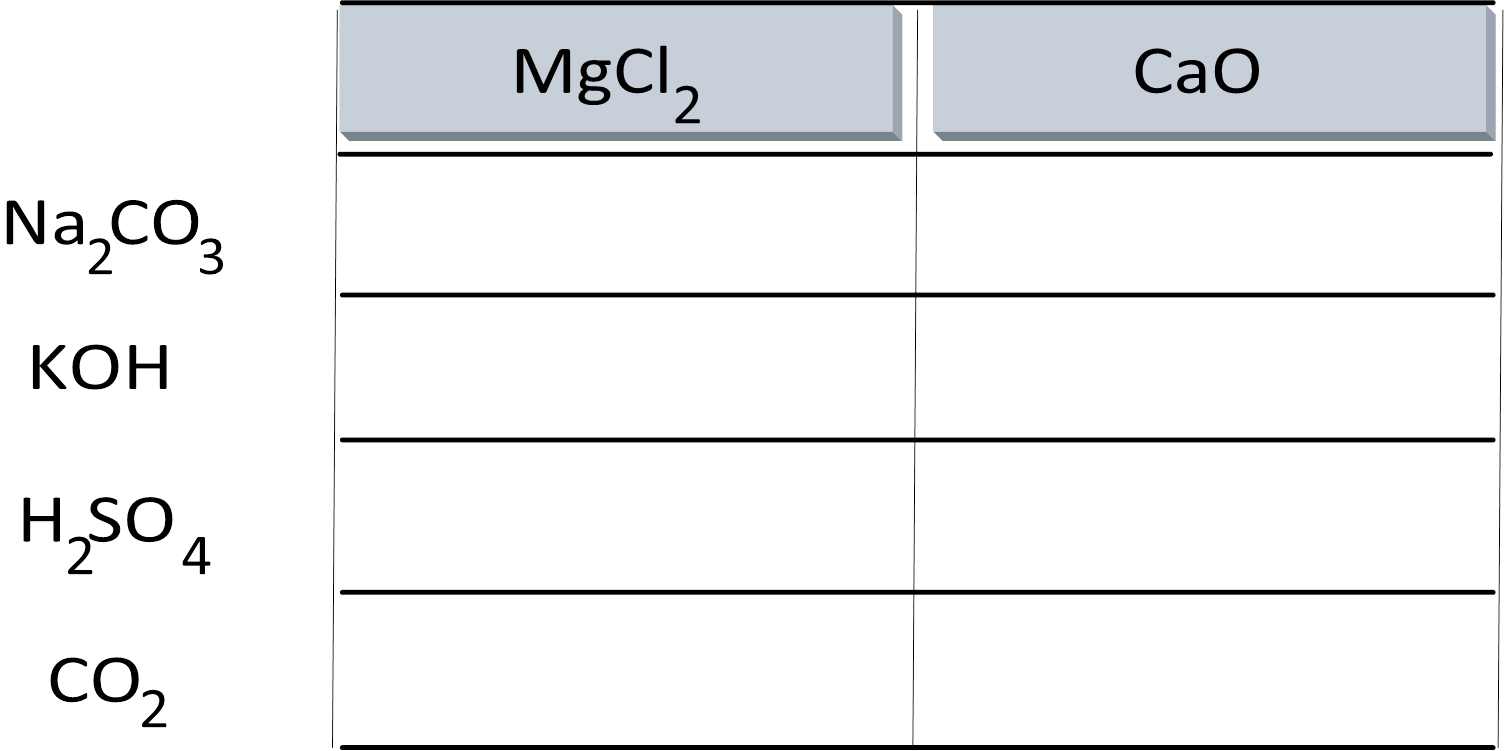
 Хімічна реакція - це явище, під час якого відбувається перетворення одних речовин на
Хімічна реакція - це явище, під час якого відбувається перетворення одних речовин на
інші

Реакції внаслідок із декількох сполучення речовин одна утворюється
Внаслідок реакції сполучення із декількох речовин утворюється одна


Реакції складовими двома між вони своїми складними обміну речовинами якої
обмінюються внаслідок частинами це реакція.

Реакція між двома складними речовинами, внаслідок якої вони обмінюються своїми складовими - це реакція обміну  Заміщення це відбувається простою між реакція яка і складною атоми складної внаслідок речовинами якої простої атоми заміщують з речовини.
Заміщення це відбувається простою між реакція яка і складною атоми складної внаслідок речовинами якої простої атоми заміщують з речовини.
 Заміщення - це реакція, яка відбувається між простою і складною речовинами, внаслідок якої атоми простої речовини заміщують атоми складної.
Заміщення - це реакція, яка відбувається між простою і складною речовинами, внаслідок якої атоми простої речовини заміщують атоми складної.




 A + BC
A + BC = AC + B















 Т И П И Х І М І Ч Н И Х Р Е А К Ц І Й
Т И П И Х І М І Ч Н И Х Р Е А К Ц І Й

Більшість хімічних процесів, що відбувається в природі та здійснюється людиною в практичній діяльності, є окисно-відновними реакціями. Саме окисно-відновні реакції відіграють значну роль у біохімічних процесах: диханні, гнитті, фотосинтезі, інших реакціях обміну речовин.
ОКИСНО-ВІДНОВНІ РЕАКЦІЇ – ЦЕ ХІМІЧНІ ПРОЦЕСИ, ПРИ ЯКИХ ВІДБУВАЮТЬСЯ
ЗМІНЕННЯ СТУПЕНІВ ОКИСНЕННЯ У АТОМІВ ОДНОГО ЧИ
ДЕКІЛЬКОХ ЕЛЕМЕНТІВ
 Ступінь окиснення визначається числом відданих або прийнятих електронів у речовинах з йонним зв’язком та числом електронів у складі спільних електронних пар, що зумовлюють ковалентний полярний зв’язок.
Ступінь окиснення визначається числом відданих або прийнятих електронів у речовинах з йонним зв’язком та числом електронів у складі спільних електронних пар, що зумовлюють ковалентний полярний зв’язок.
+1 -1
NaCl
 ПРАВИЛА ВИЗНАЧЕННЯ СТУПЕНІВ
ПРАВИЛА ВИЗНАЧЕННЯ СТУПЕНІВ
ОКИСНЕННЯ (С.О)
1.С.О. простої речовини = 0
2.Сума С.О. в сполуці = 0
3.Гідроген в сполуках має С.О. +1, крім гідридів (Н+Ме), там -1
4.Оксиген в сполуках має С.О. -2, крім сполуки OF2 , там +2 та перокисидів (Н О2 2 ), там -1
5.Метали в сполуках виявляють позитивний С.О., який = їх валентності


![]()
![]()
3. Виписуємо елементи, які змінили ступінь окиснення
0 +2
Cu - 2е- Cu 2 2 окиснення, відновник
4
![]() O2 +0 4е- 2O-2 4 1 відновлення, окисник
O2 +0 4е- 2O-2 4 1 відновлення, окисник
Розставляємо коефіцієнти у схемі реакції
2 Cu + O2 = 2Cu O

про публікацію авторської розробки
Додати розробку
