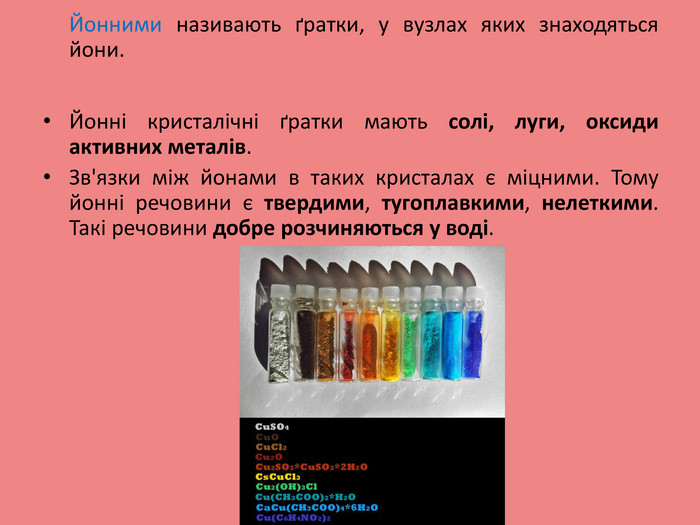
Презентація "Типи кристалічних граток"
Про матеріал
Презентація "Типи кристалічних граток" для учнів 8 класів. Містить фото та теоретичну інформацію. Використано матеріали сайтц https://miyklas.com.ua/p/himija/8-klas Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку