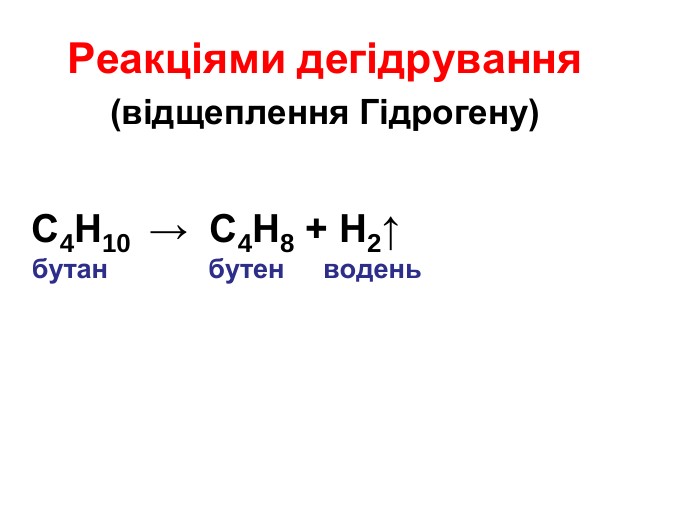
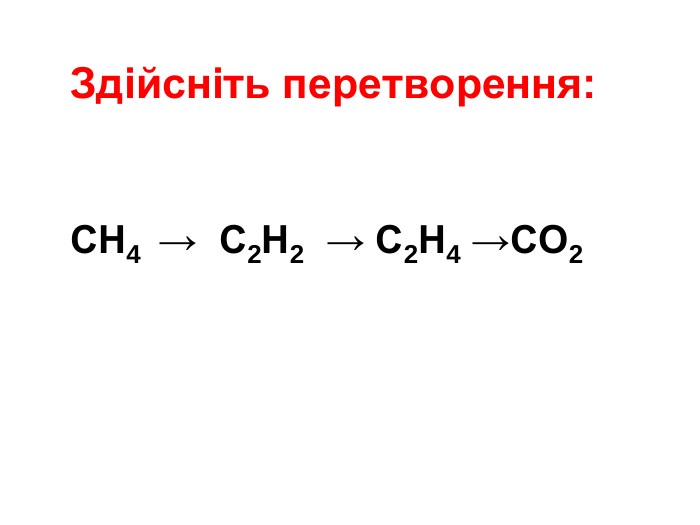
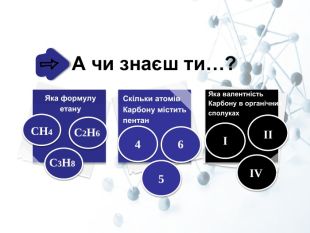
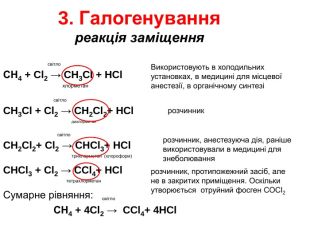
Презентація "Властивості алканів"
Про матеріал
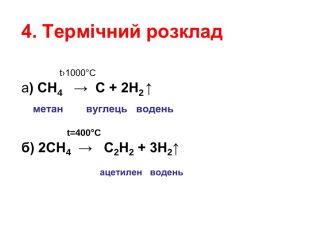
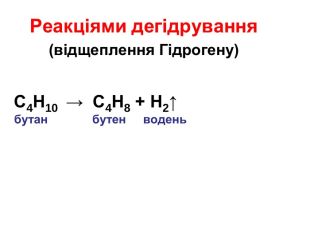
Формувати в учнів знання про хімічні властивості алканів; вивчити хімічні властивості алканів; показати значення реакцій горіння, повного й часткового окиснення для алканів; дати уявлення про хімізм реакцій заміщення. Розвивати навички й уміння складати рівняння хімічних реакцій на прикладі хімічних властивостей алканів; вміння порівнювати, аналізувати, самостійно робити висновки, формулювати гіпотези на основі спостережень, дослідів; розвивати логічне мислення, вміння будувати причинно-наслідкові взаємозв'язки, вміння працювати самостійно, користуватися інформаційно-комунікаційними можливостями мережі Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку