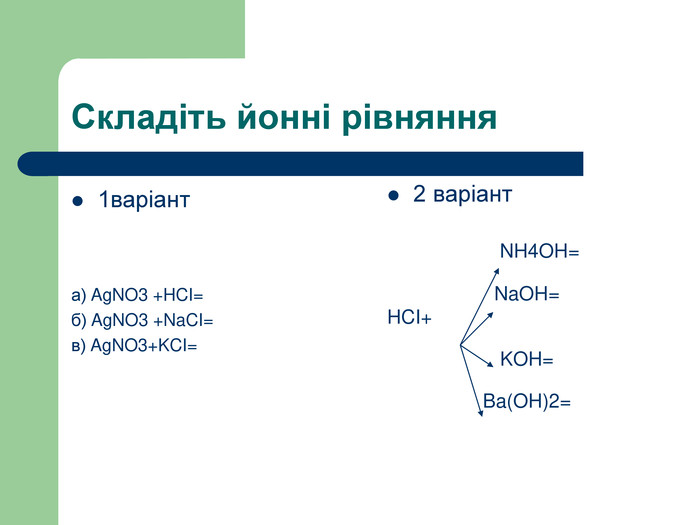
Презентація "Йонні рівняння" хімія для учнів 9 класу
Про матеріал
Презентація на тему"Йонні рівняння"є допоміжним матеріалом для викладення теми. Допоможе вчителю урізноманітнити урок та більш якісно його провести. Автор Євтушенко Антоніна Федорівна.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку