Презентація до уроку "Предмет органічної хімії"
Презентація до уроку " Предмет органічної хімії" дає можливість учням отримати уявлення про те,що вивчає органічна хімія. Розглянути сутність теорії Бутлєрова, основні класи неорнанічних сполук.Ця презентація для школ ,де предмет викладається блочно.





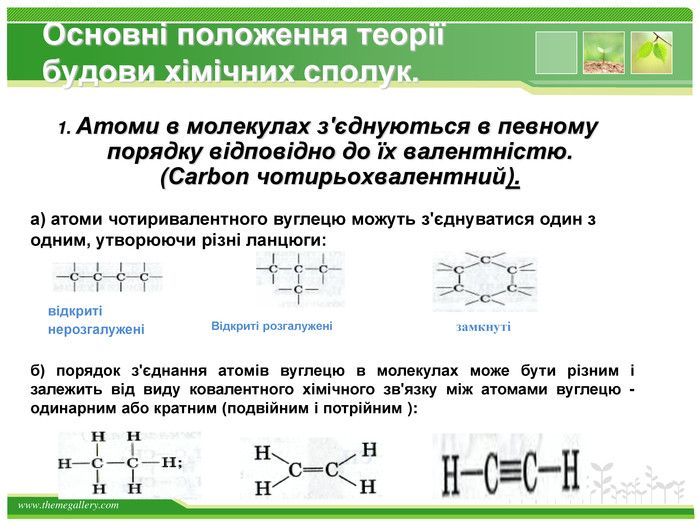





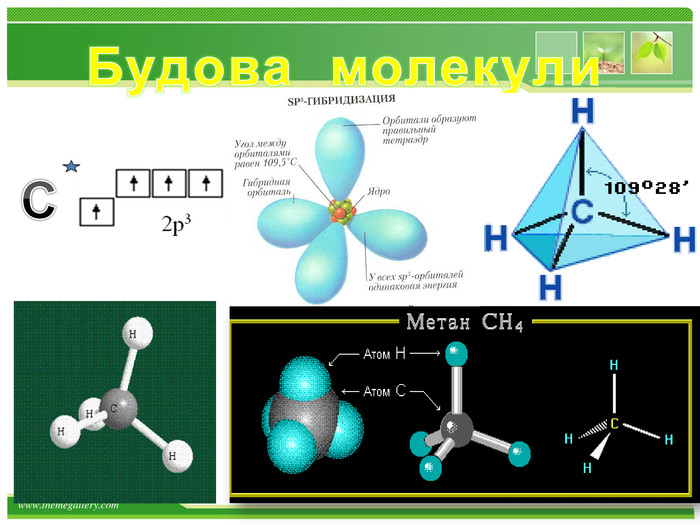













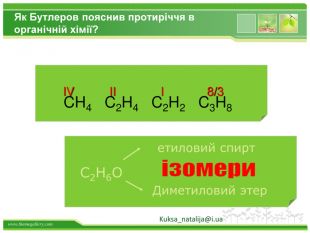
Основні положення теорії будови хімічних сполук.1. Атоми в молекулах з'єднуються в певному порядку відповідно до їх валентністю. (Carbon чотирьохвалентний).а) атоми чотиривалентного вуглецю можуть з'єднуватися один з одним, утворюючи різні ланцюги: відкриті нерозгалужені Відкриті розгалуженізамкнуті б) порядок з'єднання атомів вуглецю в молекулах може бути різним і залежить від виду ковалентного хімічного зв'язку між атомами вуглецю - одинарним або кратним (подвійним і потрійним ):
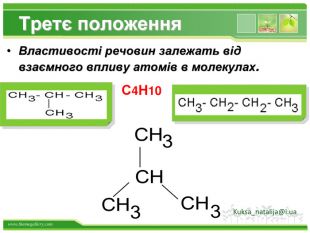
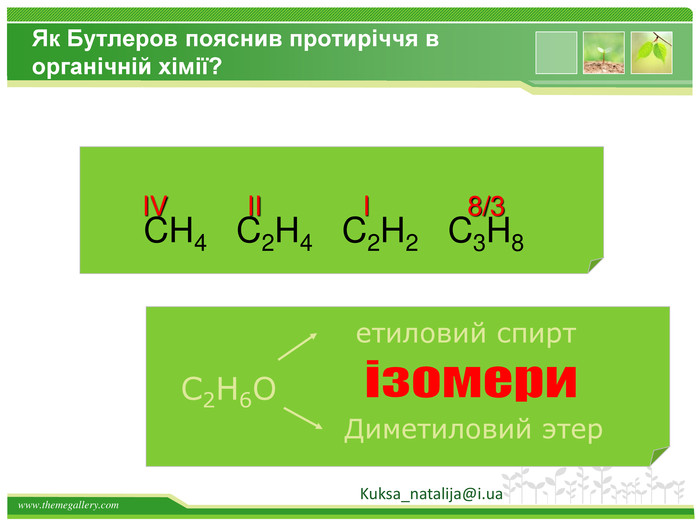
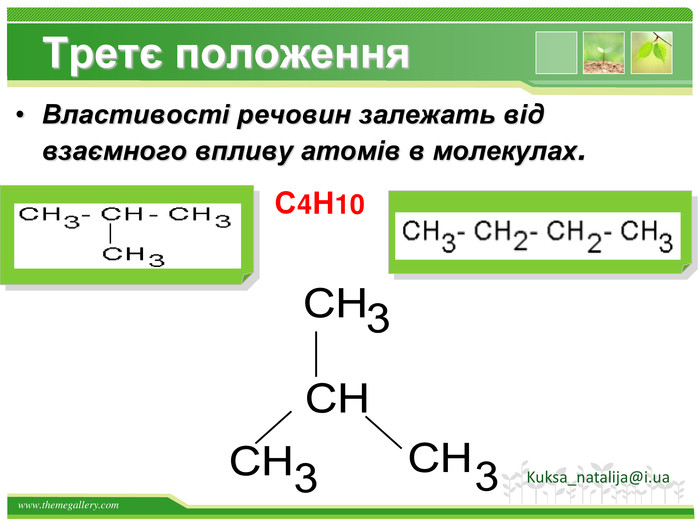
Друге положення. Властивості речовин залежать не тільки від їх якісного і кількісного складу, але і від їхньої будови молекул. Це положення пояснює явище ізомерії. Речовини, які мають однаковий склад, але різну хімічну або просторову будову, а отже, і різні властивості, називають ізомерами Kuksa_natalija@i.ua
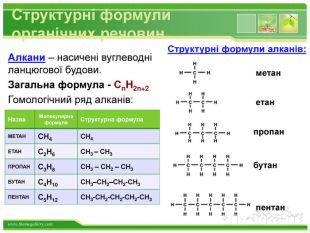
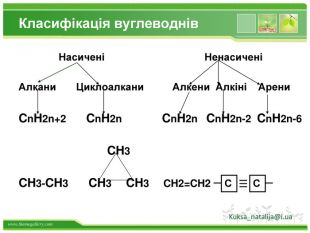
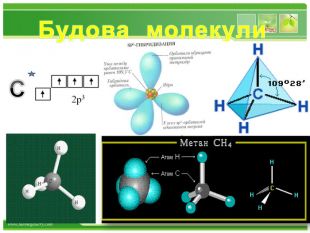
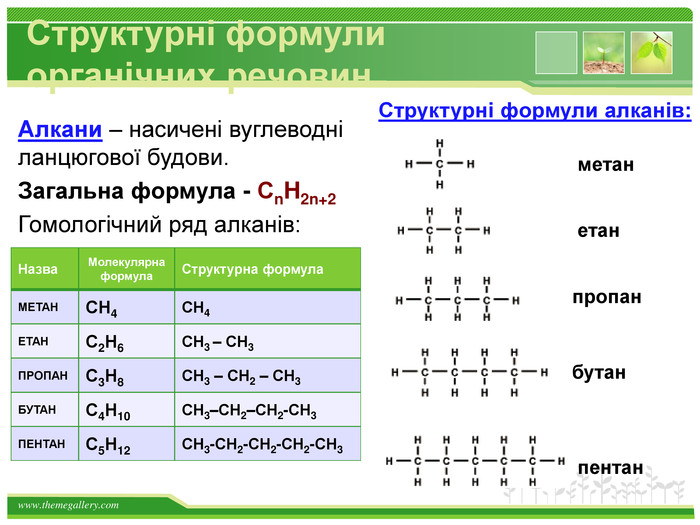
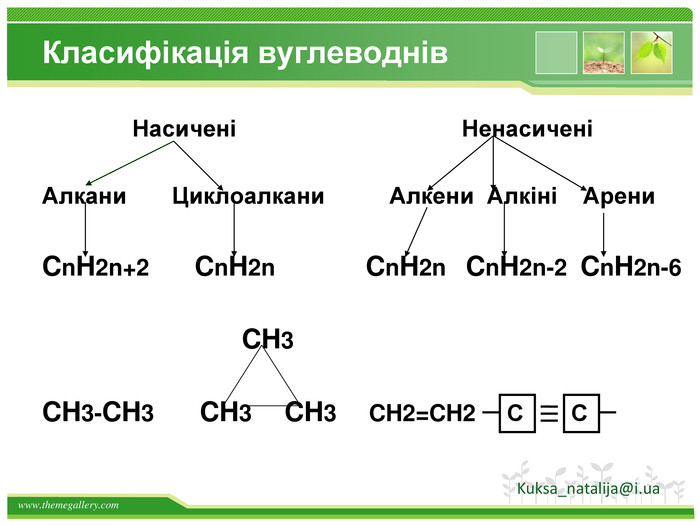
Структурні формули органічних речовин. Алкани – насичені вуглеводні ланцюгової будови. Загальна формула - Сn. H2n+2 Гомологічний ряд алканів: Назва. Молекулярна формула. Структурна формула. МЕТАНСН4 СН4 ЕТАНС2 Н6 СН3 – СН3 ПРОПАНС3 Н8 СН3 – СН2 – СН3 БУТАНС4 Н10 СН3–СН2–СН2-СН3 ПЕНТАНС5 Н12 СН3-СН2-СН2-СН2-СН3 метанетанпропанбутанпентан. Структурні формули алканів:
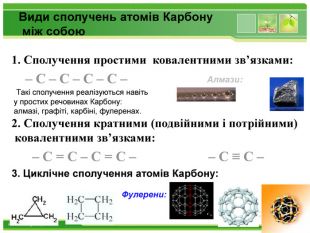
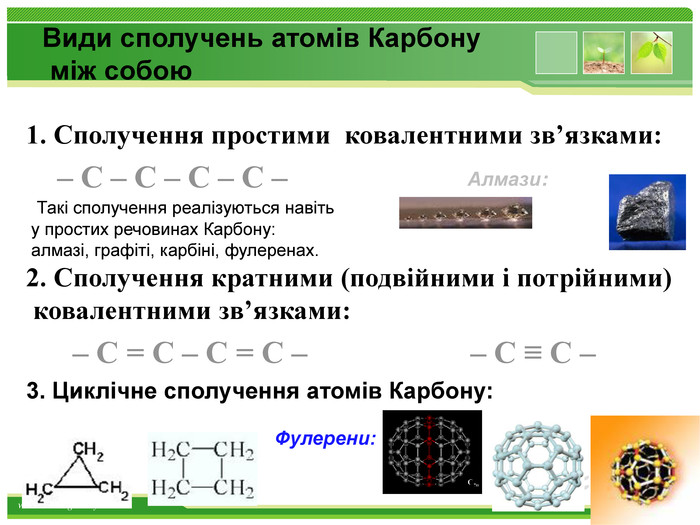
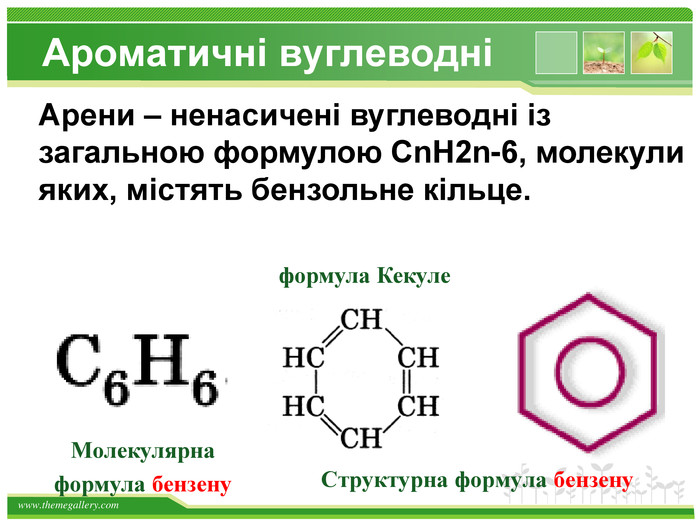
Види сполучень атомів Карбону між собою1. Сполучення простими ковалентними зв’язками: – С – С – С – С – Такі сполучення реалізуються навіть у простих речовинах Карбону: алмазі, графіті, карбіні, фулеренах.2. Сполучення кратними (подвійними і потрійними) ковалентними зв’язками: – С = С – С = С – – С ≡ С – 3. Циклічне сполучення атомів Карбону: Алмази: Фулерени:
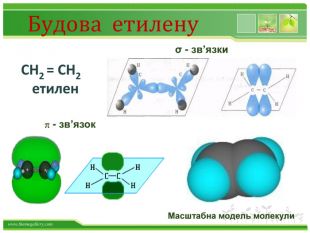
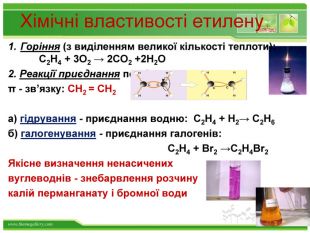
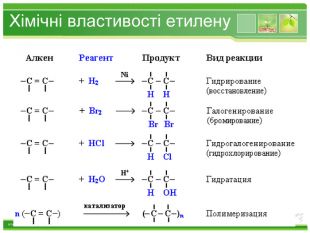
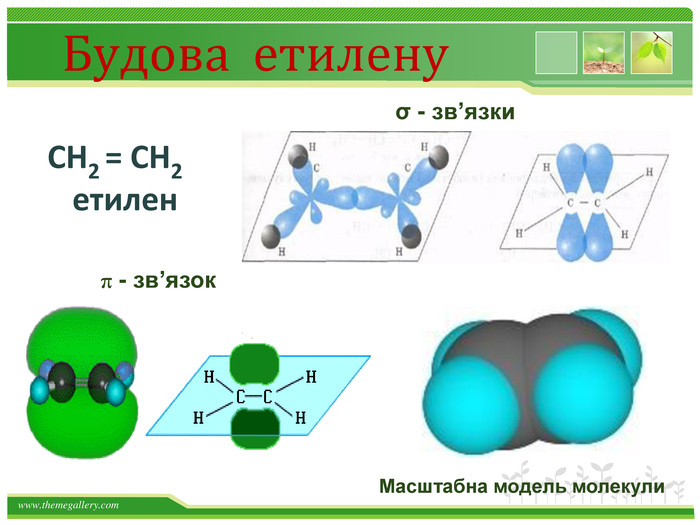
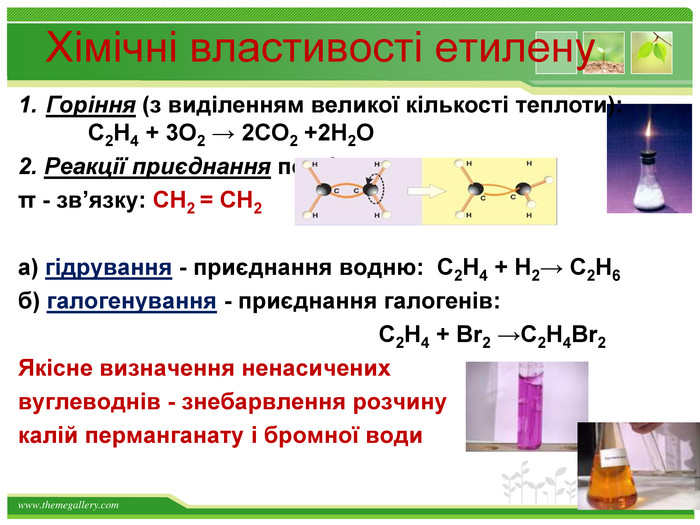
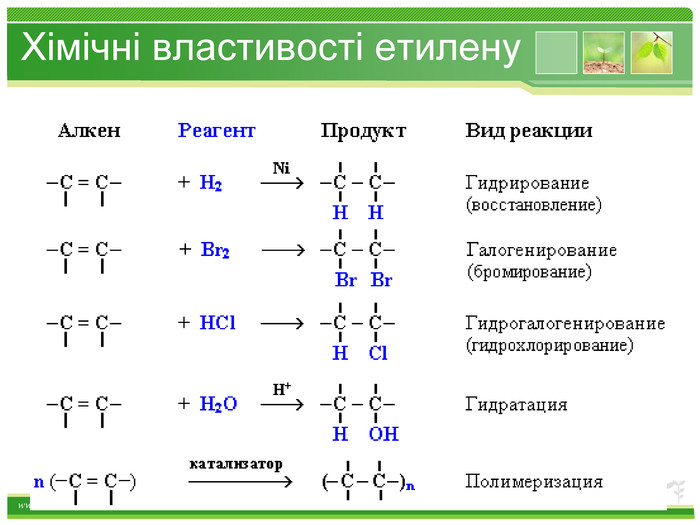
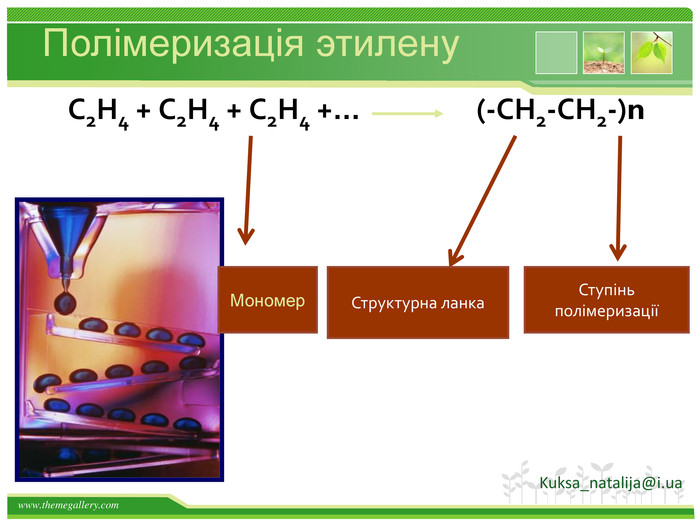
Хімічні властивості етилену. Горіння (з виділенням великої кількості теплоти): С2 Н4 + 3 O2 → 2 СО2 +2 Н2 О2. Реакції приєднання по місцю розривуπ - зв’язку: СН2 = СН2 а) гідрування - приєднання водню: С2 Н4 + Н2→ С2 Н6б) галогенування - приєднання галогенів: С2 Н4 + Br2 →С2 Н4 Br2 Якісне визначення ненасичених вуглеводнів - знебарвлення розчину калій перманганату і бромної водиppt_xxshearppt_xppt_xxshearppt_x
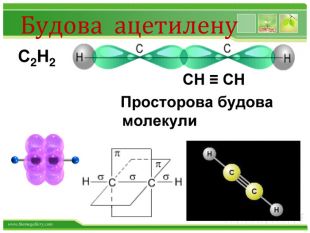
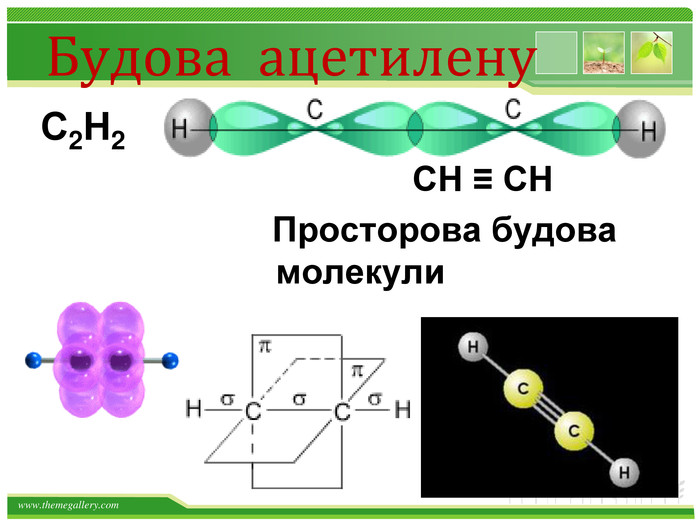
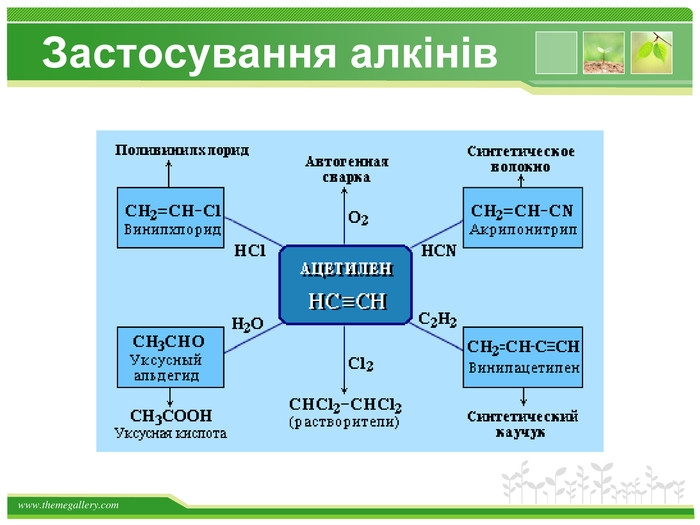
Хімічні властивості ацетилену. Горіння (яскравим кіптявим полум’ям): 2 С2 Н2 + 5 O2 → 4 СО2 +2 Н2 О2. Реакції приєднання по місцю розривуπ - зв’язків відбуваються у дві стадії а) гідрування (каталітичне): kat С2 Н2 + Н2→ С2 Н4 С2 Н4 + Н2→ С2 Н6 б) галогенування: С2 Н2 + Cl2 → С2 Н2 Cl2 (дихлороетен) С2 Н2 Cl 2 + Cl2 →С2 Н2 Cl4 (дихлороетан)Якісне визначення ненасичених вуглеводнів - знебарвлення бромної води та розчину калій перманганату.style.colorfillcolorfill.typestyle.colorfillcolorfill.typestyle.colorfillcolorfill.typestyle.colorfillcolorfill.typestyle.colorfillcolorfill.type
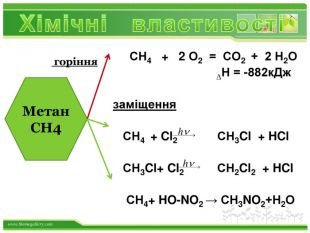
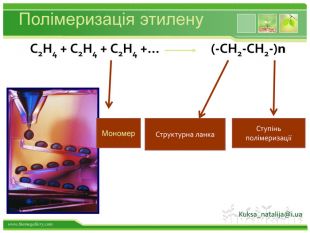
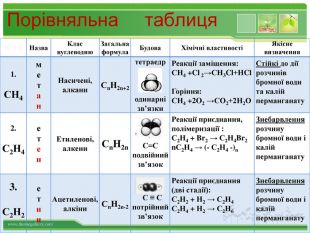
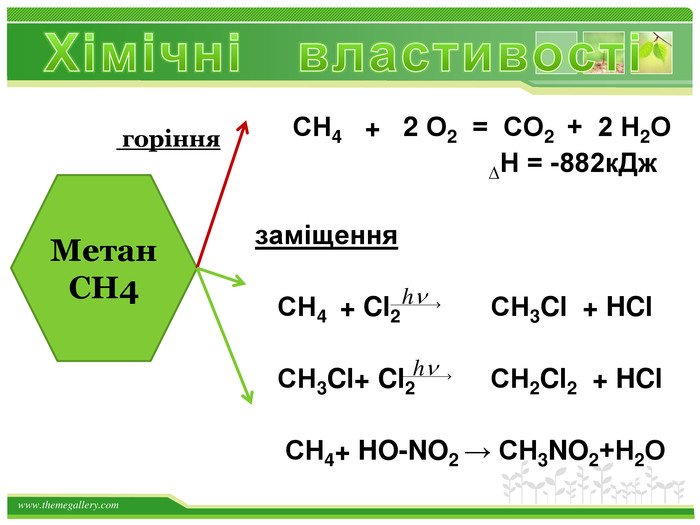
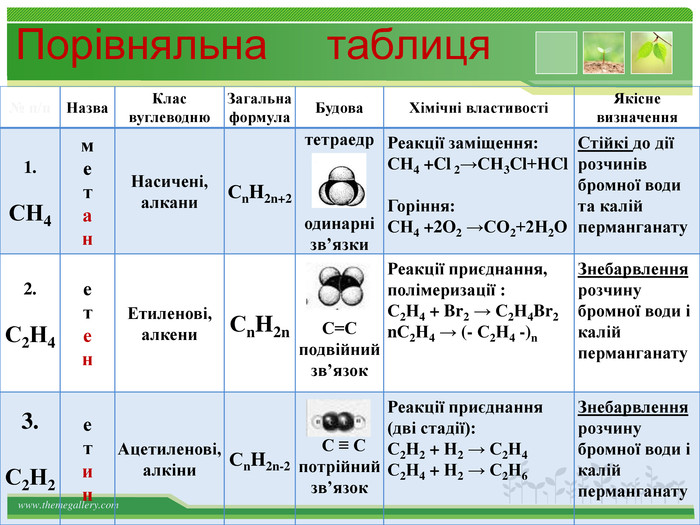
Порівняльна таблиця № п/п. Назва. Клас вуглеводню. Загальна формула. Будова. Хімічні властивостіЯкісне визначення1. СН4метан. Насичені,алкани. Сn. H2n+2 тетраедродинарні зв’язки. Реакції заміщення: СН4 +Cl 2→СН3 Cl+НCl. Горіння: СН4 +2 O2 →СО2+2 Н2 ОСтійкі до дії розчинів бромної води та калій перманганату2. С2 Н4 етен. Етиленові,алкени. Сn. H2n С=Сподвійний зв’язок. Реакції приєднання, полімеризації : С2 Н4 + Br2 → С2 Н4 Br2 n. С2 Н4 → (- С2 Н4 -)n Знебарвлення розчину бромної води і калій перманганату3. С2 Н2етин. Ацетиленові,алкіни. Сn. H2n-2 С ≡ С потрійнийзв’язок. Реакції приєднання (дві стадії): С2 Н2 + Н2 → С2 Н4 С2 Н4 + Н2 → С2 Н6 Знебарвлення розчину бромної води і калій перманганату
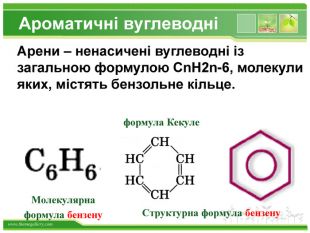
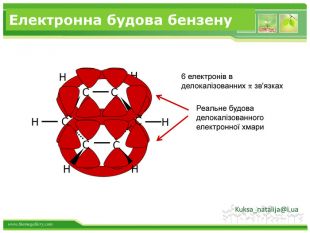
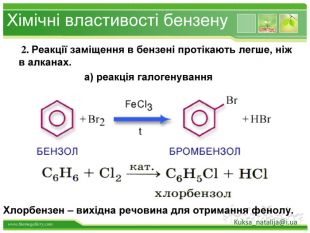
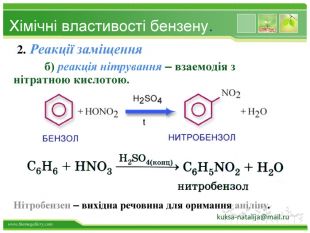
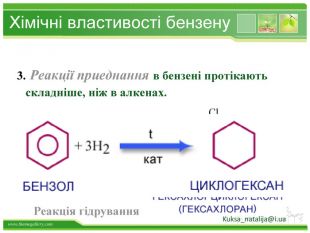
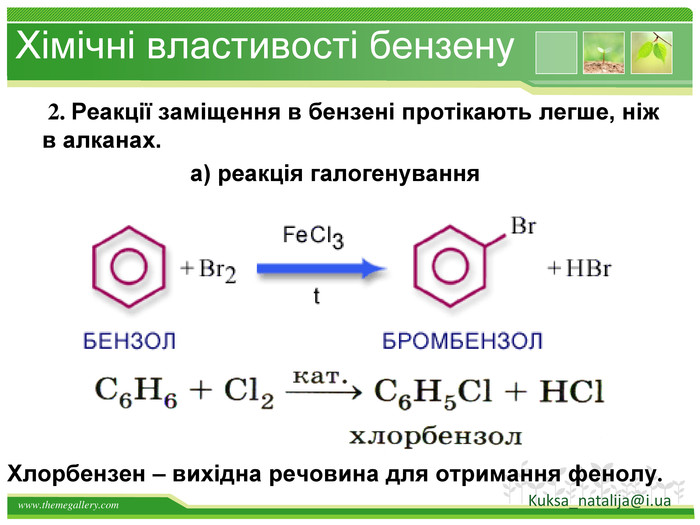
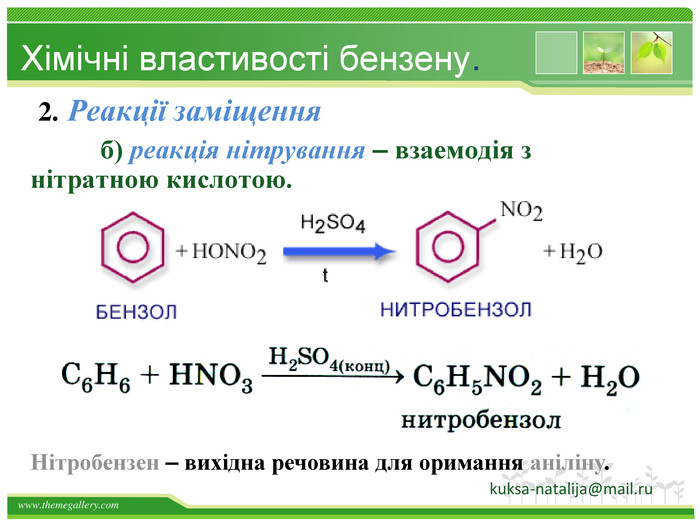
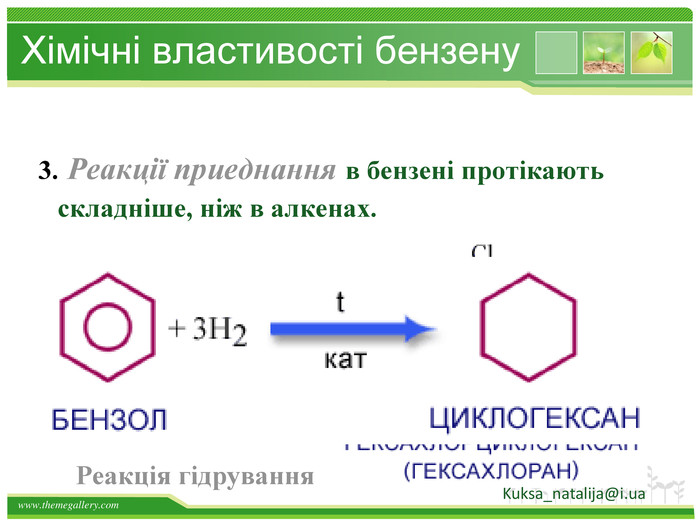
Бензен горить. Полум'я бензену кіптяве з за високого вмісту карбону в молекулі. Хімічні властивості бензену. Через особливсті будови молекули, бензен займає проміжне положення між алканами і алкенами, тобто може вступати в реакції приєднання і в реакції заміщення. Kuksa_natalija@i.uastyle.colorfillcolorfill.type
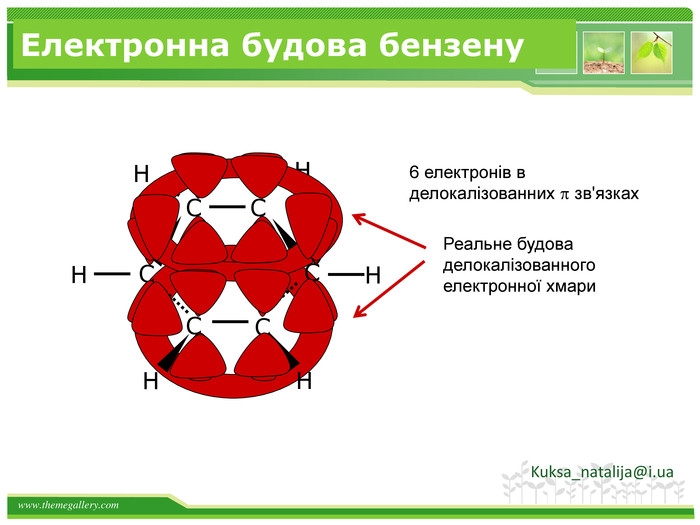
Хімічні властивості бензену. Незважаючи на високу ненасиченість молекули бензену (за складом), він не дає характерних, якісних реакцій для ненасичених вуглеводнів: не знебарвлює бромну воду і розчин перманганату калію. Це пов'язано з особливою будовою молекули бензену. Kuksa_natalija@i.ua
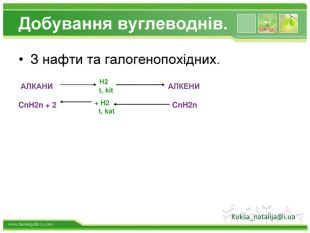
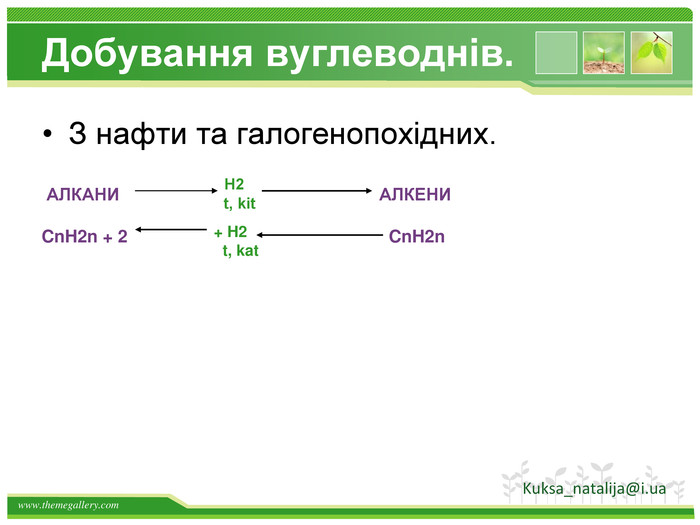
Добування бензену. Бензен є першим представником аренів. Його можна отримати трімерізаціей ацетилену. Бензен отримують при переробці кам'яного вугілля, а також при риформінгу бензинів з низьким октановим числом. Kuksa_natalija@i.uastyle.colorfillcolorfill.typestyle.colorfillcolorfill.type
-
Іванісова Валентина Михайлівна 15.09.2018 в 18:32Дякую ))Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0


про публікацію авторської розробки
Додати розробку