Презентація з хімії для учнів 8 класу на тему: "Характеристика хімічних елементів за їхнім місцем у періодичній системі й будовою атома"
Про матеріал
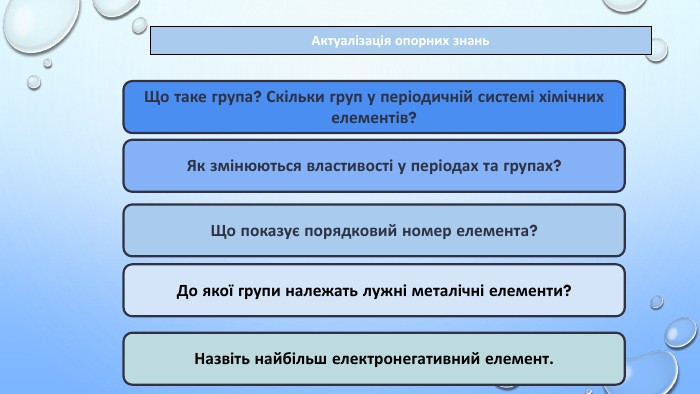
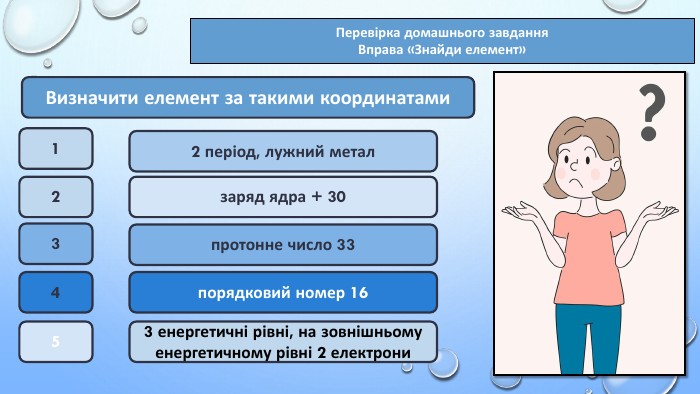
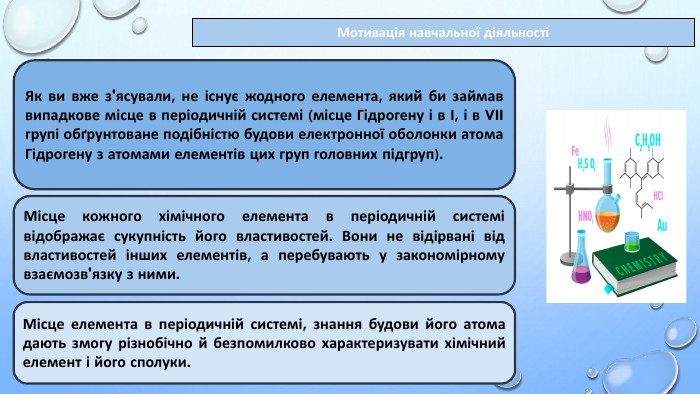
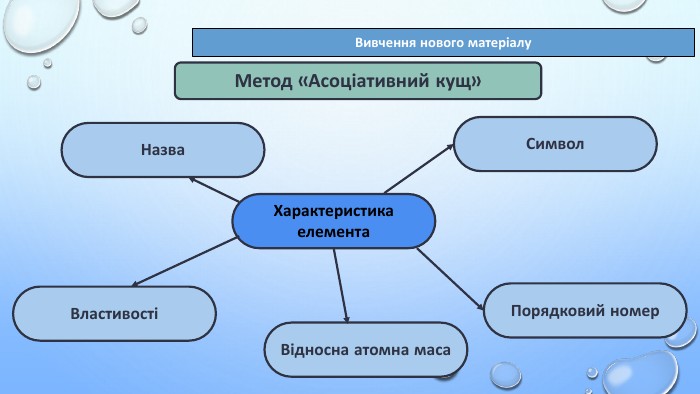
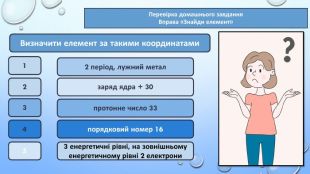
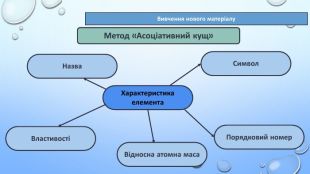
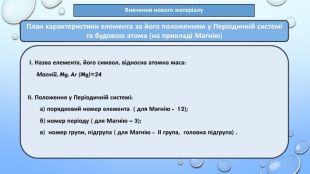
Тема уроку: "Характеристика хімічних елементів за їхнім місцем у періодичній системі й будовою атома"
Мета уроку:
- навчитися використовувати інформацію, закладену в періодичній системі, для класифікації, а також характеристики елементів, будови атомів;
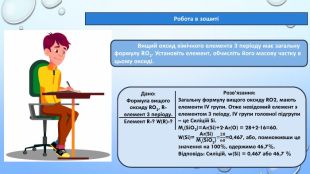
- набувати вміння встановлювати формули сполук, користуючись інформацією з періодичної системи.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку