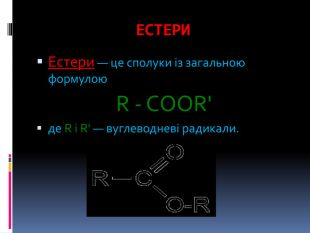
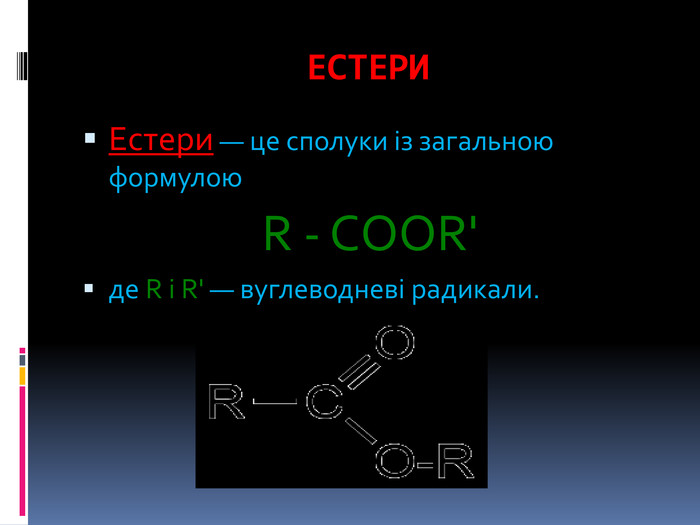
Презентація з теми: "Естери, жири, мила"

























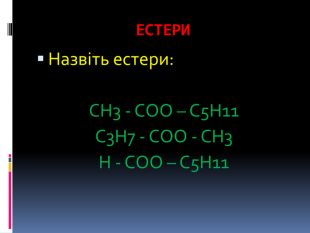
Хімічна розминка 1. Які сполуки називаються оксигеновмісними? 2. Які класи оксигеновмісних органічних речовин вам відомі ?3. Що таке функціональна група? 4. Які функціональні групи ви знаєте? 5. Які сполуки називаються спиртами? 6. Як класифікують спирти? 7. Формула гліцерину. 8. Які сполуки називаються карбоновими кислотами?
Фізичні властивості естерів Нижчі естери є рідинами. Зі збільшенням молекулярної маси температура плавлення та кипіння збільшується. Вищі естери є твердими речовинами. Естери не розчиняються у воді, добре розчиняються в спирті. Естери нижчих карбонових кислот і нижчих одноатомних спиртів мають приємний запах квітів, ягід і фруктів. • C3 H7 - COO - CH3 (метилбутаноат (метиловий естер бутанової кислоти), має запах яблука). Естери вищих одноосновних кислот і вищих одноатомних спиртів — основа природних восків. Наприклад, бджолиний віск містить естер пальмітинової кислоти й мірицилового спирту (мірицилпальмітат) CH3(CH2)14 - CO - OCH2(CH2)29 CH3.
Хімічні властивості естерів Гідроліз естерів (оборотна реакція): Гідроліз за присутності лугу відбувається необоротно (оскільки негативно заряджений карбоксилат-аніон RCOO-, що при цьому утворюється, не вступає в реакцію з нуклеофільним реагентом — спиртом). Ця реакція називається омиленням естеру.
Добування естерів Естери можна одержати в результаті взаємодії карбонових кислот зі спиртами (реакція естерифікації). Каталізаторами є мінеральні кислоти. Ця реакція є оборотною. Зворотний процес — розщеплення естеру внаслідок дії води з утворенням карбонової кислоти та спирту — називають гідролізом естеру.
Застосування естерів Ще в 30-х роках ХХ століття український академік Холодний висловив думку, що дерева і кущі та трави виділяють особливі атмовітаміни, які, можливо, застосовуються легенями і є каталізаторами біохімічних процесів обміну речовин. Час підтвердив його правоту. Суміші летючих фітоорганічних речовин були відкриті, їх назвали ефірними маслами, і у світі налічувалося більше 3000 ефіромаслянистих рослин.
ЖИРИІсторична довідка Дослідження жирів відомим французьким хіміком Шеврелем в 1811 –1823 роках належить до числа класичних робіт, які створили фундамент органічної хімії. Він встановив, що жири складаються з гліцерину і кислот, що одержали назву жирних. Омиленням жирів одержав стеаринову , олеїнову та інші кислоти. Назвав «солодку олію», відкриту Шеєле гліцерином. Синтез жирів з гліцерину і жирних кислот був вперше здійснений в 1854 році М. Бертло.
ЖИРИ Природні жири – суміші різних тригліцеридів. Загальна назва таких сполук – тригліцериди відповідної кислоти, або у назві кислоти закінчення –ова змінюється на –ин і ставиться префікс, який вказує кількість гідроксильних груп, що прореагували, наприклад, трипальмітин. Завдання: Використовуючи загальну формулу , скласти формули жирів , утворених гліцеролом та: а) стеариновою кислотою ; б) олеїновою кислотою.
Фізичні властивості жирів Відомо близько 600 видів жирів, 420 з них рослинного походження,180 – тваринного. Жири, в яких переважають насичені жирні кислоти - це жири тваринного походження, тверді жири, за винятком риб’ячого жиру; в яких переважають ненасичені – як правило, рідкі жири, рослинні олії, за виключенням кокосового масла. Жири не розчиняються у воді, погано розчиняються у спирті. У пробірці з бензином розчин майже прозорий , отже, олія розчинилась . Для жирів характерне емульгування – утворення з водою емульсій під впливом поверхнево активних речовин, тому бульйони необхідно готувати при помірному кипінні, так як при сильному кипінні утворюється непрозорий розчин – емульсія.
Хімічні властивості жирів3. Реакція гідрування . Гідрування жирів – це процес , який проводять для перетворення рідких олій на тверді жири за рахунок приєднання Гідрогену до залишків ненасичених кислот. 4. Окиснення жирів – прогіркання. Під дією світла , тепла , вологи , кисню повітря відбувається часткове окиснення залишків ненасичених кислот до альдегідів та кетонів.
Роль і значення жирів Гідроліз жирів та їх синтез з гліцерину і вищих карбонових кислот – оборотні процеси, вони мають велике значення в життєдіяльності організмів та народному господарстві. Гідроліз відбувається в організмі – жири, які ми споживаємо під впливом ферментів піддаються гідролізу. Гліцерин та карбонові кислоти, що утворилися, всмоктуються в кишечнику і знову утворюють жир, необхідний організму .
Добування мила У промисловості мило добувають лужним гідролізом жирів. Цей процес ще називають омиленням жирів. Для омилення жирів замість лугу можна використовувати соду Na2 CO3. Мило, добуте внаслідок цієї реакції, називається ядровим милом і відоме як господарське мило. Туалетне мило відрізняється від господарського наявністю добавок: барвників, запашних речовин, антисептиків тощо. Основою для виробництва натурального мила є олія (соняшникова, бавовняна), тваринний жир. Синтетичне мило отримують окисненням парафіну.
Фізичні властивості мила Властивості мила: твердість, розчинність у воді, здатність до піноутворення, мийна здатність. Властивості залежать від складу карбонових кислот. Пальмітинова кислота забезпечує твердість і високе піноутворення, олеїнова – розчинність у холодній воді і мийну здатність, стеаринова кислота - посилює дію мила у гарячій воді. Високоякісні сорти мила виготовляють з додаванням лауринової кислоти С11 Н23 СООН, що міститься в кокосовому маслі.
Мийна дія мила Мийна дія мила — складний фізико-хімічний процес. Мило є посередником між полярними молекулами води і неполярними часточками бруду, нерозчинного у воді. Якщо позначити вуглеводневий радикал буквою R, то склад мила виражається формулою R—COONa. За хімічною природою мило — це сіль, йонна сполука. Під час миття молекули мила так орієнтуються на забрудненій поверхні, що полярні групи звернені до полярних молекул води, а неполярні вуглеводневі радикали — до неполярних часток бруду. Останні ніби потрапляють в оточення молекул мила і легко змиваються з поверхні водою. Мийний ефект мила зумовлений процесами, що відбуваються на поверхні розчину, де в зв’язку зі специфікою будови зосереджені молекули мила (такі речовини називаються поверхнево-активними — ПАР).
Синтетичні мийні засоби В наш час дуже поширеними є синтетичні миючі засоби. Вони мають добру мийну дію і не втрачають її у твердій воді. До ефективних синтетичних мийних засобів належать алкілсульфати. Це натрієві солі моноестерів сульфатної кислоти з вищими спиртами RO– SO2 ONa, де R – насичений вуглеводневий радикал. Молекули цих солей містять 12–14 атомів Карбону і мають дуже добрі мийні властивості. Кальцієві та магнієві солі їх розчинні у воді, а тому такі мийні засоби миють і у твердій воді. Вони входять до складу поширених пральних порошків. R-CH2 OH + H-O-SO2-OH → R-CH2- SO2-OH + H2 O R-CH2- SO2-OH + Na. OH → R- CH2- SO2-ONa + H2 O


про публікацію авторської розробки
Додати розробку