Урок "Фенол: загальна формула, властивості, якісна реакція на феноли, використання, його вплив на організм людини та навколишнє середовище"
Урок № 24 Дата________ Хімія 10 клас
Розробив урок: вчитель Чмирівського ОЗЗСО І-ІІІ ступенів «Чмирівський ліцей», Бондар Світлана Анатоліївна
Тема. Фенол: загальна формула, властивості, якісна реакція на феноли, використання, його вплив на організм людини та навколишнє середовище
Мета:
навчальна: розширити уявлення учнів про оксигеновмісні органічні сполуки на прикладі фенолів; ознайомити з молекулярними, електронними й структурними формулами фенолу та його гомологів, фізичними властивостями, зумовленими наявністю бензольного кільця й функціональної гідроксильної групи; показати взаємний вплив атомів у молекулі фенолу, його вплив на фізичні й хімічні властивості фенолу; ознайомити учнів з якісною реакцією на феноли;
розвивальна: формувати уявлення учнів про використання фенолу у виробництві інсектицидів, охорону навколишнього середовища від відходів, що містять фенол; розвивати екологічні знання учнів;
виховна: формувати дбайливе ставлення до природи.
Розвиток компетентностей:
- спілкування державною мовою;
- екологічна грамотність і здоров’язбережувальна компетентність.
Обладнання: презентація, хмаринка тегів, кросворди, ребуси, Qr-коди, картки із завданнями.
Матеріали: аспірин, розчин ферум (ІІІ) хлориду, вода, ступка із товкачем, пробірка, мірна ложка, скляна паличка.
Тип уроку: комбінований
Хід уроку
І. Організаційний момент (привітання, перевірка готовності до уроку)
- Бажаю нам плідно попрацювати і отримати задоволення від навчання!
ІІ. Актуалізація опорних знань (колективна робота з «хмаринкою тегів», фронтальне опитування)
- Уважно подивіться на хмаринку тегів (Додаток №1), знайдіть терміни і поняття, які ми вивчили з вами на попередніх уроках. Підкресліть їх і по черзі, ланцюжком дайте визначення цих понять і термінів.
ІІІ. Мотивація навчальної діяльності (проблемне питання).
- Сполука, яку ми вивчимо сьогодні на уроці, має тісний зв’язок з термінами і поняттями, які ми щойно знайшли і розшифрували. Але, щоб дізнатися її склад, властивості, я пропоную виконати завдання в групах.
ІV. Вивчення нового матеріалу (робота в групах за завданнями на картках та Qr-кодами, вчитель наголошує про правила роботи в групах)
1 група. Встановлення хімічної формули фенолу; вивчення його фізичних властивостей.
Завдання для першої групи (Додаток №2):
1). Розв’язати задачу
Виведіть хімічну формулу оксигеновмісної органічної речовини, яка за звичайних умов є білою кристалічною, а на повітрі окислюється і стає рожевою, добре розчинна у воді. Тривіальна назва карболова кислота. Завдяки цій властивості раніше використовувалася як антисептик, що було дуже шкідливим, бо її розчини можуть спричиняти опіки. Відомо, що масова частка карбону становить 77%, масова частка гідрогену – 6,4% , а масова частка оксигену – 17%. Відносна молекулярна маса даної сполуки – 94 г/моль.
2). За допомогою Qr-коду, використовуючи інтернет-ресурс, ознайомтеся із фізичними властивостями фенолу та його похідних.
2 група. Хімічні властивості фенолу. Якісна реакція на феноли (Додаток №3)
Завдання для другої групи:
1). Розгадати ребуси.
2). За допомогою Qr-коду, використовуючи інтернет-ресурс, ознайомтеся із хімічними властивостями фенолу та його похідних.
3). Виконати лабораторне дослідження: «Якісна реакція на фенол».
Інструктивна картка
- Дотримуватися техніки безпеки під час роботи з лабораторним посудом та хімічними реактивами.
- У ступі розтовкти одну пігулку аспірину.
- Мірною ложечкою помістити 1-2 ложки розтертого аспірину і додати 2-3 мл води і перемішати скляною паличкою.
- До утвореного розчину додати розчин ферум (ІІІ) хлориду.
- Оформити звіт роботи та зробити висновки.
3 група. Вивчення фенолу та його вплив на організм людини та навколишнє середовище (Додаток №4).
Завдання для третьої групи:
1). Розгадати кросворд.
2). За допомогою Qr-коду, використовуючи інтернет-ресурс, ознайомтеся з інформацією щодо впливу фенолу та його похідних на організм людини та навколишнє середовище. Презентувати у вигляді схеми або таблиці.
V. Первинне закріплення нового матеріалу (групи по черзі презентують свої напрацювання).
VІ. Рефлексія (скласти сенкан – п’ятирядковий неримований вірш)
Наприклад,
Фенол
Білий, твердий
Розчиняється, дезінфікує, отруює
Дуже гарний антисептик!
Карболова кислота.
VІІ. Підведення підсумків уроку. Домашнє завдання
Опрацювати матеріал підручника. За матеріалом підручника скласти 6 тверджень для вправи «Вірю-не вірю».
ДОДАТКИ ДО УРОКУ
Додаток №1
«Хмаринка тегів»

Додаток №2
Завдання для І групи
1). Розв’язати задачу
Виведіть хімічну формулу оксигеновмісної органічної речовини, яка за звичайних умов є білою кристалічною, а на повітрі окислюється і стає рожевою, добре розчинна у воді. Тривіальна назва карбонільна кислота. Завдяки цій властивості раніше використовувалася як антисептик, що було дуже шкідливим, бо її розчини можуть спричиняти опіки. Відомо, що масова частка карбону становить 77%, масова частка гідрогену – 6,4% , а масова частка оксигену – 17%. Відносна молекулярна маса даної сполуки – 94 г/моль.
2) За допомогою Qr-коду, ознайомтеся із фізичними властивостями фенолу та його похідних.



У випадку відсутності програми для сканування Qr-коду, учням пропонується наступний текст для ознайомлення.
Фено́л — органічна сполука складу C6H5OH. За звичайних умов фенол є білою або безбарвною кристалічною речовиною із солодкуватим запахом, помірно розчинною у воді.
Молекула фенолу складається з бензенового ядра, безпосередньо до якого приєднана гідроксильна група (альтернативна назва фенолу — гідроксибензен). Наявність гідроксильної групи визначає приналежність фенолу до ряду спиртів, а окрім цього він є найпростішим представником ряду фенолів, в яких до бензенового кільця приєднано одну або більше гідроксильну групу.
Оскільки гідроксильна група у молекулах спиртів визначає кислотні властивості, у давнині фенол мав назву карболова кислота. Проявляючи кислотні властивості, фенол, аналогічно до інших спиртів, взаємодіє з лугами із утворенням солей — фенолятів.
Історія
Фенол був відкритий у 1834 році Фрідлібом Фердинандом Рунге, який виділив його з кам'яновугільної смоли шляхом перегонки, а також і запропонував назву для новоствореної речовини — карболова кислота.
У чистому вигляді фенол вперше був отриманий у 1841 році Огюстом Лораном, який також зміг визначити його якісний склад. Він запропонував назву фенолова кислота, яку Шарль Фредерік Жерар скоротив до сучасного фенол. Крапку у ґрунтовному дослідженні фенолу поставив Август Кекуле в 1858 році, встановивши його будову.
Основним застосуванням фенолу у 19 столітті було приготування антисептиків і дезінфектантів. Знезаражування у лікарській справі за допомогою фенолу було відкрите і широко впроваджене британським хіругом Джозефом Лістером у 1860-х роках. Він обробляв фенолом не лише відкриті рани, а й хірургічні інструменти, завдяки чому зміг скоротити кількість летальних випадків під час операцій з 50 до 15 %.
Стрімке зростання попиту на фенол припадало на періоди масового виробництва речовин, які були похідними фенолу, зокрема, саліцилової кислоти, відкритої у 1897 році, феноловмісних синтетичних смол на кшталт бакеліту після Першої світової війни, а також бісфенолів і полікарбонатів після Другої світової.
Фізичні властивості
За кімнатної температури фенол є білими або безбарвнимим кристалами, котрі поступово рожевіють за наявності домішок або при дії світла чи повітря.
У проміжку від 0 до 65 °C фенол обмежено розчиняється у воді, а вище 65,3 змішується у будь-яких пропорціях. Він добре розчиняється у спиртах, бензені, хлороформі, етерах.
Додаток №3
Завдання для ІІ групи
-
 Розгадати ребуси
Розгадати ребуси

![]()
![]()
![]()
![]()



 2. За допомогою Qr-коду, ознайомтеся із хімічними властивостями фенолу та його похідних.
2. За допомогою Qr-коду, ознайомтеся із хімічними властивостями фенолу та його похідних.
3. Інструктивна картка до лабораторного досліду «Якісна реакція на фенол».
- Дотримуватися техніки безпеки під час роботи з лабораторним посудом та хімічними реактивами.
- У ступі розтовкти одну пігулку аспірину.
- Мірною ложечкою помістити 1-2 ложки розтертого аспірину і додати 2-3 мл води і перемішати скляною паличкою.
- До утвореного розчину додати розчин ферум (ІІІ) хлориду.
- Оформити звіт роботи та зробити висновки.
У випадку відсутності програми для сканування Qr-коду, учням пропонується наступний текст для ознайомлення
Хімічні властивості. Фенол вступає в хімічні реакції, обумовлені гідроксигрупою та ароматичним ядром.
Кислотні властивості. Фенол виявляє властивості кислоти, слабшої за вугільну (К = 10–10), але сильнішої за спирти. Його водні розчини містять достатню кількість іонів водню, щоб змінити колір індикаторів (наприклад, метилоранж набуває червоного забарвлення):
![]()
![]()
Фенол легко взаємодіє не лише з металічним натрієм, але й з лугами, утворюючи солі – феноляти (порівняйте з властивостями аліфатичних одноатомних спиртів):
Феноляти гідролізуються в розчини (реакція розчину лужна) і розкладаються мінеральними кислотами, навіть вугільною:
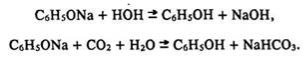
Взаємодія з формальдегідом. Фенол реагує з формальдегідом за реакцією поліконденсації і утворює фенол-формальдегідні смоли. Цю реакцію буде розглянуто в розділі, де наведені властивості альдегідів.
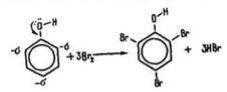
Взаємодія з бромною водою. На відміну від бензолу фенол утворює з бромною водою 2,4,6-трибромфенол:
Додаток №4
Завдання для ІІІ групи
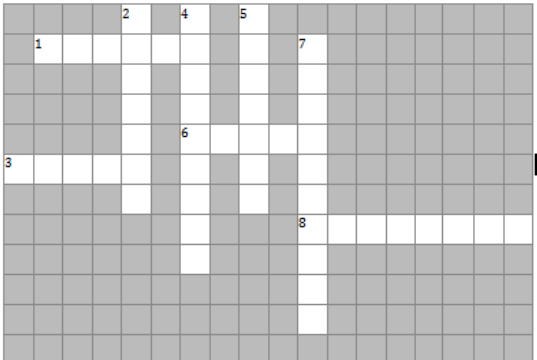
По горизонталі:
- Речовини, які викликають інтоксикацію організму.
3. Оксигеновмісна органічна сполука, похідна бензолу.
6. Термічне пошкодження шкіри.
8. Штучні синтетичні матеріали, виготовлені з фенол-формальдегідних смол.
По вертикалі:
- Природні джерела вуглеводнів.
4. Тривіальна назва фенолу.
5. Метод перегонки вугілля.
7. Синонім дезінфікуючих засобів.
2. За допомогою Qr-коду, використовуючи інтернет-ресурс, ознайомтеся з інформацією щодо впливу фенолу та його похідних на організм людини та навколишнє середовище. Презентуйте у вигляді схеми або таблиці «Позитивний і негативний вплив».

У випадку відсутності програми для сканування Qr-коду, учням пропонується наступний текст для ознайомлення.
Що таке фенол і його вплив на організм людини?
Фенол – це хімічне органічна речовина, вуглеводень. Інші назви – карболова кислота, гидроксибензол. Він буває природного та промислового походження. Що таке фенол і яке його значення в житті людини?
Походження речовини, хімічні та фізичні властивості
Хімічна формула фенолу – c6h5oh. За зовнішнім виглядом речовина нагадує кристали у вигляді голок, прозорі, з білим відтінком. На відкритому повітрі при взаємодії з киснем забарвлення набуває світло-рожевий колір. Для речовини характерний специфічний запах. Фенол пахне як фарба гуаш.
Природні феноли – це антиоксиданти, які в різних кількостях присутні у всіх рослинах. Вони обумовлюють колір, аромат, захищають рослини від шкідливих комах. Природний фенол корисний для організму людини. Він міститься в оливковій олії, зернах какао, фруктах, горіхах. Але зустрічаються і отруйні сполуки, наприклад, танін.
Хімічна промисловість виробляє ці речовини шляхом синтезу. Вони отруйні і дуже токсичні. Фенол небезпечний для людини, також промислові масштаби його виробництва значно забруднюють навколишнє середовище.
Фізичні властивості:
- нормально розчиняється фенол у воді, спирті, луги;
- має низьку температуру плавлення, при 40°C перетворюється в газ;
- за своїми властивостями багато в чому нагадує спирт;
- володіє високою кислотністю і розчинністю;
- при кімнатній температурі знаходяться в твердому стані;
- запах фенолу різкий.
Як застосовують феноли
Більше 40% речовин використовують у хімічній промисловості для одержання інших органічних сполук, в основному смол. Також з нього штучні волокна – капрон, нейлон. Речовина застосовують в нафтопереробній галузі для очищення масел, які застосовують в бурових установках та інших технологічних об’єктах.
Фенол використовують для виробництва лакофарбової продукції, пластмас, в складі хімікатів і пестицидів. У ветеринарії речовиною на фермах обробляють тварин сільськогосподарського значення для профілактики інфекцій.
Застосування фенолу у фармацевтичній промисловості значне. Він входить до складу багатьох лікарських препаратів:
- антисептики;
- знеболюючі;
- антиагреганти (розріджують кров);
- як консервант для виробництва вакцин;
- у косметології у складі препаратів для хімічного пілінгу.
В генній інженерії фенол застосовують для очищення ДНК і його виділення з клітини.
Токсична дія фенолу
Фенол – це отрута. По своїй токсичності з’єднання відноситься до 2-го класу небезпеки. Це означає, що воно високоопасное для навколишнього середовища. Ступінь впливу на живі організми висока. Речовина здатна нанести серйозної шкоди екологічній системі. Мінімальний період відновлення після дії фенолу становить мінімум 30 років, за умови повної ліквідації джерела забруднення.
Синтетичний фенол вплив на організм людини надає негативний. Токсична дія з’єднання на органи і системи:
- При вдиханні парів або проковтуванні уражаються слизові оболонки травного тракту, верхніх дихальних шляхів, очей.
- При попаданні на шкіру утворюється опік фенолом.
- При глибокому проникненні викликає некроз тканин.
- Має виражену токсичну дію на внутрішні органи. При ураженні нирок викликає пієлонефрит, руйнує структуру еритроцитів, що призводить до кисневого голодування. Здатний викликати алергічний дерматит.
- При вдиханні фенолу у великих концентраціях порушується робота мозкової діяльності, може призвести до зупинки дихання.
Механізм токсичної дії фенолів полягає в зміні структури клітини і, як наслідок, її функціонування. Найбільш сприйнятливі до отруйних речовин нейрони (нервові клітини).
Гранично допустима концентрація (ГДК фенолу):
- максимально разова доза в атмосфері для населених місць становить 0,01 мг/м3, яка тримається в повітрі протягом півгодини;
- середньодобова доза в атмосфері для населених місць становить 0,003 мг/м3;
- смертельна доза при потраплянні всередину організму становить для дорослих від 1 до 10 г, для дітей від 0,05 до 0,5 р.
Симптоми отруєння фенолом
Шкода фенолу на живий організм давно доведено. При попаданні на шкіру або слизові з’єднання швидко всмоктується, долає гематогенний бар’єр і з кров’ю розноситься по всьому тілу.
Першим на дію отрути реагує головний мозок. Ознаки отруєння у людини:
- Психіка. Спочатку пацієнт відчуває легке збудження, яке триває недовго і переходить роздратування. Потім наступає апатія, байдужість до подій навколо, людина перебуває в пригніченому стані.
- Нервова система. Наростає загальна слабість, млявість, занепад сил. Змащується тактильна чутливість, але реакція на світло і звуки загострюється. Постраждалий відчуває нудоту, яка не пов’язана з роботою травної системи. З’являється запаморочення, головний біль стає більш інтенсивним. Тяжке отруєння може призвести до судом та несвідомого стану.
- Шкірні покриви. Шкіра стає блідою і холодною на дотик, при важкому стані набуває синього відтінку.
- Органи дихання. При попаданні навіть незначних доз в організм у людини з’являється задишка і прискорене дихання. Через подразнення слизової носа у потерпілого безперервне чхання. При отруєнні середнього ступеня тяжкості розвивається кашель і спастичні скорочення гортані. У важких випадках зростає загроза спазму трахеї і бронхів і, як наслідок, задуха, що приводить до летального результату.
Обставини, при яких може відбутися отруєння – порушення правил техніки безпеки при роботі з особливо небезпечними речовинами, передозування лікарськими препаратами, побутовому отруєнні миючими і чистячими засобами, в результаті нещасного випадку.
Якщо в будинку знаходиться меблі низької якості, дитячі іграшки, не відповідають міжнародним стандартам безпеки, стіни пофарбовані фарбою, не призначеної для цих цілей, то вихідні пари фенолу людина вдихає постійно. В цьому випадку розвивається хронічне отруєння. Його основна ознака – синдром хронічної втоми.
Принципи надання першої допомоги
Перше, що необхідно зробити, це перервати контакт людини з отруйною джерелом.
Постраждалого винести з приміщення на свіже повітря, розстібнути ґудзики, замки, блискавки, щоб краще забезпечити доступ кисню.
Якщо розчин фенолу потрапив на одяг, її негайно зняти. Уражену шкіру і слизову оболонку очей багаторазово і ретельно промити проточною водою.
Категорично не можна обробляти шкірні покриви маслами, мазями, спиртом, харчовим жиром.
При попаданні фенолу в ротову порожнину нічого не ковтати, а негайно прополоскати рот протягом 10 хвилин. Якщо речовина встигло потрапити в шлунок, можна випити сорбент зі склянкою води:
- активоване або білий вугілля;
- ентеросорб;
- ентеросгель;
- сорбекс;
- карболен;
- полісорб;
- лактофільтрум.
Не можна промивати шлунок, так як ця процедура підсилить ступінь опіку і збільшить площу ураження слизової.
Антидот фенолу – розчин глюконату кальцію для внутрішньовенного введення. При отруєння будь-якого ступеня тяжкість потерпілий доставляється в лікарню для спостереження та лікування.
Вивести фенол з організму в умовах стаціонару при важких отруєннях можна такими методами:
- Гемосорбція – очищення крові спеціальним сорбентом, який зв’язує молекули отруйної речовини. Кров очищається шляхом прогону в спеціальному апараті.
- Дезінтоксикаційна терапія – внутрішньовенне вливання розчинів, які розбавляють концентрацію речовини в крові і сприяють його природному виведенню з організму через нирки).
- Гемодіаліз показаний у важких випадках, коли є потенційна загроза життю. Процедура проводиться за допомогою апарата «штучна нирка», в якому кров проходить через спеціальні мембрани і залишає молекули отруйної речовини. В організм кров повертається чиста і насичена корисними мікроелементами.
Фенол – це синтетичне отруйна речовина, небезпечна для людини. Навіть з’єднання природного походження може завдати шкоди здоров’ю. Щоб уникнути отруєння, необхідно з відповідальністю ставиться до роботи на виробництві, де є ризик контакту з отрутою. При покупках цікавитися складом продукції. Неприємний запах пластмасових виробів повинен насторожити. При вживанні лікарських препаратів з вмістом фенолу дотримуватися визначене дозування.

про публікацію авторської розробки
Додати розробку
