Презентація з теми: "Природа хімічного зв'язку."
Презентація з теми "Природа хімічного зв'язку."
Розробка уроку за посиланням:
https://naurok.com.ua/urok-priroda-himichnogo-zv-yazku-373624.html
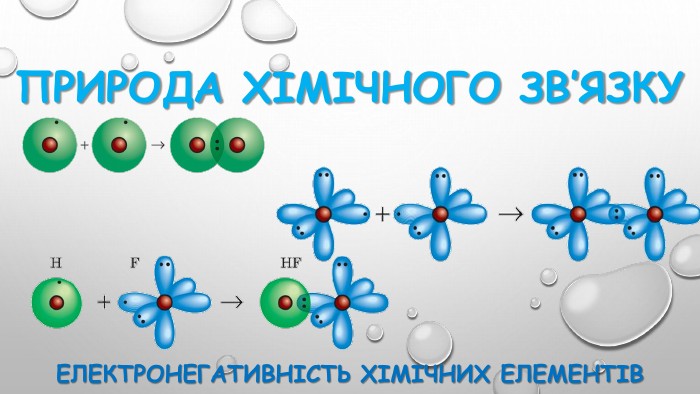






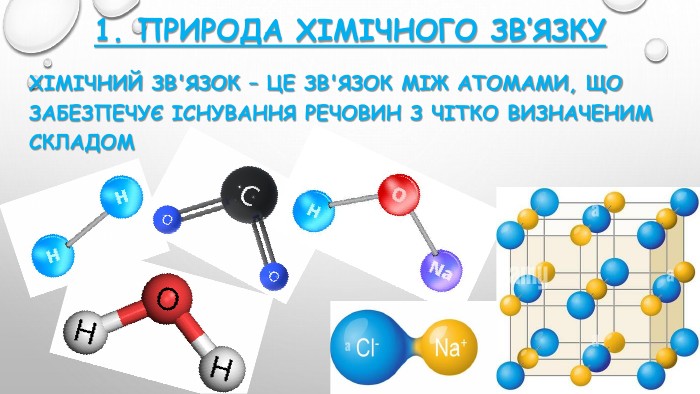
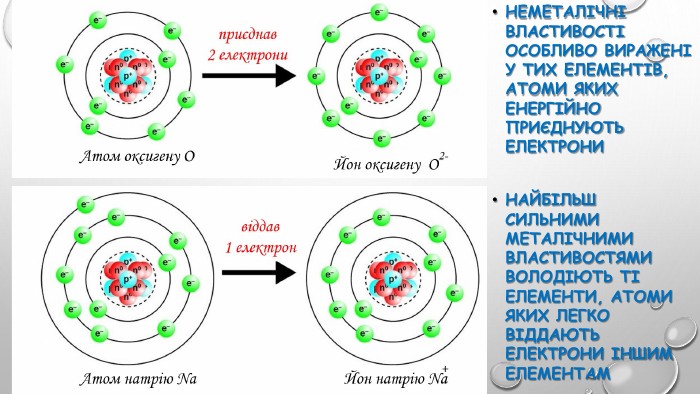















уривок із твору Льюіса Керролла «Аліса в Країні чудес»: За кілька кроків від неї сидів на гілці Чеширський кіт. Скажіть, будь ласка, куди мені звідси йти? А куди ти хочеш потрапити? - спитав у відповідь кіт. Мені все одно… - сказала Аліса. Тоді все одно куди йти. - зауважив кіт. Що хоче сказати кіт Алісі та навіщо я прочитала ці слова на початок уроку? Ваша думка?Так, правильно, потрібно знати мету своєї роботи.
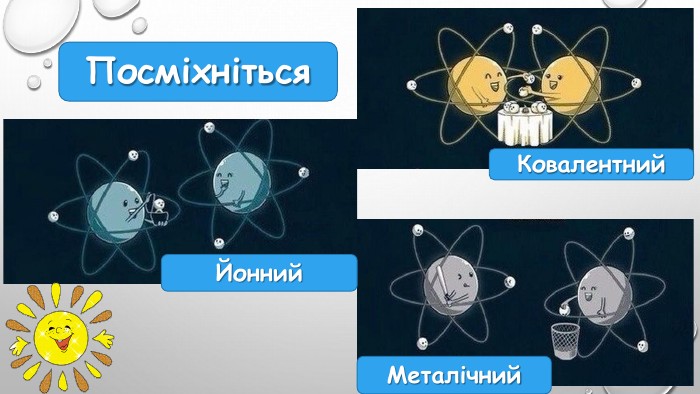
предметні компетентності: Знаннєвий компонент. Учні мають: - називати види хімічного зв’язку; - наводити приклади сполук із ковалентним (полярним і неполярним) та йонним хімічними зв’язками; - пояснювати утворення йонного, ковалентного (полярного і неполярного) зв'язків. Діяльнісний компонент. Учні мають: - складати електронні формули молекул; - характеризувати особливості ковалентного, йонного та інших зв’язків; - визначати вид хімічного зв’язку в типових випадках, полярність ковалентного зв'язку; - прогнозувати фізичні властивості та практичне використання речовин залежно від виду хімічного зв'язку; - використовувати поняття електронегативності для характеристики хімічних зв'язків. Ціннісний компонент. Учні мають: - обґрунтовувати природу хімічних зв'язків; - робити висновки про види та особливості хімічного зв’язку.
«Мозковий штурм»Яким елементом закінчується кожен період?Назвіть інертні елементи. Які властивості проявляють інертні елементи?Чому інертні елементи не можна віднести до типових неметалів?Яка будова зовнішнього енергетичного рівня в інертних елементів?Яка зміна властивостей спостерігається у періодах?Які властивості проявляють елементи, що мають однакове число електронів на зовнішньому енергетичному рівні?Які електрони називаються спареними, а які неспареними?Що таке радіус атома? Як змінюється радіус атома у періодах і групах?
Хімічний диктант «Мандруємо Періодичною системою»1. Загальне число електронів в атомі елемента №25.2. Відносна атомна маса 27.3. Розташований у 3-му періоді, на зовнішньому енергетичному рівні містить 4 електрони.4. Розташований у ІІ групі, 4-му періоді, побічній підгрупі.5. Кількість протонів 42.6. Елемент з порядковим номером 35.7. Кількість електронів 16.8. Елемент 2-го періоду, утворює сполуку з Гідрогеном RH3.9. Елемент 3-го періоду, утворює сполуку з Оксигеном R2 O3.10. Елемент містить на 3 електрони більше, ніж атом Магнію.11. Елемент містить на 4 протони менше, ніж атом Хрому.12. Має три ізотопи – Протій, Дейтерій, Тритій. 1. Mn2. Аl3. Si4. Zn5. Mo6. Br7. S8. N9. Al10. P11. Ca12. H
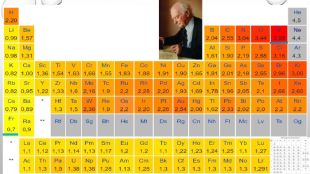
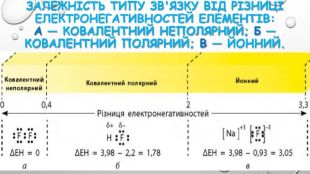
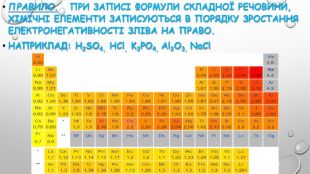
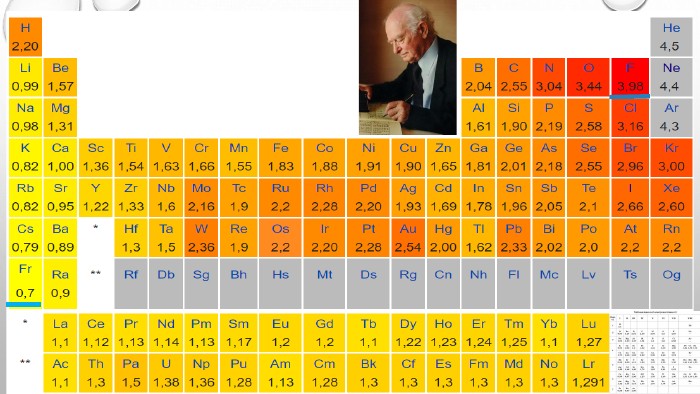
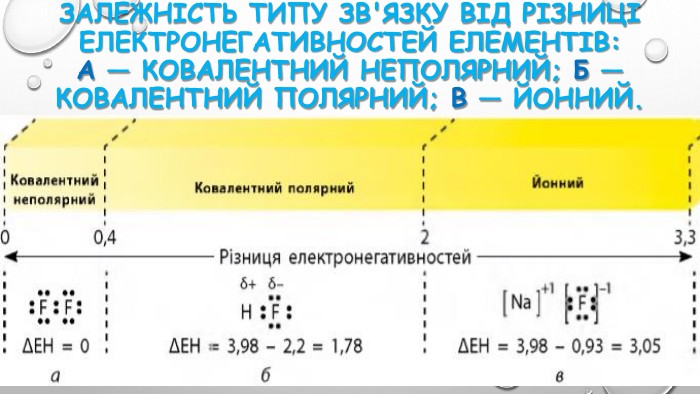
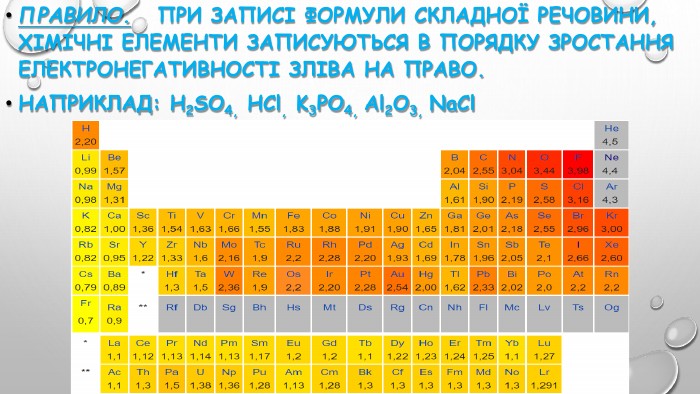
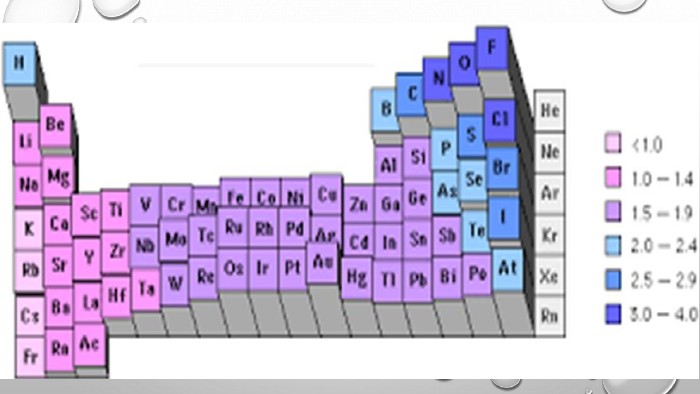
3. електронегативність. Електронегативність – це здатність атомів хімічного елемента притягувати до себе електрони інших атомів у хімічних сполуках. Електронегативність – умовна величина. Шкалу електронегативності розробив Лайнус Полінг у 1932 році. За одиницю електрогенативності було взято електронегативність літію.
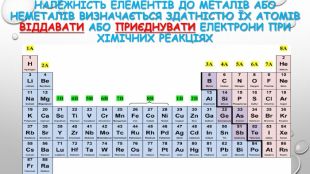
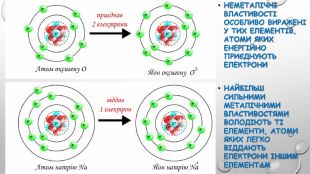
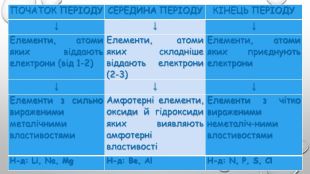
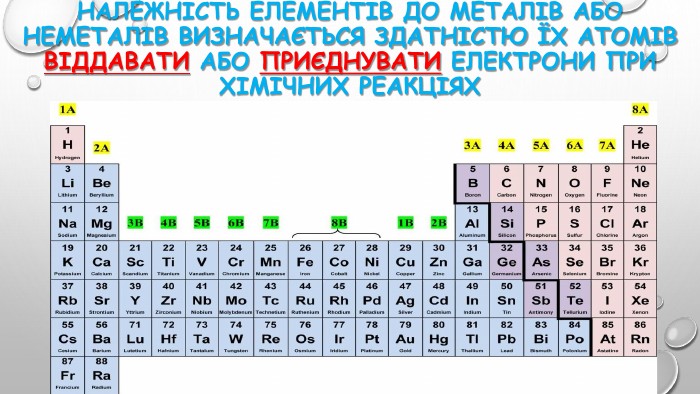
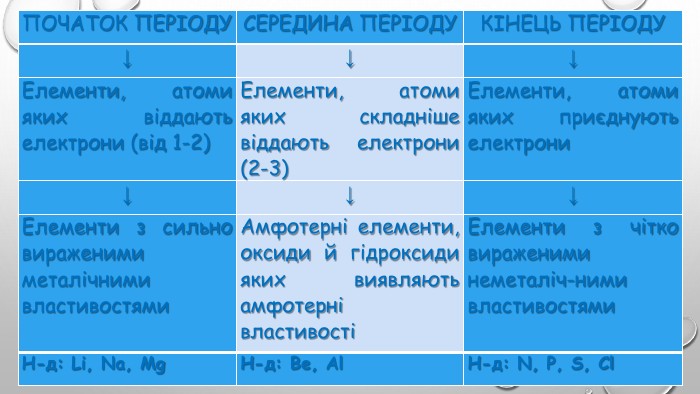
{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}ПОЧАТОК ПЕРІОДУСЕРЕДИНА ПЕРІОДУКІНЕЦЬ ПЕРІОДУ↓↓↓Елементи, атоми яких віддають електрони (від 1-2)Елементи, атоми яких складніше віддають електрони (2-3) Елементи, атоми яких приєднують електрони ↓↓↓Елементи з сильно вираженими металічними властивостями. Амфотерні елементи, оксиди й гідроксиди яких виявляють амфотерні властивостіЕлементи з чітко вираженими неметаліч-ними властивостями Н-д: Li, Na, Mg. Н-д: Be, Al. Н-д: N, P, S, Cl
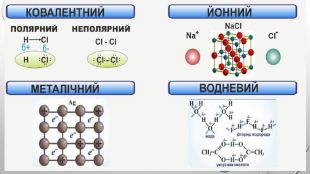
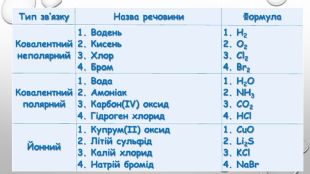
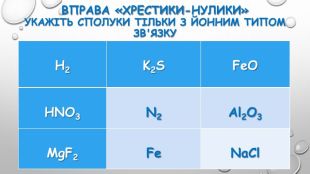
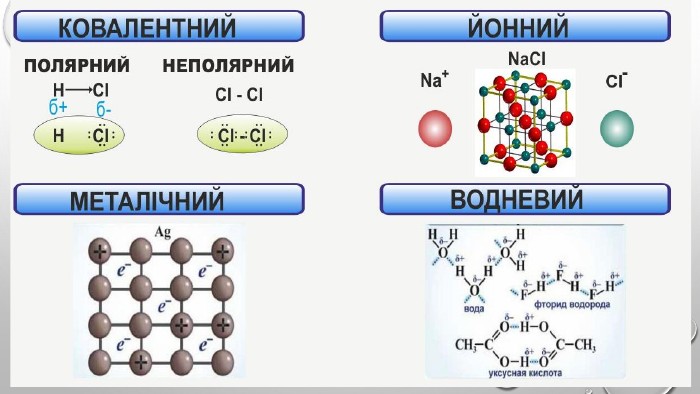
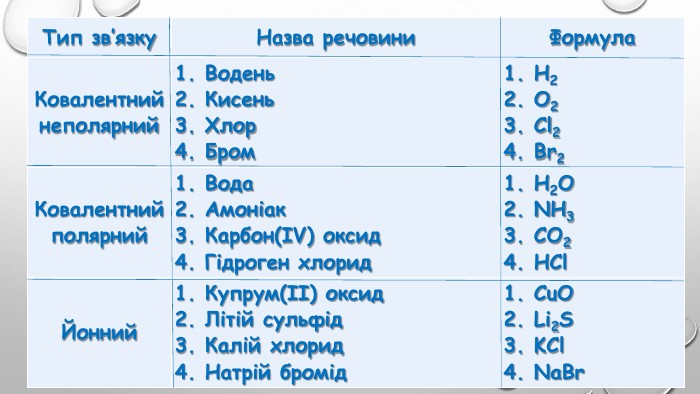
{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Тип зв’язку. Назва речовини. Формула. Ковалентнийнеполярний1. Водень2. Кисень3. Хлор4. Бром1. H22. O23. Cl24. Br2 Ковалентнийполярний1. Вода2. Амоніак3. Карбон(ІV) оксид4. Гідроген хлорид1. H2 O2. NH33. CO24. HCl. Йонний1. Купрум(ІІ) оксид2. Літій сульфід3. Калій хлорид4. Натрій бромід1. Cu. O2. Li2 S3. KCl4. Na. Br
Вправа «Так чи Ні» 1. Взаємодію між атомами, молекулами, йонами, завдяки якій частинки утримуються разом називають мобільним зв'язком.2. У молекулі води ковалентний неполярний зв'язок.3. У сполуках із йонним зв'язком електронегативності елементів майже однакові.4. Ковалентний зв'язок утворюється за допомогою спільних електронних пар.5. Йонний зв'язок утворюється за допомогою електростатичної взаємодії між йонами. 6. Хімічний зв'язок утворюється за рахунок дії сил приклеювання та відштовхування.7. Йони — електонейтральні часточки.8. Флуор — найелектронегативніший елемент.9. Електронегативність атома Натрію більша, ніж у атома Калію.10. Вr2 — неполярна молекула.1. НІ2. НІ3. НІ4. ТАК5. ТАК6. НІ7. НІ8. ТАК9. ТАК10. ТАК
Вправа «Знайди помилку» 1. Взаємодію між атомами, молекулами, йонами, завдяки якій частинки утримуються разом називають мобільним зв’язком.2. Хімічний зв’язок утворюється за рахунок дії сил приклеювання та відштовхування.3. Нова молекула може утворитися, якщо при взаємодії атомів їхня енергія збільшується.4. Атом складається з негативно зарядженого ядра та позитивно заряджених електронів5. Електронегативність – це здатність атома притягувати до себе атоми та молекули.6. Метали мають вищу електронегативність ніж неметали.7. Електронегативність елементів у періодах зменшується зліва направо.8. Благородні (Інертні) гази мають високу електронегативність.9. Атоми металів легко приєднують валентні електрони.10. Електронегативність у групах знизу вгору зменшується.1. Хімічний. 2. Кулонівських сил – притягання та відштовхування 3. Зменшується 4. Позитивно заряджене ядро та негативно заряджені електрони. 5. До себе е– (електронну густину) 6. Нижчу7. Збільшується8. Вони інертні 9. Віддають 10. Зростає
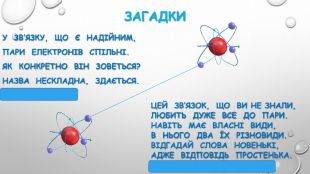
загадки. У зв’язку, що є надійним,Пари електронів спільні. Як конкретно він зоветься?Назва нескладна, здається. (ковалентний)ЦЕЙ ЗВ’ЯЗОК, ЩО ВИ НЕ ЗНАЛИ,ЛЮБИТЬ ДУЖЕ ВСЕ ДО ПАРИ. НАВІТЬ МАЄ ВЛАСНІ ВИДИ,В НЬОГО ДВА ЇХ РІЗНОВИДИ. ВІДГАДАЙ СЛОВА НОВЕНЬКІ,АДЖЕ ВІДПОВІДЬ ПРОСТЕНЬКА. (ПОЛЯРНИЙ І НЕПОЛЯРНИЙ)
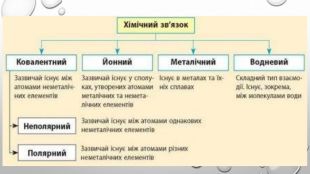
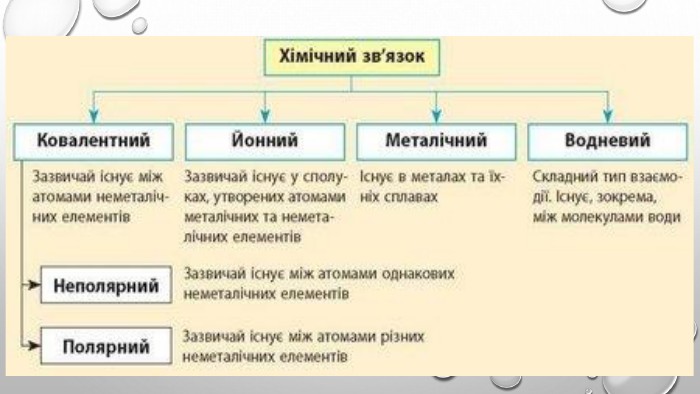
Підсумки вивченого:1. Хімічний зв'язок - це взаємодія між атомами, яка утримує їх у молекулі чи твердому тілі.2. Атоми утворюють хімічні зв’язки, щоб стати більш стабільними, прагнуть мати повну зовнішню електронну оболонку, тобто октет електронів. Атоми досягають цього, коли отримують, втрачають або діляться електронами з іншими атомами. 3. Електронегативність – це здатність атомів хімічного елемента притягувати до себе електрони інших атомів у хімічних сполуках. Використовуючи поняття електронегативності, можна передбачити тип хімічного зв’язку у сполуці. 4. Розрізняють ковалентний, йонний, металічний та водневий хімічні зв’язки.
Вивчити § 13.Індивідуальні Завдання:1) Із запропонованих хімічних елементів вибрати елементи – метали. Zn, C, K, Na, Fe, O, He, Ba, Pb, Si, Sn, S, W, Hg.2) Розмістити метали у порядку зменшення їх активності: Fe, Zn, Na, Al, Ag, Cu, Pb, Mg, K, Ca, Sn.3) Підготувати повідомлення про Нобелівського лауреата Лайнуса Полінга ДОМАШНЄ ЗАВДАННЯ«Кіт у мішку»


про публікацію авторської розробки
Додати розробку