Урок: "Природа хімічного зв'язку."
Розробка уроку: "Природа хімічного зв'язку".
Презентація до уроку за посиланням:
https://naurok.com.ua/prezentaciya-z-temi-priroda-himichnogo-zv-yazku-373631.html
Тема: Природа хімічного зв’язку. Електронегативність хімічних елементів.
Очікувані результати:
Формування ключових компетентностей:
- Спілкування державною мовою (формулювати відповідь на поставлене запитання, робити висновки);
- Математична компетентність (аналізувати принцип утворення зв’язку);
- Основні компетентності у природничих науках і технологіях (виконувати вправи на засвоєння йонного, ковалентного полярного та неполярного зв’язку);
- Інформаційно-цифрова компетентність (використовувати сучасні пристрої для добору хімічної інформації, її оброблення);
- Уміння вчитися впродовж життя (застосовувати і переносити знання та навички у нову тему);
- Соціальна та громадянська компетентності (співпрацювати з іншими над реалізацією поставлених завдань).
Формування предметних компетентностей:
Знаннєвий компонент: Учні мають
- називати види хімічного зв’язку;
- наводити приклади сполук із ковалентним (полярним і неполярним) та йонним хімічними зв’язками;
- пояснювати утворення йонного, ковалентного (полярного і неполярного) зв'язків.
Діяльнісний компонент: Учні мають
- складати електронні формули молекул;
- характеризувати особливості ковалентного та йонного зв’язків;
- визначати вид хімічного зв’язку в типових випадках, полярність ковалентного зв'язку;
- прогнозувати фізичні властивості та практичне використання речовин залежно від виду хімічного зв'язку;
- використовувати поняття електронегативності для характеристики хімічних зв'язків.
Ціннісний компонент: Учні мають
- обґрунтовувати природу хімічних зв'язків;
- робити висновки про види та особливості хімічного зв’язку.
Тип уроку – вивчення нового матеріалу.
Обладнання: таблиця електронегативності атомів хімічних елементів Полінга, періодична система хімічних елементів Д.І. Менделєєва, роздатковий матеріал (завдання для роботи на уроці).
Основні поняття та терміни: електронегативність атомів хімічних елементів, типи хімічного зв'язку.
Хід уроку:
Девіз уроку:
«Збиратися разом – це початок,
триматися разом – це процес,
працювати разом – це успіх.»
Г. Форд
І. Актуалізація опорних знань та мотивація навчальної діяльності:
1. Я хочу прочитати вам уривок із твору Льюіса Керролла «Аліса в Країні чудес»:
За кілька кроків від неї сидів на гілці Чеширський кіт.
«Скажіть, будь ласка, куди мені звідси йти?»
«А куди ти хочеш потрапити?» - спитав у відповідь кіт.
«Мені все одно…» - сказала Аліса.
«Тоді все одно куди йти: - зауважив кіт.
Що хоче сказати кіт Алісі та навіщо я прочитала ці слова на початок уроку? Ваша думка?
Так, правильно, потрібно знати мету своєї роботи.
2. «Мозковий штурм»
- Яким елементом закінчується кожен період?
- Назвіть інертні елементи.
- Які властивості проявляють інертні елементи?
- Чому інертні елементи не можна віднести до типових неметалів?
- Яка будова зовнішнього енергетичного рівня в інертних елементів?
- Яка зміна властивостей спостерігається у періодах?
- Які властивості проявляють елементи, що мають однакове число електронів на зовнішньому енергетичному рівні?
- Які електрони називаються спареними, а які неспареними?
- Що таке радіус атома? (відстань від центра ядра до сферичної поверхні, якої торкаються орбіталі з електронами останнього енергетичного рівня)
- Як змінюється радіус атома у періодах і групах? (радіус атомів елементів у періоді зменшується зліва направо, а у групі (підгрупі) зростають зверху донизу)
![]()
![]() Радіус атома ЗМЕНШУЄТЬСЯ (у періоді)
Радіус атома ЗМЕНШУЄТЬСЯ (у періоді)
Радіус атома ЗБІЛЬШУЄТЬСЯ (у групі (підгрупі))
У ході бесіди ми з’ясували, що всі хімічні елементи, крім інертних газів, мають незавершені електронні орбіталі. У процесі утворення хімічних зв’язків атоми хімічних елементів намагаються завершити їх і утворити стійку восьми електронну будову зовнішнього енергетичного рівня. Отже, сьогодні на уроці ми повинні з’ясувати принципи завершення зовнішнього енергетичного рівня. Також ви вивчите таке поняття, як «електронегативність», та її зміну у періодах і групах.
3. Хімічний диктант «Мандруємо Періодичною системою»:
1. Загальне число електронів в атомі елемента №25. Mn
2. Відносна атомна маса 27. АІ
3. Розташований у 3-му періоді, на зовнішньому енергетичному рівні містить 4 електрони. Si
4. Розташований у ІІ групі, 4-му періоді, побічній підгрупі. Zn
5. Кількість протонів 42. Mo
6. Елемент з порядковим номером 35. Br
7. Кількість електронів 16. S
8. Елемент 2-го періоду, утворює сполуку з Гідрогеном RH3. N
9. Елемент 3-го періоду, утворює сполуку з Оксигеном R2O3. Al
10. Елемент містить на 3 електрони більше, ніж атом Магнію. P
11. Елемент містить на 4 протони менше, ніж атом Хрому. Ca
12. Має три ізотопи – Протій, Дейтерій, Тритій. H
II. Вивчення нового матеріалу:
1. Природа хімічного зв’язку
Хімічний зв'язок – це зв'язок між атомами, що забезпечує існування речовин з чітко визначеним складом.
За розташуванням у періодичній системі можна визначити, елемент є металом чи неметалом.
Належність елементів до металів або неметалів визначається здатністю їх атомів віддавати або приєднувати електрони при хімічних реакціях.
Неметалічні властивості особливо виражені у тих елементів, атоми яких енергійно приєднують електрони.
Найбільш сильними металічними властивостями володіють ті елементи, атоми яких легко віддають електрони іншим елементам.
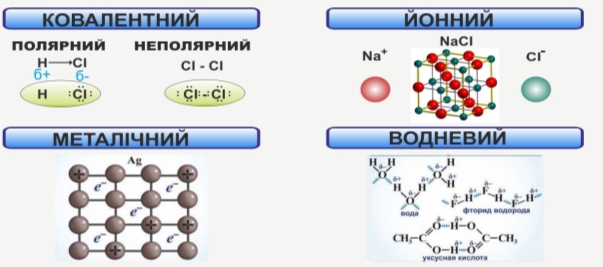
2. Типи хімічних зв’язків.
Міні – лекція з критичним слуханням і маркуванням на полях:
! – це цікаво, не знав (не знала),
вже відомо,
? – не зрозуміло.
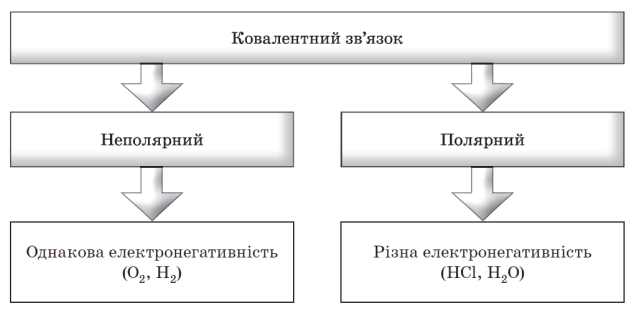
3. Електронегативність.
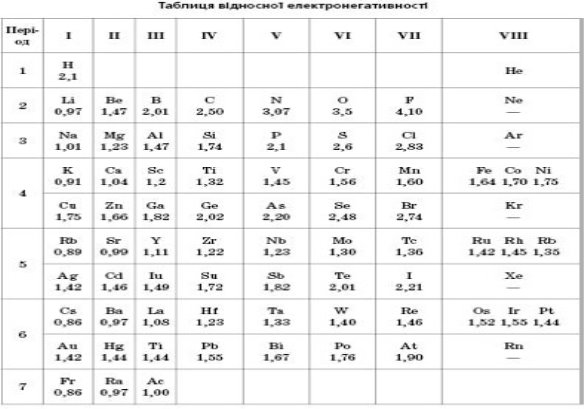
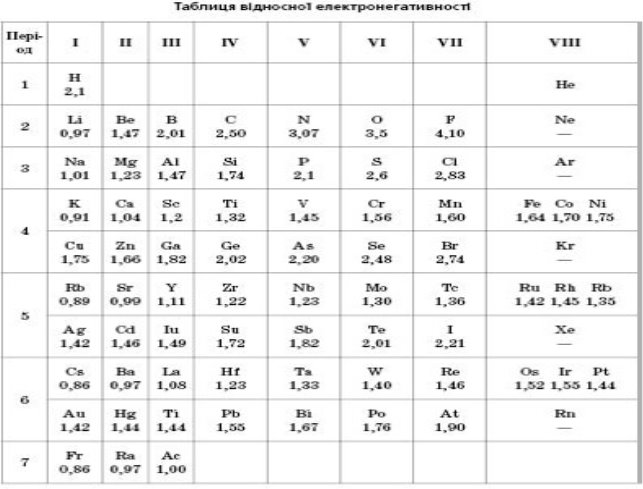
Електронегативність – це здатність атомів хімічного елемента притягувати до себе електрони інших атомів у хімічних сполуках. Електронегативність – умовна величина.
Шкалу електронегативності розробив Лайнус Полінг у 1932 році.
За одиницю електрогенативності було взято електронегативність Літію.
Робота з таблицею.
|
ПОЧАТОК ПЕРІОДУ |
≈ СЕРЕДИНА ПЕРІОДУ |
КІНЕЦЬ ПЕРІОДУ |
|
↓ |
↓ |
↓ |
|
Елементи, атоми яких віддають електрони (від 1-2) |
Елементи, атоми яких складніше віддають електрони (2-3) |
Елементи, атоми яких приєднують електрони |
|
↓ |
↓ |
↓ |
|
Елементи з сильно вираженими металічними властивостями |
Амфотерні елементи, оксиди й гідроксиди яких виявляють амфотерні властивості |
Елементи з чітко вираженими неметаліч-ними властивостями |
|
Н-д: Li, Na, Mg |
Н-д: Be, Al |
Н-д: N, P, S, Cl |
Ряд електронегативності
F>O>Cl>Br>S>P>C>H>Si>Ag>Mg>Ca>Na>K>Cs>Fr
У періодичній системі електронегативність елементів зростає в періодах зліва на право, а в головних підгрупах – знизу вверх.
Правило. При записі формули складної речовини, хімічні елементи записуються в порядку зростання електронегативності зліва на право.
Наприклад: H2SO4, HCl, K3PO4, Al2O3, NaCl
ІІІ. Узагальнення й систематизація знань:
1. Завдання для кожного ряду: заповнити «свій мішок», розподіливши формули сполук за типом хімічного зв’язку.
H2, CO2, CuO, O2, H2O, KCl, Cl2, NH3, NaBr, Br2, HCl, Li2S
|
Тип зв’язку |
Назва речовини |
Формула |
|
Ковалентний неполярний |
1. Водень 2. Кисень 3. Хлор 4. Бром |
1. H2 2. O2 3. Cl2 4. Br2 |
|
Ковалентний полярний |
1. Вода 2. Амоніак 3. Карбон(ІV) оксид 4. Гідроген хлорид |
1. H2O 2. NH3 3. CO2 4. HCl |
|
Йонний |
1. Купрум(ІІ) оксид 2. Літій сульфід 3. Калій хлорид 4. Натрій бромід |
1. CuO 2. Li2S 3. KCl 4. NaBr |
2. Вправа «Знайдіть пару»
- Li ⁺
- CaCl2
- H2O
- F -
- K3P
- Br2
A) КОВАЛЕНТНИЙ ПОЛЯРНИЙ
Б) КОВАЛЕНТНИЙ НЕПОЛЯРНИЙ
В) КАТІОН
Г) ЙОННИЙ
Д) ЙОННИЙ ПОЛЯРНИЙ
Ж) АНІОН
З) ЙОННИЙ НЕПОЛЯРНИЙ
3. Вправа «Так чи Ні»
1. Взаємодію між атомами, молекулами, йонами, завдяки якій частинки утримуються разом називають мобільним зв'язком. (ні)
2. У молекулі води ковалентний неполярний зв'язок. (ні)
3. У сполуках із йонним зв'язком електронегативності елементів майже однакові. (ні)
4. Ковалентний зв'язок утворюється за допомогою спільних електронних пар. (так)
5. Йонний зв'язок утворюється за допомогою електростатичної взаємодії між йонами. (так)
6. Хімічний зв'язок утворюється за рахунок дії сил приклеювання та відштовхування. (ні)
7. Йони — електонейтральні часточки. (ні)
8. Флуор — найелектронегативніший елемент. (так)
9. Електронегативність атома Натрію більша за електронегативність атома Калію. (так)
10. Вr2 — неполярна молекула. (так)
4. Визначити тип зв’язку
• NaСl
• СF4
• N2
• NH3
• ССl4
• Н2S
• O2
• NаF
• ОF2
• MgO
• СО2
• F2
• Йонний
• Ковалентний полярний
• Ковалентний неполярний
• Ковалентний полярний
• Ковалентний полярний
• Ковалентний полярний
• Ковалентний неполярний
• Йонний
• Ковалентний полярний
• Йонний
• Ковалентний полярний
• Ковалентний неполярний
5. Вправа «Хрестики-нулики»
Укажіть сполуки тільки з йонним типом зв'язку:
|
Н2 |
K2S |
FeO |
|
HNO3 |
N2 |
Al2O3 |
|
MgF2 |
Fe |
NaCl |
6. Вправа «Знайди помилку»
1.Взаємодію між атомами, молекулами, йонами, завдяки якій частинки
утримуються разом називають мобільним зв’язком.
2.Хімічний зв’язок утворюється за рахунок дії сил приклеювання та відштовхування.
3.Нова молекула може утворитися, якщо при взаємодії атомів їхня енергія збільшується.
4.Атом складається з негативно зарядженого ядра та позитивно заряджених електронів
5.Електронегативність – це здатність атома притягувати до себе атоми та
молекули.
6.Метали мають вищу електронегативність ніж неметали.
7.Електронегативність елементів у періодах зменшується зліва направо
8. Благородні (Інертні) гази мають високу електронегативність
9. Атоми металів легко приєднують валентні електрони.
10. Електронегативність у групах знизу вгору зменшується.
Ключ: 1. Хімічний. 2. Кулонівських сил – притягання та відштовхування. 3. Зменшується. 4. Позитивно заряджене ядро та негативно заряджені електрони. 5. До себе е– (електронну густину). 6.Нижчу. 7. Збільшується. 8. Вони інертні. 9. Віддають 10. Зростає.
7. Загадки:
Ось два атоми зустрілись
І чомусь не помирились:
То відштовхуються сильно,
То притягуються мирно.
Що ж за сили тут працюють,
Рухом атомів керують? (кулонівські сили)
Атомів взаємодія -
Це і сила, і надія,
Бо це явище фізичне,
А зв’язок назвіть логічно. (хімічний)
Врешті сили порівнялись,
Атоми, мов задрімали.
Зв’язок між ними проявився.
Яка ж структура тут з’явилась? (молекула)
У зв’язку, що є надійним,
Пари електронів спільні.
Як конкретно він зоветься?
Назва нескладна, здається. (ковалентний)
Цей зв’язок, що ви не знали,
Любить дуже все до пари.
Навіть має власні види,
В нього два їх різновиди.
Відгадай слова новенькі,
Адже відповідь простенька. (полярний і неполярний)
Є молекула хлор-два
І нічого більш нема.
Як у ній зв’язок назвати?
Вам всім треба написати. (ковалентний неполярний)
Ось аш-хлор – сполука чемна,
Формула – проста, приємна
Та який у ній зв’язок?
Думай, вчися весь урок. (ковалентний полярний)
8. Експрес-опитування.
Визначити тип хімічного зв’язку:
S8, SiO2, CCl4, O2, N2, CO, SO2, H2O, P, NH3, CH4, Al2O3, NaCl, CO, KI, Zn, NH3, Al, NaF, HCl, F2, PH3, Br2, H2S, LiІ
IV. Підсумки вивченого:
1. Хімічний зв'язок - це взаємодія між атомами, яка утримує їх у молекулі чи твердому тілі.
2. Атоми утворюють хімічні зв’язки, щоб стати більш стабільними, прагнуть мати повну зовнішню електронну оболонку, тобто октет електронів. Атоми досягають цього, коли отримують, втрачають
або діляться електронами з іншими атомами.
3. Електронегативність – це здатність атомів хімічного елемента притягувати до себе електрони інших атомів у хімічних сполуках. Використовуючи поняття електронегативності, можна передбачити тип хімічного зв’язку у сполуці.
4. Розрізняють ковалентний, йонний, металічний та водневий хімічні зв’язки.
V. Домашнє завдання
Вивчити §
Завдання.
- Із запропонованих хімічних елементів вибрати елементи – метали.
Zn, C, K, Na, Fe, O, He, Ba, Pb, Si, Sn, S, W, Hg.
2) Розмістити метали у порядку зменшення їх активності: Fe, Zn, Na, Al, Ag, Cu, Pb, Mg, K, Ca, Sn.
3) Підготувати повідомлення про Нобелівського лауреата Лайнуса Полінга
Додатки:

10 запитань, які врятують будь-який урок
Теми для розвитку критичного мислення:
- Якби ви могли подорожувати в часі, в яку епоху ви б хотіли потрапити та чому?
- Якби тварини могли говорити, якій тварині першій ви б поставили запитання? Що саме ви б запитали?
- Якби ви могли змінити одне правило в школі, яке б ви обрали?
- Яка найважливіша річ, якої вас навчили ваші батьки або опікуни?
- Якби ви мали суперсилу, якою б вона була? Як би ви її використали?
- Що, на вашу думку, буде найбільшою проблемою для нашого покоління в майбутньому? Як її можна розв’язати?
- Якби ви могли створити ідеальний світ, якими були б його основні правила?
- Чи вважаєте ви, що машини або роботи можуть мати почуття або емоції? Аргументуйте свою думку.
- Якби ви могли придумати новий шкільний предмет, що б ви додали до програми?
- Що означає бути щасливим? Чи можливо навчити людину бути щасливою?


про публікацію авторської розробки
Додати розробку
