Презентація з теми: "Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки. Складання формули сполуки за відомими ступенями окиснення елементів."
Про матеріал
Презентація з теми: "Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки. Складання формули сполуки за відомими ступенями окиснення елементів." Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку




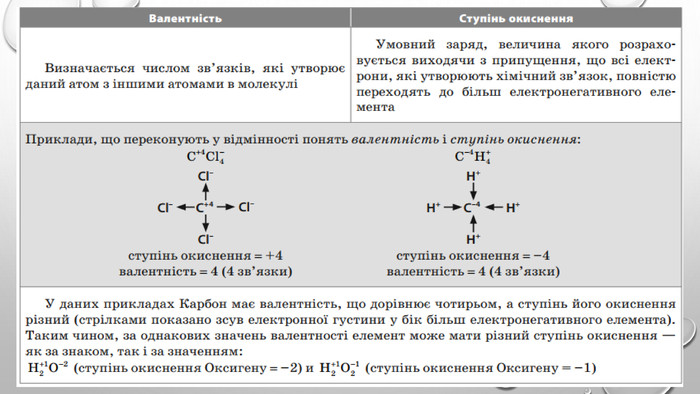

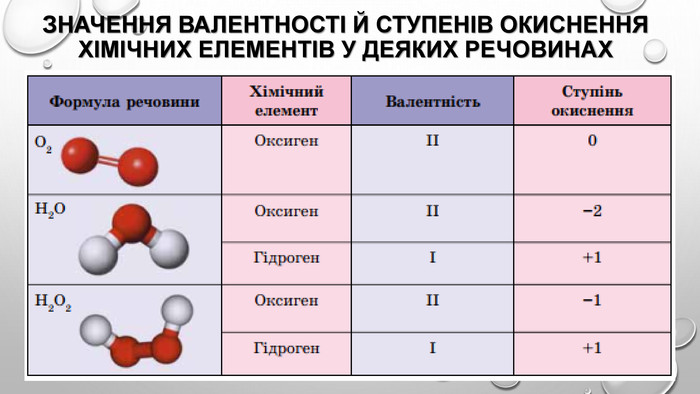
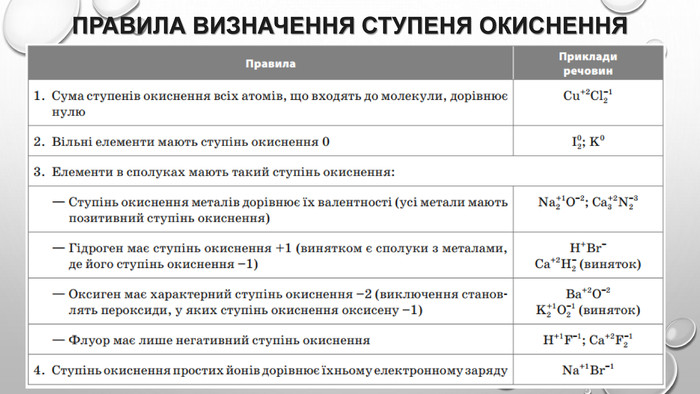
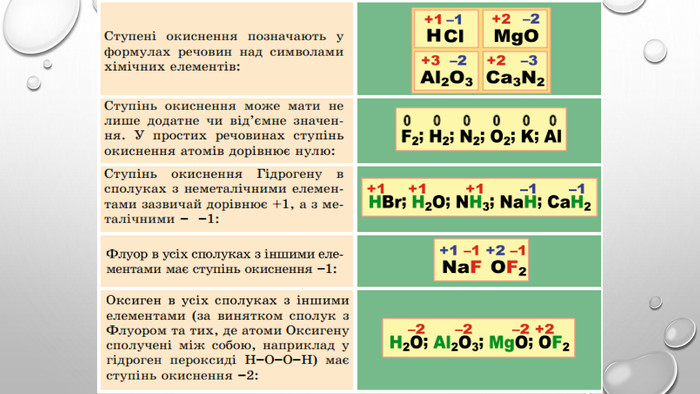


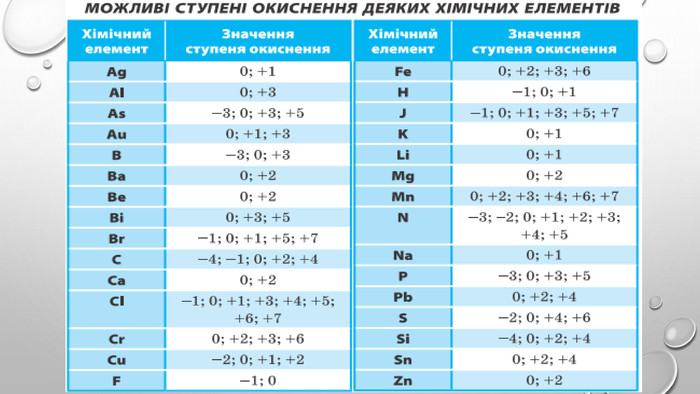













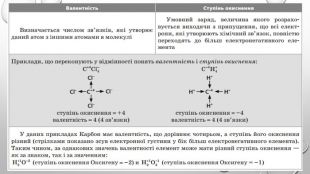

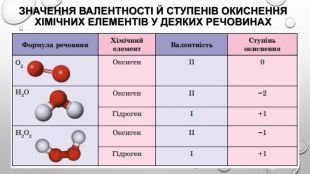
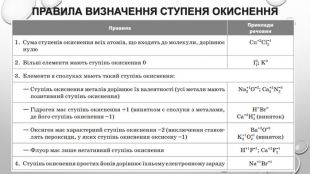


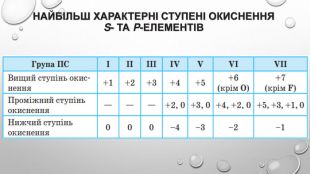
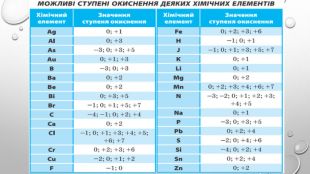
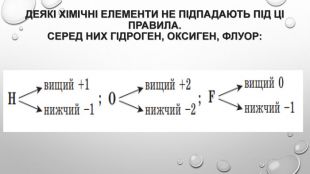

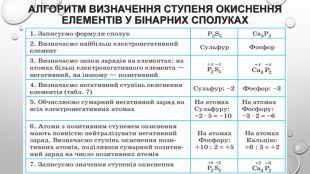







-

Гурська Оксана Вікторівна
22.11.2024 в 20:51
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

ОСТАПЧУК ІННА ПЕТРІВНА
24.10.2024 в 18:29
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гнатюк Віра Олексіївна
10.12.2023 в 23:23
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Юсин Надія Улянівна
04.12.2023 в 19:59
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
30.11.2023 в 08:56
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Воронівська Наталья Гуріївна
15.11.2022 в 12:25
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Підкалюк Любов Петрівна
13.11.2022 в 19:41
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 4 відгука