Презентація з теми: "Термохімічні рівняння"


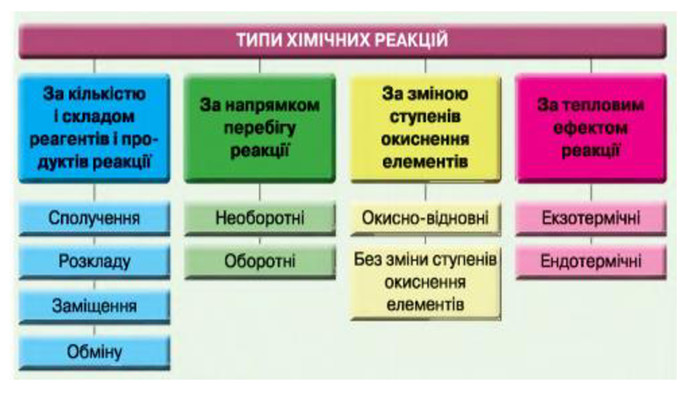
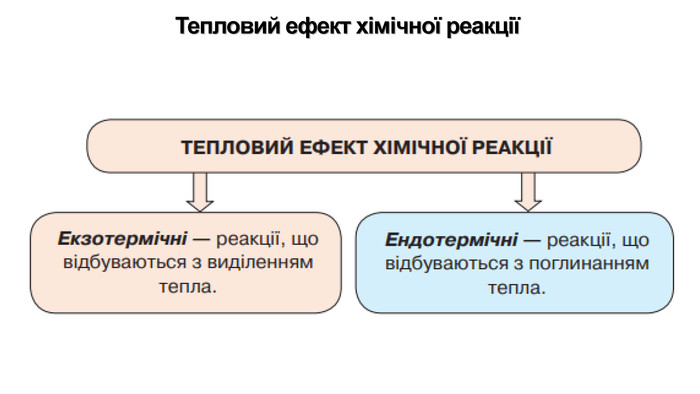
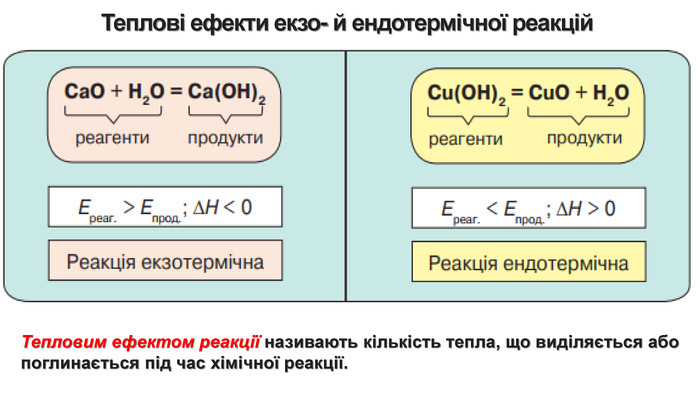

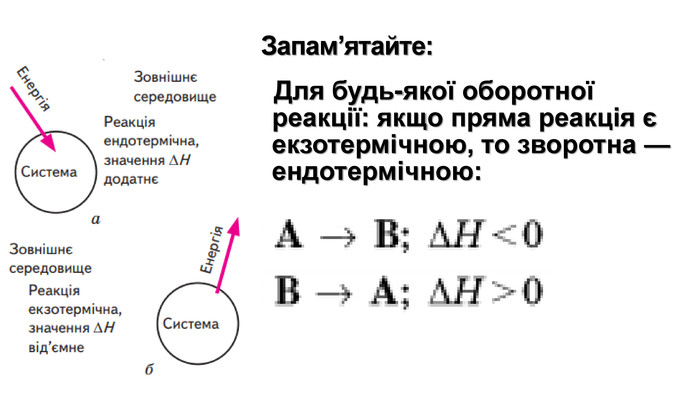
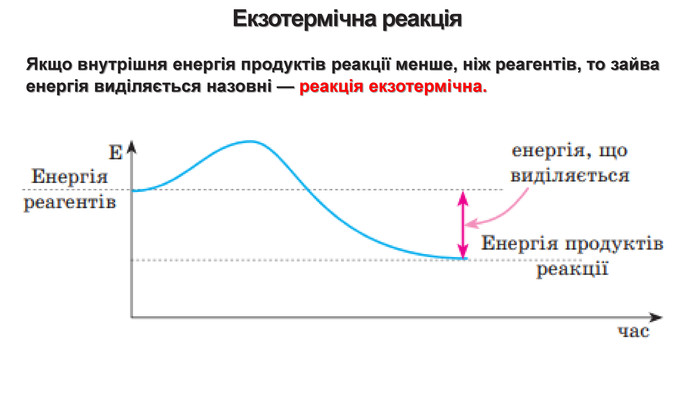
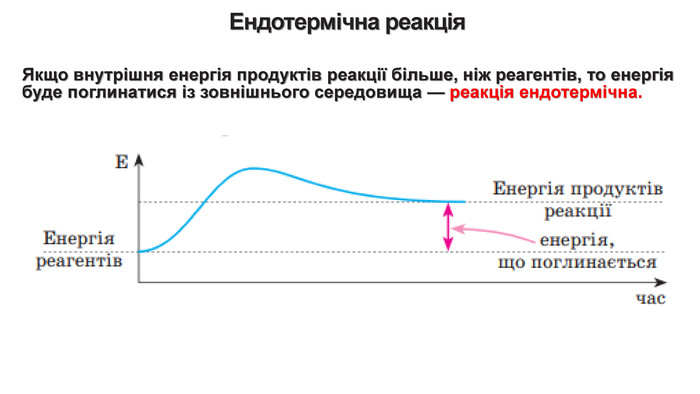
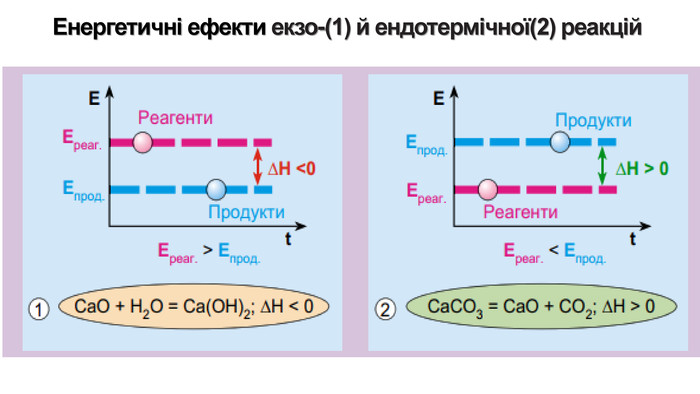
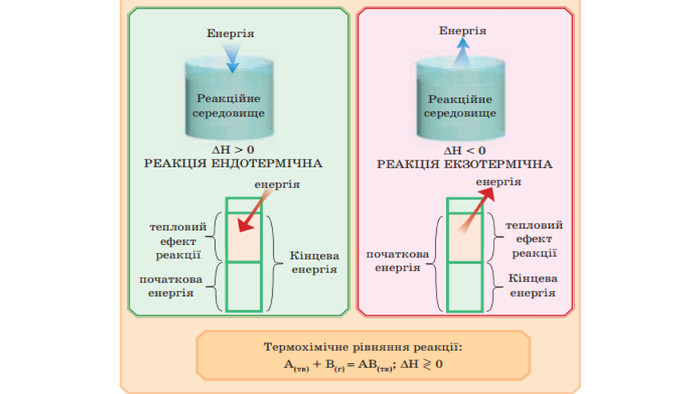
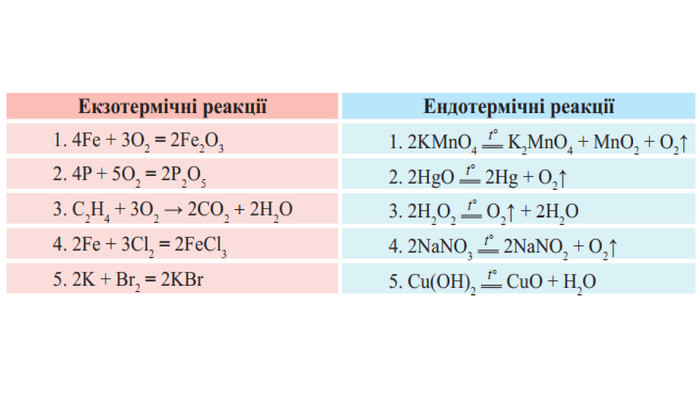









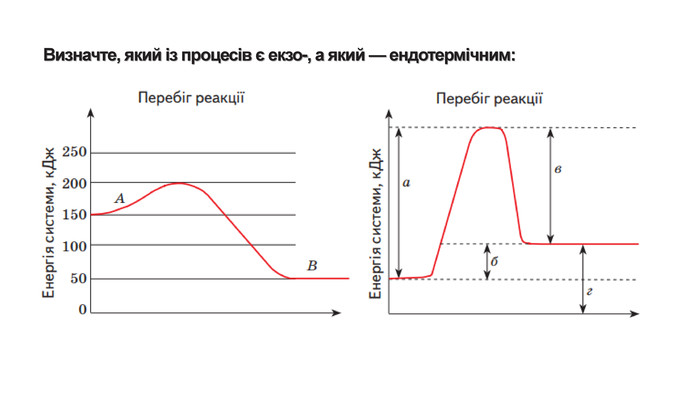











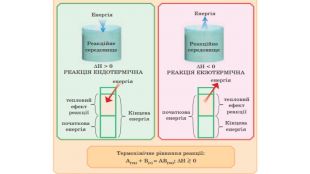
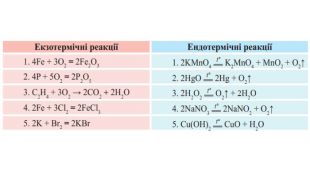
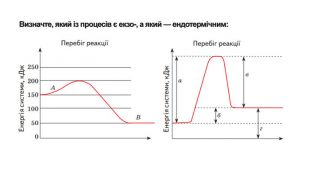
Укажіть рівняння екзотермічних реакцій:а) 2 НВr → Н2 + Вr2; ∆Н = + 70,18 к. Дж; б) 2 NO + O2 → 2 NO2; ∆H = - 117,2 к. Дж;в) 2 Н2 + О2 → 2 Н2 О; ∆Н = - 572,8 к. Дж; г) N2 O4 = 2 NO2; ∆H = + 23 к. Дж.д) 3 РН3 + 4 О2 = Р2 О5 +3 Н2 О; ∆Н = - 2348 к. Дж; е) СН4 + 2 О2 = СО2 + 2 Н2 О; ∆Н = - 890 к. Дж;
5. Термохімічне рівняння реакції між бромом і воднем: Н2 + Вr2 = 2 НВr; ∆ H = - 70,76 к. Дж. Яка кількість теплоти виділиться, якщо утвориться 1 л бромоводню ( н.у.)? 6. Термохімічне рівняння реакції горіння фосфору: 4 Р + 5 О2 = 2 Р2 О5; ∆ H = - 3009,6 к. Дж. Який об’єм кисню (н.у.) витратився на згоряння фосфору, якщо при цьому виділилось -601,92 к. Дж теплоти?
7. Термохімічне рівняння реакції горіння метану: СН4 + 2 О2 = СО2 + 2 Н2 О; ∆Н = - 891,3 к. Дж. Скільки теплоти виділиться від згоряння 1 л метану (н.у.).8. Термохімічне рівняння реакції добування заліза методом алюмотермії таке: Fe2 O3 + 2 Al = 2 Fe + Al2 O3; ∆Н = - 828,85 к. Дж;Обчисліть, скільки теплоти виділиться, якщо прореагує 3 кг алюмінію.
9. У результаті взаємодії водню кількістю речовини 1 моль і хлору кількістю речовини 1 моль утворюється 2 моль гідроген хлориду й виділяється 183,6 к. Дж теплоти. Складіть термохімічне рівняння цієї реакції. 10. Ферум(II) оксид відновлюється карбон(II) оксидом до заліза. Ця реакція супроводжується виділенням -1318 к. Дж теплоти під час добування1 моль заліза. Складіть термохімічне рівняння цієї реакції.


про публікацію авторської розробки
Додати розробку




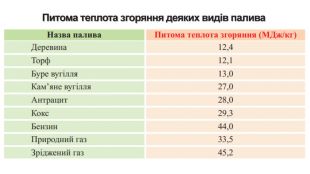
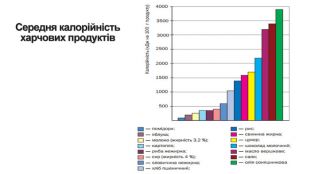




















-

Потапова Галина Іванівна
02.12.2024 в 21:42
дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Пономаренко Ліна Володимирівна
07.12.2023 в 03:09
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Воронівська Наталья Гуріївна
05.12.2022 в 20:55
Дуже дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Казімко Ольга Сергіївна
30.11.2022 в 16:14
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Оксана Проценко Григорівна
15.10.2022 в 23:26
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Задорожна Ніна Олександрівна
16.12.2021 в 23:54
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Година Марина Леонiдiвна
16.12.2021 в 23:40
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Палій Людмила Олександрівна
16.01.2021 в 22:51
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 5 відгуків