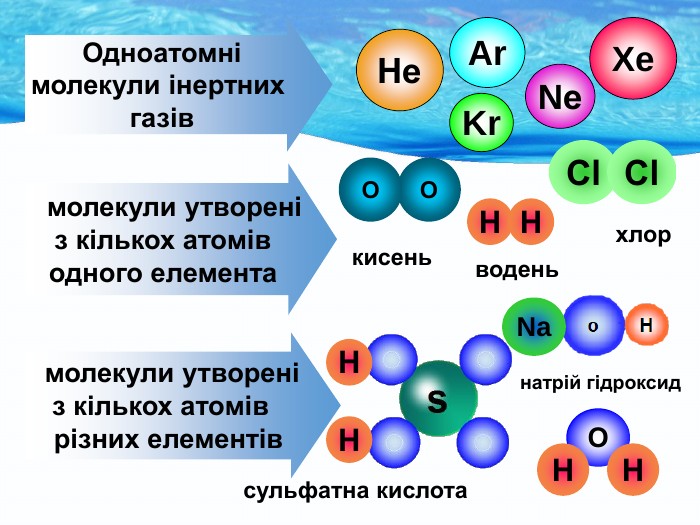
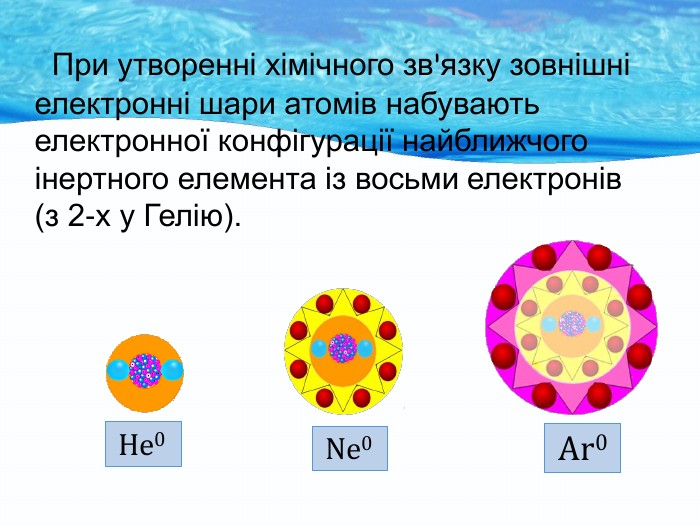
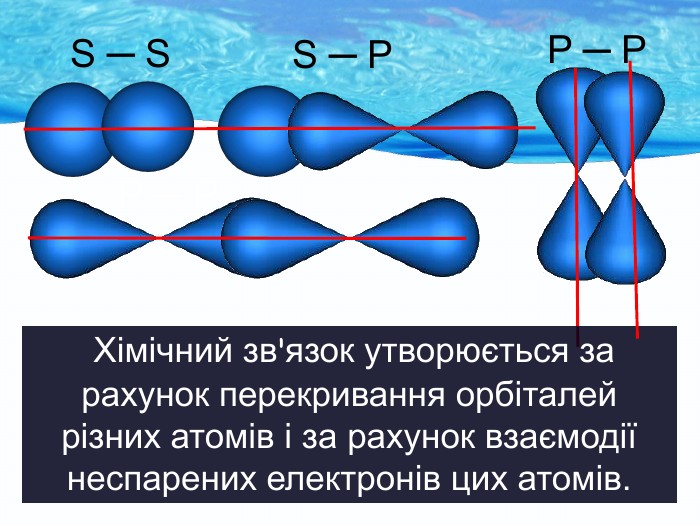
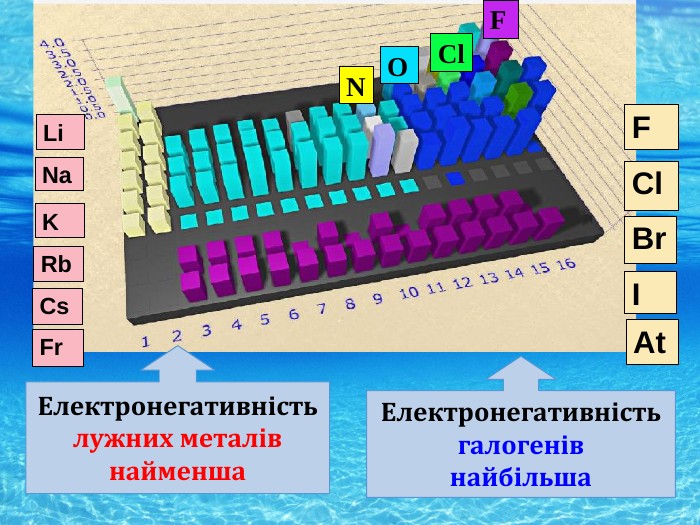
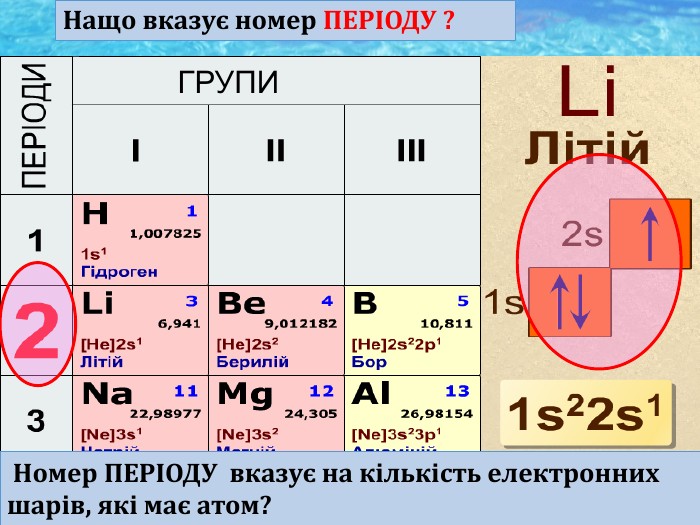
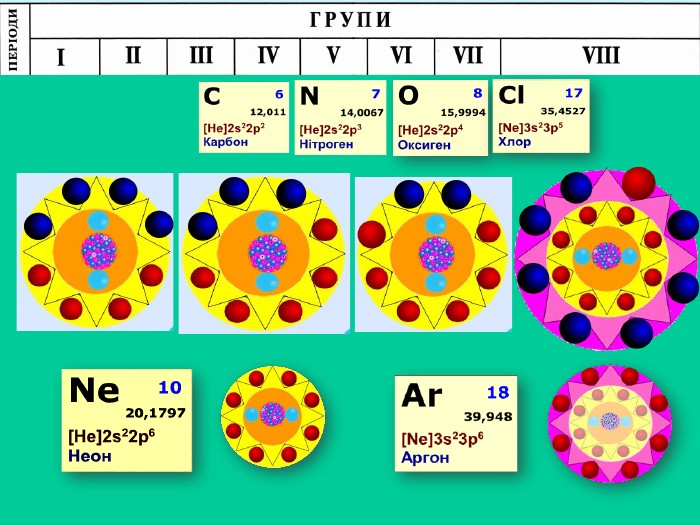
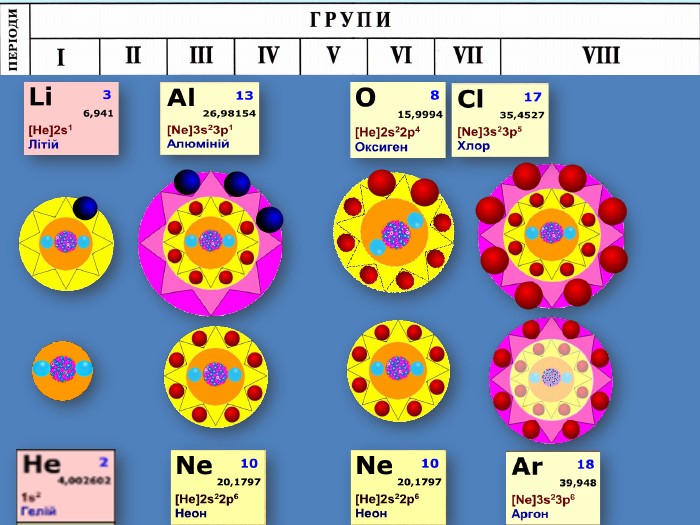
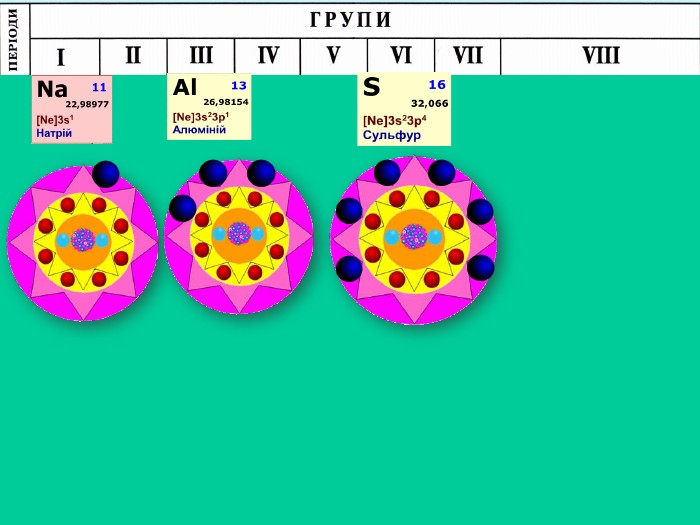
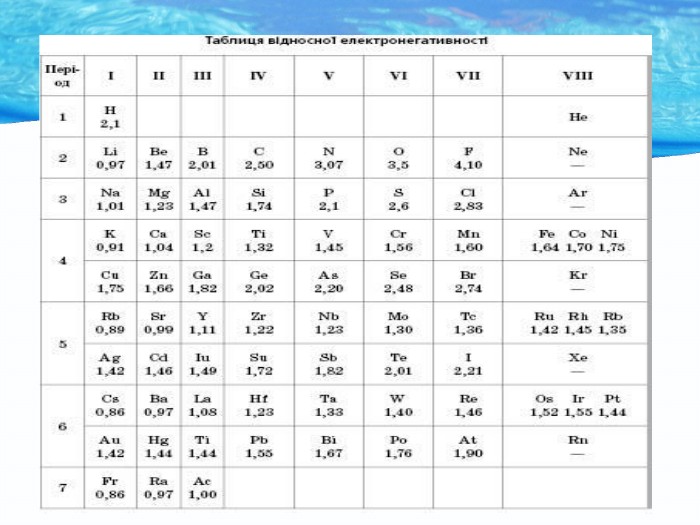
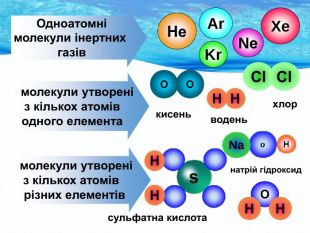
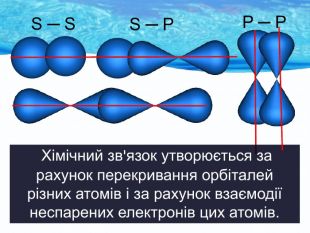
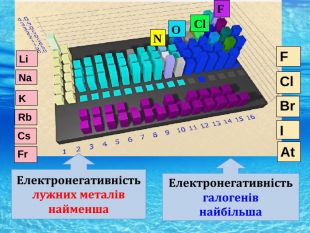
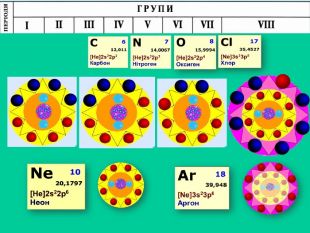
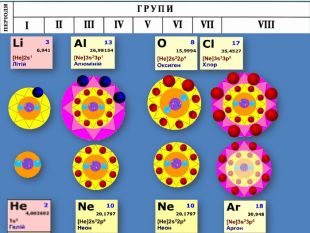
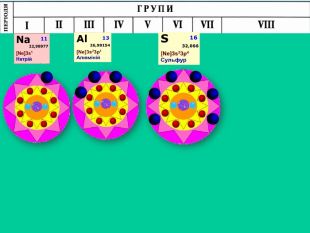
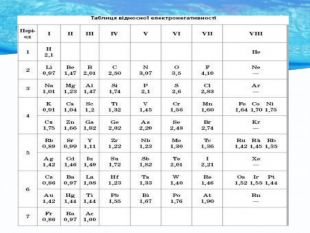
Природа хімічного зв’язку. Електронегативність атомів хімічних елементів.
Про матеріал
Природа хімічного зв’язку. Електронегативність атомів хімічних елементів. Неорганічна хімія. 8 клас Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку