Проект "Замерзання води" на урок фізики
Проект на тему "Замерзання води" для уроків фізики. Проект містить теоретичні відомості чому замерзає вода, лабораторні досліди цікаві для учнів та висновки.
- на тему замерзання води.doc doc
- .ppt ppt
- 1.ppt ppt
|
Проект на тему: Замерзання води |
||
|
Мета |
|
|
|
Завдання |
Провести досліди, та опрацювати інформаційні джерела |
|
|
Типологія проектів |
Домінуюча діяльність |
Пошукова, дослідна |
|
Предметно-змістова область |
Міжпредметний |
|
|
Характер координування |
Безпосередній |
|
|
Характер зв'язків |
Між учасниками одного регіону |
|
|
Кількість учасників |
Необмежена |
|
|
Час виконання |
І чверть |
|
|
Значення проблеми |
Практичне значення |
Практичне застосування властивостей замерзання води у сільському господарстві та техніці. |
|
Теоретичне значення |
Навчитися контролювати температуру замерзання води. |
|
|
Самостійна робота |
Дослідна |
Дослід 1 |
|
Дослід 2 |
||
|
Дослід 2 |
||
|
Пошукова |
Узагальнити інформацію знайдену в інформаційних джерелах |
|
|
Узагальнення результатів |
Презентація |
|
|
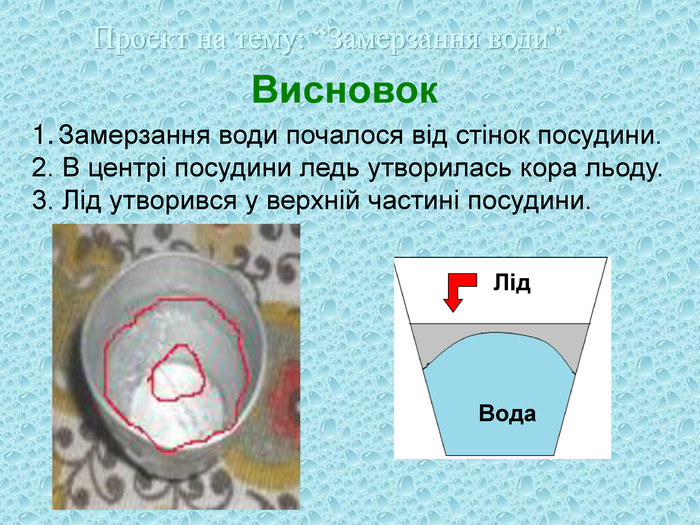
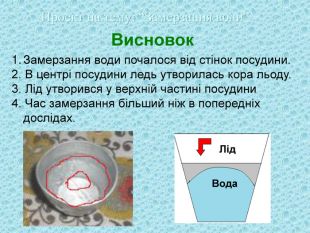
Висновок |
|
|
Дослід 1
Мета: Визначити час та властивості замерзання води.
Обладнання: посудина з водою, холодильник, секундомір.
Хід роботи
Взяти посудину з водою. Поставити в холодильник та вирахувати час, коли на поверхні води утвориться шар льоду.
t=______ хв..
Висновок:_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дослід 2
Мета: Визначити час та властивості замерзання води.
Обладнання: посудина з водою, холодильник, секундомір, металевий стержень.
Хід роботи
Взяти посудину з водою. Поставити по середині металевий стержень. Поставити в холодильник та вирахувати час, коли на поверхні води утвориться шар льоду.
t=______ хв..
Висновок:_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дослід 3
Мета: Визначити час та властивості замерзання води.
Обладнання: посудина з водою, холодильник, секундомір, срібло.
Хід роботи
Взяти посудину з водою. Очистити воду сріблом. Поставити в холодильник та вирахувати час, коли на поверхні води утвориться шар льоду.
t=______ хв..
Висновок:_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
 Хімічна характеристика води.
Хімічна характеристика води.
Н2O — хімічна речовина у вигляді прозорої безбарвної рідини без запаху і смаку, (в нормальних умовах). У природі існує у трьох агрегатних станах — твердому (лід), рідкому (вода) і газоподібному (водяна пара). Молекула води складається з одного атома оксигену і двох атомів гідрогену. Атоми гідрогену розташовані в молекулі так, що напрямки до них утворюють кут 104,45o із вершиною в центрі атома оксигену. Таке розташування зумовлює молекулі води дипольний момент у 1,844 Дебая. При заміні атомів гідрогену (протонів) на атоми дейтерію утворюється модифікація, яка називається важкою водою.
 Вода — одна із найголовніших речовин, потрібних для органічного життя. Рослини та тварини містять понад 60 % води за масою. На Землі водою покрито 70,9% поверхні. Вона здійснює у природі постійний кругообіг, випаровуючись з поверхні й повертаючись на неї у вигляді атмосферних опадів. Вода має велике значення для економіки: сільського господарства й промисловості. Прісні води, придатні для пиття, становлять лише 2,5% від загальної кількості води на Землі. Нестача води може стати однією з найгостріших проблем людства в найближчі десятиліття.
Вода — одна із найголовніших речовин, потрібних для органічного життя. Рослини та тварини містять понад 60 % води за масою. На Землі водою покрито 70,9% поверхні. Вона здійснює у природі постійний кругообіг, випаровуючись з поверхні й повертаючись на неї у вигляді атмосферних опадів. Вода має велике значення для економіки: сільського господарства й промисловості. Прісні води, придатні для пиття, становлять лише 2,5% від загальної кількості води на Землі. Нестача води може стати однією з найгостріших проблем людства в найближчі десятиліття.
Чому замерзає вода?
Життя людини завжди залежала від води. Тому з давніх часів люди уважно за нею спостерігали, виявивши, що на холоді вода замерзає, тобто перетворюється у тверду речовину - лід, який при нагріванні знову стає водою.
Інструкція
1 Багато речовин, як природні, так і штучні, можуть перебувати в кількох фазових станах, тобто формах існування, що змінюють один одного в залежності від зовнішніх умов. В даний час відомо більше десятка таких фазових станів, більшість яких можна досягти тільки в лабораторіях. У природі ж найчастіше зустрічаються тверде, рідке і газоподібне.
2 Велика частина води, що знаходиться на нашій планеті - рідина. Це означає, що її молекули швидко рухаються і слабо пов'язані між собою. Тому рідина приймає будь-яку форму, але не здатна її зберігати сама по собі.
3 При нагріванні молекули рідини починають рухатися ще швидше, і речовина поступово переходить в газоподібний стан. У газі молекули знаходяться ще далі один від одного, тому газ можна сильно розріджувати або стискати, і він не тільки не зберігає форму, але й займає будь-який доступний об'єм.
4 Але якщо рідину охолодити, то вона може перейти в твердий стан. Її молекули сповільнюються настільки, що між ними утворюються стійкі зв'язки. Виникає тверде тіло, що володіє власною внутрішньою структурою. Якщо ця структура впорядкована, то вона називається кристалічною. Наприклад, лід - кристалічна речовина. Його кристали мають шестигранну форму. Дрібні фігурні кристали льоду, що утворюються в хмарах, більше відомі як сніжинки.
5 Процес переходу речовини з рідкого стану в твердий називається застиганням або кристалізацією, а перехід з твердого в рідкий - плавленням. Плавлення льоду в просторіччі називають таненням, а його кристалізацію - замерзанням.
6 Усі тіла при нагріванні розширюються, а при охолодженні стискаються. Однак відстань між молекулами води в кристалі льоду трохи більша, ніж в рідині. Тому лід при замерзанні розширюється, так що вода, залишена замерзати в пляшці, може розірвати її, перетворившись на лід. З цієї ж причини лід, що утворився у воді взимку, завжди плаває зверху, а не опускається на дно.
7 Вода замерзає при температурі 0 градусів за шкалою Цельсія. Правильніше, втім, буде сказати, що нульова відмітка на шкалі Цельсія була встановлена на температурі танення льоду, а температуру кипіння води Цельсій прийняв рівної 100 градусам.
Якщо ви спостерігали, як на ставку, озері або річці утворюється лід, то могли помітити, що спочатку лід заявляється на поверхні води.
А вам не здається, що, якби ставки, озера й ріки замерзали б із дна, а не навпаки, то багато що в нашому житті виглядало б інакше? Змінився б не тільки клімат Землі, а й зовсім зникли б деякі істоти, що живуть у воді!
Подивіться, як вода в ставку перетворюється на лід. Коли повітря над ставком охолоджується, воно охолоджує й верхній шар води. Верхні холодні шари води стають важчі, ніж теплі нижні шари, і вони опускаються вниз. Цей процес триває доти, поки вся вода ставка знизиться до температури +4°С.
Але температура повітря знижується! Коли верхні шари води охолоджуються до температури нижче +4° С, вони залишаються на поверхні. Справа в тому, що вода, охолоджена до температури нижче 4°С, стає легшою!
Отже, верхні шари води готові до замерзання. Коли температура залишається на рівні точки замерзання 0° С або опускається нижче, починають утворюватися дрібні кристалики.
Кожний такий кристал має шість променів. З'єднуючись, вони утворять лід, і незабаром на поверхні води утворюється скоринка льоду.
Іноді лід прозорий, іноді – ні. Чому?
Справа в тому, що при замерзанні капель води виділяються маленькі пухирці повітря. Вони прилипають до променів кристалів льоду. Чим більше утвориться кристаликів льоду, тим більше пухирців повітря – от вам і непрозорий лід.
Якщо вода під льодом рухається, повітряні пухирці збираються разом, і утвориться прозорий лід.
Вода, як і деякі інші речовини, не зменшує свого об’єму при переході з рідкого у твердий стан. Вода при замерзанні розширюється на одну дев'яту свого об’єму, тобто при замерзанні дев'яти літрів води виходить десять літрів твердого льоду!
Коли взимку розриваються автомобільні радіатори й водопроводи, це відбувається тому, що вода замерзає й збільшується в об’ємі.
Вода може не замерзати при температурі нижче нуля градусів Цельсія під впливом електричного поля. Ізраїльські вчені детально досліджували це явище, хоча про його причини поки можна тільки здогадуватися. З дитинства кожен пам’ятає, що вода замерзає при температурі 0 градусів за Цельсієм. Можливо, хтось чув і про те, що чиста прісна вода в дуже чистій посудині може перебувати в рідкому стані і при негативних температурах.
Вчені у своїх дослідах доходили до температури мінус 40 градусів за Цельсієм. Вода в рідкому вигляді при негативній температурі зветься переохолодженою, і при цьому вона знаходиться в дуже нестійкому стані: варто з’явитися хоч однієї сторонньої частці, навколо якої може утворитися кристал льоду, як тут же вся вода замерзає. Група вчених з інституту імені Вейцмана (Ізраїль) під керівництвом Ігоря Любомирського з’ясувала, що переохолоджена вода замерзає при різних температурах в залежності від того, позитивно чи негативно заряджена поверхня, з якою стикається вода. Основним предметом дослідження ізраїльських учених стали піроелектричні (володіють поляризацією за відсутності зовнішніх впливів) аморфні (що не мають впорядкованої кристалічної структури) тверді тіла. Одного разу Ігор Любомирський виявив, що якщо вода контактує з поверхнею з подібного матеріалу, то температура замерзання води залежить від заряду поверхні.
Негативний заряд знижував температуру замерзання, а позитивний підвищував її. Звернувши увагу на цей факт, учені вирішили докладніше досліджувати його. Використовуючи потужні мікроскопи, Ігор Любомирський і колеги виявили, що крапельки води на кристалах танталата літію (LiTaO) замерзають при температурі -11 градусів.
Зі зміною заряду з негативного на позитивний температура замерзання підвищувалася на кілька градусів. Використовуючи метод рентгеноструктурного аналізу, дослідники відзначили, що позитивно заряджені поверхні викликають початок замерзання переохолодженої води на межі поверхні вода, тоді як негативно заряджені тягнуть початок замерзання на поверхні води повітря. Коментуючи свою роботу, Ігор Любомирський зізнається, що не знає, чому зміна заряду так змінює властивості води. Те, що ми тепер знаємо, дає нам дуже, дуже, дуже хорошу тему для роздумів, наводять слова вченого.
Можливість контролювати температуру замерзання переохолодженої води може бути досить актуальною. Зокрема, результати роботи ізраїльських учених можуть знайти своє застосування в актуальних галузях досліджень: виживання холоднокровних тварин; криоконсервация (методи зберігання органів, тканин або окремих клітин при зниженій температурі); захист сільськогосподарських культур від замерзання; посів хмар (тобто цілеспрямована зміна погоди для створення дощу в посушливих місцях або викликання дощу з метою зменшення ймовірності граду).
Бактерії відповідальні за погоду.
 Кристалізація льоду в хмарах стає можливою лише за сприяння місцевих мікроорганізмів.
Кристалізація льоду в хмарах стає можливою лише за сприяння місцевих мікроорганізмів.
Концентрації мікроорганізмів, що живуть у товщі граду, впливають на утворення льоду в хмарах, визначаючи погоду, стверджують експерти.
Мікроорганізми і опади
На 111-их зборах Американського товариства мікробіологів (Новий Орлеан, США) дослідник Олександр Мішо представив роботу, яку він провів разом зі своїми колегами. У ній була вивчена ступінь впливу мікроорганізмів на погодні явища. У центрі граду вчені побачили так звані ініціатори утворення льоду. Молекули води потребують таких ініціаторів, щоб прийняти вид дощу, граду або снігу. Саме навколо них наростають крижані кристали. Ініціаторами кристалізації можуть бути частинки будь-якого аерозолю. Найчастіше вони бувають мінерального походження. Проте вчені довели, що бактерії «працюють» в даному випадку не гірше.
Дослідники вивчили також інші зразки граду (вони більше вихідних на 5 см в діаметрі), які впали в кампусі університету під час шторму в червні 2010 року. А також вони проаналізували склад талої води і виявили, що в її ядрі теж міститься найбільша кількість живих бактерій. Таким чином, вчені виявили їх у всіх зразках снігу і граду.
Це явище вчені охрестили біопреціпітація (або біологічні опади). До речі, термін не новий. Його ще в 1980-х роках ввів фітопатолог з Університету штату Монтана (США) Девід Сендс.
Над загадкою, яку ж роль в утворенні льоду грають бактерії, б'ється ще одна команда американських мікробіологів під керівництвом доктора Брента Крістнера з Університету штату Луїзіана (США). Вони довели, що якраз природні, біологічні ініціатори кристалізації «працюють» набагато краще мінеральних. Вони стимулюють утворення опадів при температурі вже близько -2 градусів за Цельсієм.
Найактивнішою бактерією, від якої залежить утворення опадів, є Pseudomonas syringae. Вона, до речі, добре відома фермерам через те, що вражає томати і бобові. Крім того, бактерія використовує свою можливість заморожувати воду, щоб розірвати стінки клітин рослин, на яких вона паразитує. Ще ці бактерії можуть переміщатися на деякі відстані і повертатися назад на Землю.
Деякий час тому вчені думали над тим, щоб знищити розумну бактерію. Але результати дослідження змусили їх замислитися про те, шкода або все-таки користь цей мікроорганізм приносить нашій планеті.
Висновки:
1. Для замерзання води необхідне стороннє тіло (аерозоль, бактерія, частинка будь-якого тіла).
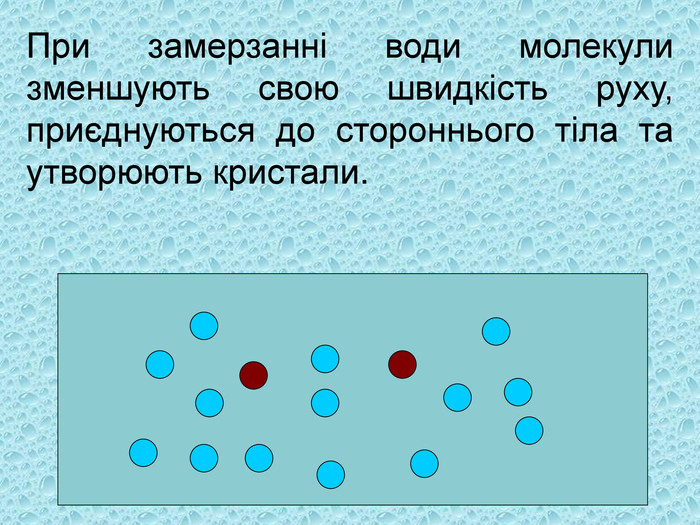
2. При замерзанні води молекули зменшують свою швидкість руху, приєднуються до стороннього тіла та утворюють кристали.
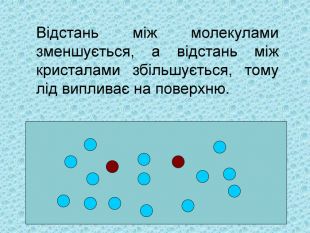
3. Відстань між молекулами зменшується, а відстань між кристалами збільшується, тому лід випливає на поверхню.
4. Вода при замерзанні збільшується в об'ємі.
5. На замерзання чистої води необхідно більше часу та нижчу температуру.
6. При негативному заряді для замерзання води необхідна температура нижча за 0 градусів за Цельсієм, а при позитивному навпаки.
Список використаних джерел.
1.http://ladyfacts.ru/insha/ekologija/42280-bakterii-vidpovidalni-za-pogodu.html.
2. https://ru.wikipedia.org/wiki/Вода.
3. http://tips-ua.com/80935-chomu-voda-zamerzaeh.html.
4.Современная гимназия: взгляд теоретика и практика/ Под ред. Е.С.Полат – М., 2000.
5.Новые педагогические и информационные технологии в системе образования/ Под ред. Е.С.Полат – М., 2000
6.Полат Е.С. Метод проектов на уроках иностранного языка/ Иностранные языки в школе - № 2, 3 - 2000 г.
7.Полат Е.С. Типология телекоммуникационных проектов. Наука и школа - № 4, 1997

про публікацію авторської розробки
Додати розробку