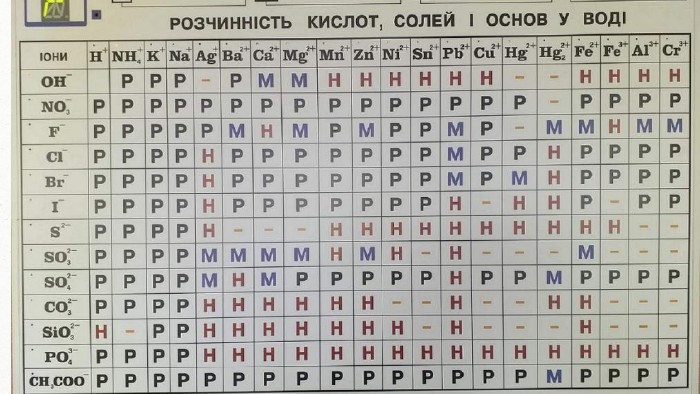
Реакції обміну між розчинами електролітів. Йонно-молекулярні рівняння хімічних реакцій
Про матеріал
Реакції обміну між розчинами електролітів. Йонно-молекулярні рівняння хімічних реакцій . Особливості перебігу реагуючих речовин. Перегляд файлу
Зміст слайдів
pptx
До підручника
Хімія для загальноосвітніх навчальних закладів з поглибленим вивченням хімії 9 клас (Бутенко А.М.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку