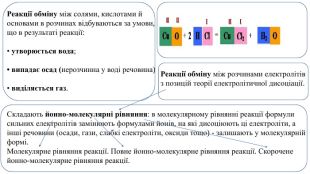
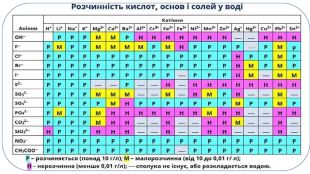
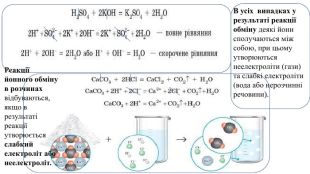
Презентація. 9клас. Реакції обміну між розчинами електролітів. Йонно-молекулярні рівняння хімічних реакцій.
Про матеріал
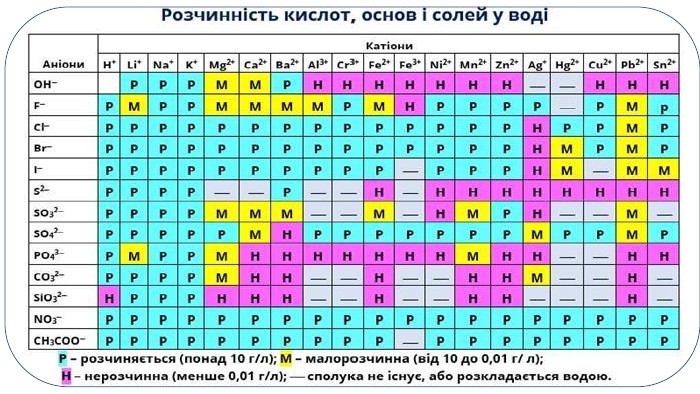
Пропоную до уваги добірку навчального матеріала у вигляді презентації. Матеріал презентації буде доречний під час повторення навчального матеріала за вказаною темою. Презентація за темою "Реакції обміну між розчинами електролітів. Йонно-молекулярні рівняння хімічних реакцій." може бути корисною та використана під час підготовки до уроку або під час уроку онлайн або офлайн заняття. Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку








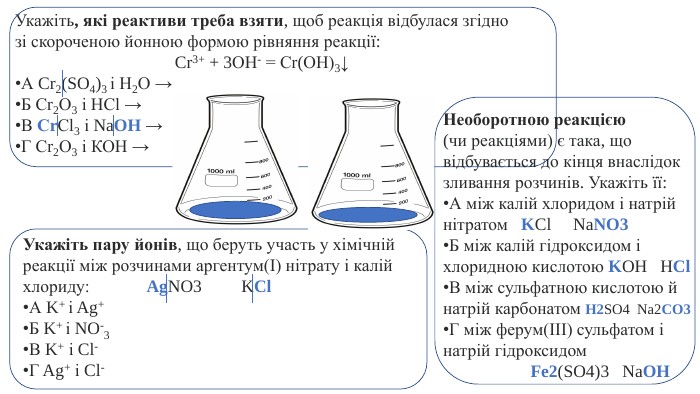
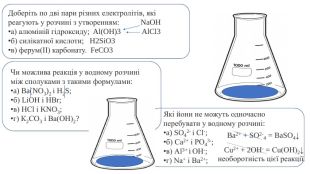
![Запишіть формули продуктів реакцій і складіть молекулярні та йонно-молекулярні рівняння:а) Nі(NO3)2 + КОН → ... б) Zn. Cl2 + Na2 S → ...в) Мn. СO3 + H2 SO4 → ... Допишіть схеми реакцій, складіть молекулярні та йонно-молекулярні рівняння:a) Ba(NО3)2 + ... → HNО3 + ...б) К2 СО3 + ... → K2 SO4 + ...в) Na[Al(OH)4] + ... → ... + Аl. Сl3 + Н2 O Запишіть формули продуктів реакцій і складіть молекулярні та йонно-молекулярні рівняння:а) Nі(NO3)2 + КОН → ... б) Zn. Cl2 + Na2 S → ...в) Мn. СO3 + H2 SO4 → ... Допишіть схеми реакцій, складіть молекулярні та йонно-молекулярні рівняння:a) Ba(NО3)2 + ... → HNО3 + ...б) К2 СО3 + ... → K2 SO4 + ...в) Na[Al(OH)4] + ... → ... + Аl. Сl3 + Н2 O](/uploads/files/1463499/310974/341635_images/11.jpg)