Реакція нейтралізації. Розкладання нерозчинних основ у процесі нагрівання
| Тема: | Реакція нейтралізації. Розкладання нерозчинних основ у процесі нагрівання |
| Мета: | закріпити знання учнів про хімічні властивості основ |
| Завдання: | закріпити знання учнів про хімічні властивості основ; |
| Тип уроку: | формування вмінь та навичок.. |
УРОК №
|
Тема: |
Реакція нейтралізації. Розкладання нерозчинних основ у процесі нагрівання
|
|
Мета: |
закріпити знання учнів про хімічні властивості основ
|
|
Завдання: |
закріпити знання учнів про хімічні властивості основ;
|
|
Тип уроку: |
формування вмінь та навичок..
|
|
Форми роботи: |
розповідь вчителя з елементами бесіди, виконання завдань
|
|
Обладнання: |
періодична система хімічних елементів Д. І. Менделєєва; таблиця розчинності основ, кислот і солей у воді; |
ХІД УРОКУ
I. Організаційний етап
II. Перевірка домашнього завдання
На попередніх уроках ми познайомилися з фізичними й хімічними властивостями основ.

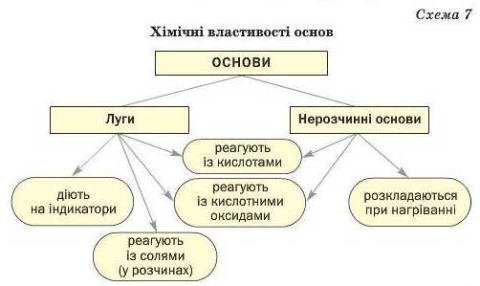
Робота з опорною схемою «Хімічні властивості основ»
• На основі знань про хімічні властивості основ заповнимо опорну схему «Хімічні властивості основ».
IIІ. Актуалізація опорних знань. Мотивація навчальної діяльності.
Ми з вами продовжуємо вивчати основні класи неорганічних сполук.
1. В які класи неорганічних сполук єднають всі складні речовини? (Оксиди, кислоти, солі та основи).
2. Які речовини називають оксидами? (Бінарні сполуки, що містять Оксиген).
3. На які групи можна поділити оксиди? (Основні та кислотні).
4. Чим відрізняються між собою основні та кислотні оксиди? (Основні утворені металом, а кислотні – неметалом)
5. Які речовини називають основами? (Іонні сполуки, що містять катіони металу та аніони гідроксогрупи).
6. Які речовини називають кислотами? (Складні речовини, що містять Гідроген та кислотний залишок).
7. Які речовини називають солями? (Іонні сполуки, що містять катіони металу та аніони кислотного залишку).
Завдання 1 «Морський бій». (Робота з навчальною таблицею)
Вчитель вказує координати, а учень:
• Читає формулу речовини,
• Вказує клас, до якого належить ця речовина
8. На які групи можна поділити всі основи? (За кількістю гідроксогрупи: одно кислотні, двокислотні та багатокислотні, по відношенню до води: розчинні та нерозчинні).
9. Як називають основи, які розчиняються у воді? (основи, які розчиняються у воді називають лугами).
10. Де взяти інформацію про розчинність речовин у воді? (З таблиці розчинності.)
Завдання 2
Із запропонованих речовин виберіть ті, які реагують з розчинами лугів:
1. Н2О,
2. Н2SO4
3. SO3
4. CаO
5. СuSO4
6. NаОН
11. З речовинами яких класів реагують луги? (Кислотними оксидами, кислотами, солями).
ІV. Формування практичних вмінь та навичок.
1. Реакція нейтралізації
Реакції з кислотами. Під час взаємодії основи з кислотою сполуки обмінюються частинками, з яких вони складаються:
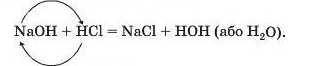
Це — реакція обміну.
З’ясувати, чи залишився луг після добавляння певної порції кислоти, можна, добавивши до рідини 1—2 краплі розчину фенолфталеїну. Якщо малиновий колір не з’явився, то луг повністю прореагував із кислотою.
Приклад реакції нерозчинної основи з кислотою:
![]()
Реакцію між основою і кислотою називають реакцією нейтралізації.
Ва(OH)2 + SO2 = BaSO3 + H2O
6KOH + P2O5 = 2K3PO4 + 3H2O
Ca(OH)2 + CO2 = CaCO3 + H2O
2. Розкладання нерозчинних основ
Майже всі основи (крім гідроксидів Натрію і Калію, лужних металів) у результаті нагрівання легко розкладаються на оксид і воду:
Cu(OH)2 = CuO + H2O.
3. Правила техніки безпеки при роботі з лугами.
Бесіда.
1. Чим небезпечні луги? (Потрапляючи на шкіру викликають опіки).
2. Чому луги викликають опіки, потрапляючи на шкіру? (Активно реагують з вологою шкіри).
3. Як називають опіки лугами чи кислотами? (Хімічними).
4. Чим небезпечні хімічні опіки? (Вони досить сильні (2-4 ступені), сліди залишаються тривалий час).
5. Як надати першу допомогу у разі потрапляння лугу на шкіру? (Промити ушкоджену ділянку великою кількістю води, обробити слабким розчином оцту, чи борної кислоти, що є в лабораторній аптечці).
V. Закріплення вивченого матеріалу
- Самостійна робота
Прийом «Коло ідей»
Прийом «Взаємоперевірка»
Відповіді перевіряють.
- Керована практика
Завдання 1. Обчисліть кількість речовини води, що утвориться внаслідок нагрівання алюміній гідроксиду масою 15,6 г.
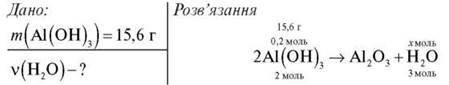
1) Обчислимо кількість речовини Аl(ОН)3 за формулою ![]() = m/M:
= m/M:
![]()
2) Складемо пропорцію й обчислимо кількість речовини води:
0,2 моль : 2 моль = х моль : 3 моль
![]()
Відповідь: 0,3 моль.
Завдання 2.
Прийом «Лови помилку»
Знайти помилки в рівняннях реакцій:
1) CaOH + HCl = CaCl2+ H2O
2) H2SO3 + NaOH = Na2SO4 + H2
3) SO3 + NaOH = Na2SO3 + H2O
4) Mg (OH)2 + H2SO4 = Mg2SO4 + H2O
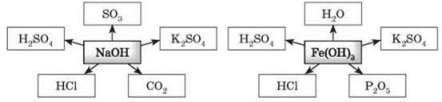
Завдання 3. Здійсніть перетворення:
![]()
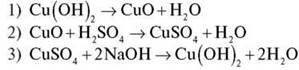
VІ. Підсумки уроку
• Підсумки уроку
Ми розглянули матеріал уроку і тепер, гадаю, можемо дати відповіді на питання, поставлені на початку уроку.
1. Чи характерні подібні властивості для нерозчинних основ? (Так, нерозчинні основи, подібно до лугів, реагують з кислотами з утворенням солі та води).
2. Чим відрізняються за властивостями розчинні та нерозчинні основи? (нерозчинні основи не змінюють колір індикатора, розкладаються при нагріванні до оксидів).
• Висновки
1. Нерозчинні основи подібно до лугів реагують з кислотами з утворенням солі та води.
2. Нерозчинні основи розкладаються при нагріванні на відповідний оксид та воду.
• Оцінювання учнів
VІІ. Домашнє завдання


про публікацію авторської розробки
Додати розробку
