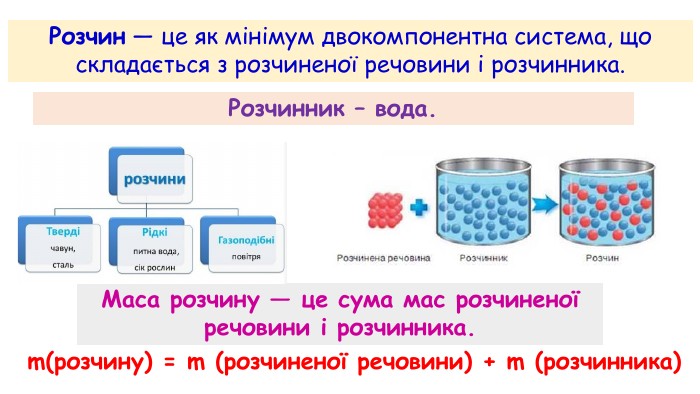
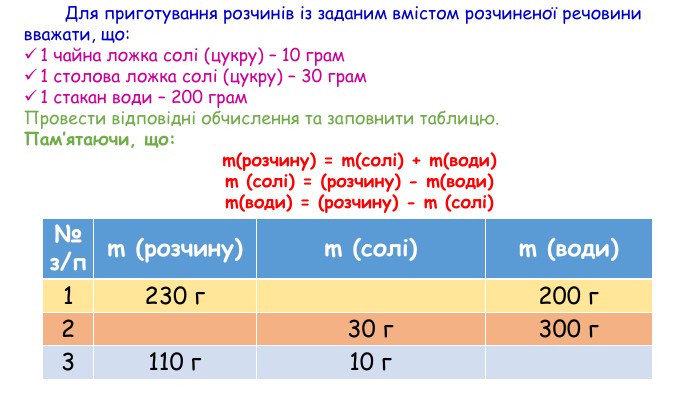
Розчини: склад і виготовлення. Розчини у природі й побуті
Про матеріал
Навчальна презентація для 6 класу і/к "Пізнаємо природу" до Модельної навчальної програми «Пізнаємо природу» 5-6 класи (інтегрований курс)» для закладів загальної середньої освіти (авт. Коршевнюк Т.В.) Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку