РОЗЧИНИ. Способи вираження концентрації розчинів.
![]()
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
КАХОВСЬКИЙ АГРОТЕХНОЛОГІЧНИЙ ФАХОВИЙ КОЛЕДЖ


МЕТОДИЧНІ МАТЕРІАЛИ
ДЛЯ ПРОВЕДЕННЯ ЛЕКЦІЇ-ПРАКТИКУМУ
![]()
УКЛАДАЧ: Падалка Олена Миколаївна – викладач хімії, біології та
спеціальної хімії Каховського агротехнологічного фахового
коледжу, спеціаліст вищої кваліфікаційної категорії,
викладач – методист.
Методична розробка включає методичні матеріали традиційного заняття із застосування форм педагогічної майстерності для формування професійних вмінь та компетенцій майбутнього спеціаліста харчової промисловості.
![]()

Дисципліна: Неорганічна хімія
Тема заняття: Розчини, їх загальна характеристика.
Способи вираження концентрації розчинів.
Вид заняття: Лекція-практикум
Методична
мета: Показати інтегрування ретротехнологій і інтерактивними методами із
метою формування вмінь та предметних і професійних компетенцій
спеціаліста харчової переробки.
Мета заняття:
Навчальна: ознайомити студентів із загальною характеристикою розчинів, значенням розчинів в технології, техніці і природі, сформувати поняття “розчини”, ”розчинність”, ”концентрація розчинів”. Розглянути класифікацію розчинів, фактори, що впливають на розчинність речовин, з’ясувати суть хімічної теорії розчинів та процесу розчинення. Навчити визначати різні види концентрації розчинів, розв’язувати задачі на визначення масової і об’ємної кількості речовини, необхідної для приготування розчинів заданої концентрації.
Розвиваюча: розвивати пізнавальний інтерес до дисципліни, логічне мислення,
самостійність при розв’язуванні задач, увагу, пам’ять, уміння ви
користовувати знання інших дисциплін, робити висновки.
Виховна: формувати науковий та технологічний світогляд компетентного спеціаліста, сприяти розвитку організаційно-управлінської, технологічної та контролюючої функції спеціаліста. Реалізувати всі напрямки програми Національного виховання студентської молоді.
Компетентності: уміння вчитися, інформаційно-комунікативна, здоров'язберігаюча.
Теоретична: Знати поняття “розчини”,”розчинність”, ”концентрація розчинів”, їх природу, класифікацію, механізм розчинення речовин, визначення різних видів концентрації розчинів.
Практична: Вміти визначати розчинність твердих речовин у воді, розв’язувати задачі на визначення масової і об’ємної кількості речовини, необхідної для приготування розчинів заданої концентрації.
![]()
Забезпечуючі:
Математика:
- Відсоткові розрахунки.
Забезпечувані:
Фізика:
- Електричний струм в електролітах.
Фізична і колоїдна хімія:
- Фазова рівновага та вчення про розчини.
Аналітична хімія:
- Теоретичні основи аналітичної хімії.
- Титрометричний аналіз.
Санітарія і гігієна:
- Санітарні вимоги до прибирання території, приміщень ресторанного господарства.
Технологія виробництва продукції тваринництва:
- Обробка риби і нерибних продуктів моря.
- Солодкі страви.
- Гарячі і холодні безалкогольні напої.
Процеси і апарати харчових виробництв:
- Процеси кристалізації і розчинення.
Основи харчових промисловості:
- Чай, кава, чайні та кавові напої.
- Алкогольні і безалкогольні напої.
Безпека життєдіяльності:
- Техногенні небезпеки.
Основи екології:
- Водні ресурси України та їх охорона.
Забезпечення заняття
1. Наочні посібники: періодична система хімічних елементів Д.І Менделєєва; таблиця розчинності, таблиця “Залежність розчинності речовин від температури”,“Залежність розчинності речовин від природи розчиненої речовини”; макети: “Мариновані овочі”, “Сік”, “Молоко, “Алкогольні напої”, “Оцтова кислота”, ”Парфуми”, “5 % розчин йоду,” “1 % розчин бріліанта зеленого”, “3 % розчин гідроген пероксиду ”, “Краплі назальні”, “Сироп від кашлю”, “Зубна паста”, склянки з написом: “Повітря”, “Морська вода”, “0,2 % розчин хлорного вапна”, “2 % розчин кальцинованої соди”, “1 % розчин соди”, колекція сплавів, мінералів.
2. Роздатковий матеріал: опорний робочий конспект “Розчини”
З.ТЗН: комп’ютер, мультимедійний проектор: презентація “Розчини. Способи вираження концентрації розчинів”, відеофільм “Загальні властивості розчинів”, відеодослід “Розчинення твердих речовин у воді”
4. Навчальні місця: кабінет хімії (аудиторія №7)
|
СТРУКТУРА ЗАНЯТТЯ |
||
|
№ П\П |
ВИД РОБОТИ НА ЗАНЯТТІ |
МЕТОДИ РОБОТИ ВИКЛАДАЧА |
|
1. |
Організація заняття. |
|
|
2. |
Підготовка студентів до вивчення нового матеріалу.
|
|
|
3. |
Вивчення нового матеріалу. |
|
|
4. |
Закріплення знань, формування вмінь, навичок, компетенцій, самостійна робота під керівництвом викладача. |
|
|
5. |
Підсумки заняття. Аналіз роботи студентів на занятті (усний). |
|
|
6. |
Рефлексія. |
|
|
7. |
Повідомлення домашнього завдання. |
|
Література:
- основна:
1. Г.П. Хомченко “Посібник з хімії”- К.: А.С.К.: 2005.– с. 131-134.
2. О.М. Ерохин, В.И.Фролов “Сборник задач и упражнений по химии” с. 55-57.
- додаткова:
1. М.М.Петров, Л.А. Михилев, Ю.Н. Кукушкин ”Неорганическая химия” ,
с.128-145.
2. А.И. Астахов, А.И. Касьяненко “Химия”, с.19-21, 272-273.
Зміст заняття
1. Організація заняття:
- перевірка готовності студентів до заняття;
- оформлення журналу;
- встановлення психолого-педагогічного контакту з аудиторією студентів.
- Метод: навіювання.
Викладач:
Доброго дня! Я рада бачити Вас знову у нашій творчій лабораторії.
Слайд 2
Нас чекає напружена і цікава робота, девізом якої нехай стануть слова видатного вченого М.В. Ломоносова: “Хімії навчитися неможливо, якщо не бачити самої практики і не братися за хімічні операції”.
Подаруйте один одному посмішку, а я бажаю кожному з вас, щоб на цьому занятті ви були:
Слайд 3
“У”- уважними;
“С”- спокійними;
“П”- працелюбними;
“І”- ініціативними;
“Х”- хоробрими.
А одним словом, я бажаю вам УСПІХУ в процесі пізнання!
Підніміть руку, хто бажає досягти успіху?
Отже, це питання є важливим для всіх нас.
- Підготовка студентів до вивчення нового матеріалу.
- Повідомлення теми, мети та завдань заняття.
Слайд 4
Тема заняття: Розчини, їх загальна характеристика. Способи вираження концентрації розчинів.
Мета заняття: ознайомитися із загальною характеристикою розчинів, значенням розчинів в технології, техніці і природі. Сформувати поняття “розчини”, ”розчинність”, ”концентрація розчинів”. Розглянути класифікацію розчинів, фактори, що впливають на розчинність речовин, з’ясувати суть хімічної теорії розчинів та процесу розчинення. Навчитись визначати різні види концентрації розчинів. Розв’язувати задачі на визначення масової і об’ємної кількості речовини, необхідної для приготування розчинів заданої концентрації.
Слайд 5
Вивчивши цю тему, Ви будите знати:
- значення розчинів в технології, техніці і природі;
- природу і основні властивості розчинів, їх класифікацію;
- механізм розчинення речовин;
- залежність розчинення від різних чинників;
- різні способи вираження концентрації розчинів.
Слайд 6
Знання цієї теми збагатять Вас такими вміннями:
- визначати розчинність речовин у воді;
- користуватися таблицею розчинності основ, кислот, солей у воді (за температури 20-25 °С) для прогнозування перебігу хімічних реакцій;
- пояснювати залежність розчинності речовин від різних чинників;
- розв’язувати задачі з визначення масової і об’ємної кількості речовини, необхідної для приготування розчинів заданої концентрації.
Слайд 7
План викладу нового матеріалу
1. Природа розчинів, їх класифікація.
2. Розчинність, її залежність від різних факторів.
3. Сутність процесу розчинення.
4. Способи вираження складу розчинів.
2.2. Мотивація навчальної діяльності студентів
- Метод: переконання, демонстрація.
Викладач:
Зверніть, будь ласка, увагу на продукцію, що виставлена на столі. Як Ви вважаєте, що є спільним для всіх виставлених предметів?
Очікувана відповідь:
Всі вони або є розчинами або виготовлені з використанням розчинів.
Викладач:
Як Ви думаєте, з якою метою вони виставлені на занятті?
Очікувана відповідь:
Вони пов’язані з темою нашого заняття.
Викладач:
Дійсно, сьогодні ми поговоримо про добре знайомі кожній людині розчини.
Давайте поміркуємо над питанням: чому Вам потрібно вивчати цю тему?
Очікувана відповідь.
Розчини й сам процес розчинення мають велике значення у природі, у нашому житті, у промисловості і сільському господарстві. Найчастіше ми маємо справу не з чистими речовинами, а із сумішами або розчинами.
Слайд 8-10
Викладач:
Дійсно, з розчинами ми зустрічаємось повсякчасно.
Вода морів, річок, озер, ґрунтові води, питна вода — це розчини. Повітря — це розчин газів. Більшість мінералів — це тверді розчини.
З біології Ви вже знаєте, що без розчинів не виникло б життя на нашій планеті. Адже доісторичні організми спершу отримували необхідні для життєдіяльності речовини лише з водного середовища.
Людина складається на 80% із води. Всі важливі біологічні процеси існування від найпростіших організмів до людини відбуваються за участю водних розчинів різних речовин. Поживні речовини переносяться по організму всіх живих істот лише у розчиненому стані.
Розчинами є найважливіші фізіологічні рідини - кров, лімфа тощо.
Життєдіяльність людини відбувається завдяки використанню продуктів, що вирощує сільське господарство, внесенню мінеральних добрив до ґрунту, які розчиняються водою, утворюючи розчини, що покращують врожайність, витривалість рослин від хвороб, захищеність від шкідників покращується за рахунок використання різних розчинів.
Розчини використовують також у виробничих процесах. Важко назвати яку-небудь галузь промислового виробництва, де не використовувалися розчини.
Наочні приклади використання розчинів у побуті та житті людини Ви бачите перед собою та на екрані.
Вміти приготувати розчин – це життєва потреба кожного з нас.
Ось чому вчення про розчини є одним із найважливіших розділів хімії.
Викладач:
Знання та практичні навички, якими Ви оволодієте під час вивчення даної теми, знадобляться при вивченні цілого ряду наступних дисциплін.
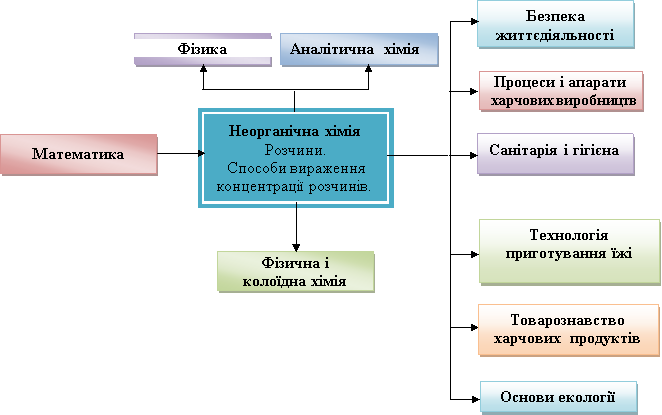
Слайд 11 Структурно-логічна схема МПЗ
В майбутньому, вивчаючи дисципліни “Аналітична хімія”, “Фізколоїдна хімія” та ”Біологічна хімія”, Ви поглибити знання про розчини, їх різноманітність, властивості, удосконалити вміння готувати розчини різних концентрацій.
Під час вивчення дисциплін “Санітарія і гігієна” і “Безпека життєдіяльності” Ви дізнаєтесь, які розчини використовують на підприємствах громадського харчування для дезінфекції території, приміщень, миття столового і кухонного посуду, обладнання інвентарю та умови їх безпечного використання.
На спецдисциплінах Ви вивчатиме склад, властивості, особливості розчинів, навчитеся готувати та правильно використовувати розчини, на основі їхніх властивостей.
У своїй професійній діяльності Ви будите щодня використовувати продукти, готувати страви із застосуванням саме розчинів. З розчинами пов’язані такі технологічні процеси як термічна обробка сировини та продукції, приготування їжі шляхом варіння, тушкування, пароваріння, консервування; прибирання робочого місця, очистка посуду, варильних поверхонь, спецодягу спеціаліста тощо. Розчинами є холодні і горячи напої: смак, колір та запах яких залежить від концентрації різних речовин в складі розчину.
Тому знання даної теми необхідні Вам, майбутнім спеціалістам харчової промисловості.
2.3. Актуалізація життєвого досвіду і опорних знань студентів.
- Метод: інформаційно-комунікативний, діалогове навчання, демонстрація, опора на життєвий досвід.
Викладач:
Я пропоную переглянути відеофільм «Приготування розчинів».
Слайд 12
Викладач:
На основі переглянутого матеріалу, поясніть поняття: “розчинник”, “розчинена речовина”.
Очікувана відповідь:
“Розчинник” – речовина, в якій розчиняють. В нашому прикладі розчинником є вода.
“Розчинена речовина” – речовина, яку розчиняють. В нашому розчині це – кухонна сіль.
Викладач:
Проблема: А як визначити, яка речовина буде розчинником, а яка розчиненою речовиною, якщо обидві речовини до розчинення перебувають в однаковому агрегатному стані, наприклад оцет і вода, як в нашому другому розчині?
Очікувана відповідь:
Розчинником вважають речовину, якої в розчині більше.
Висновок:
Компонент, якого є більше, називають розчинником, а якого менше – розчиненою речовиною. Якщо один компонент рідина, а другий – тверде тіло або газ, то розчинником називають рідину, незалежно від її кількості в суміші.
Викладач:
Чи можна стверджувати, що розчини бувають лише рідкими?
Примітка:
Звернути увагу студентів на склянку з повітрям (газоподібний розчин),
зразок мінералу або сплаву (твердий розчин).
Очікувана відповідь:
Ні. Розчини можуть бути рідкими, газоподібними (повітря), твердими (сплави).
Викладач:
- Чи можна стверджувати, що обов’язковим компонентом всіх рідких
розчинів є вода?
- В яких рідинах, крім води, можна розчиняти речовини?
Очікувана відповідь:
- Ні.
- Досить часто для розчинення використовують інші рідини: спирт,
ацетон, бензин, оліфу, рослинну олію, молоко тощо.
Викладач:
Чим розчин відрізняється від суміші?
Очікувана відповідь:
Розчин – однорідна система, а в суміші помітні окремі складові частинки.
Викладач:
Чим розчин відрізняється від складної речовини?
Очікувана відповідь:
Розчини не мають постійного складу.
Викладач:
На вашу думку, що ж таке розчини?
Очікувана відповідь:
Розчини – це однорідні (гомогенні) системи змінного складу, які складаються з двох або більше незалежних компонентів.
3. Вивчення нового матеріалу.
Питання №1. Природа розчинів, їх класифікація.
- Метод: пояснювально-ілюстративний, опора на життєвий досвід, логічний аналіз.
Слайд 13
Викладач знайомить студентів з класифікацією розчинів за складом, розчинністю, агрегатним станом:
Класифікація розчинів
![]()
![]()
![]() Розчини
Розчини
За агрегатним За розчинністю Ненасичені за вмістом
станом: речовин: розчиненої речовини
- рідкі - насичені - концентровані
- тверді - ненасичені - розведені
- газоподібні - перенасичені
Завдання:
Поясніть поняття: ”насичений розчин”, “ненасичений розчин”, “перенасичений розчин”, “концентрований розчин“, “розведений розчин”.
Слайд 14
Викладач доповнює і уточнює відповіді студентів, формулює визначення основних понять, що розглядаються:
- Насичений розчин - це розчин, в якому речовина за даних умов більше не розчиняється,
- Ненасичений розчин - це розчин, у якому вміст розчиненої речовини менший, ніж у насиченому за даної температури.
- Перенасичений розчин містить розчиненої речовини більше, ніж насичений за даної температури. Перенасичені розчини нестабільні і за найменшого впливу досить легко переходять у насичені з вивільненням надлишку розчиненої речовини (надлишок розчиненої речовини переходить в осад). Ці розчини застосовують для очищення речовин методом перекристалізації та вирощення кристалів.
- Концентровані - кількості розчиненої речовини і розчинника виражені співставними величинами.
- Розведені – вміст розчиненої речовини значно менший, ніж вміст розчинника.
Проблема:
Поясніть:
- Як можна з насиченого розчину зробити ненасичений?
Очікувана відповідь:
- Нагріти, додати розчинник.
- Чи можна з ненасиченого розчину зробити насичений?
Очікувана відповідь:
Остудити, додати розчиненої речовини, випарити розчинник.
Питання №2. Розчинність, її залежність від різних
факторів.
- Метод вивчення: проблемна бесіда, пояснювально-демонстраційний, пояснювально-ілюстративний, опора на життєвий досвід, віртуальний експеримент.
Слайд 15
Викладач:
Найпоширенішим розчинником є вода. Як Ви вважаєте, чи всі речовини однаково розчиняються у воді.
Очікувана відповідь:
Ні. За розчинністю у воді всі речовини поділяють на три групи:
малорозчинні, розчинні і нерозчинні.
Викладач:
Переконаємося в цьому переглянувши відеодослід.
Слайд 16
Перегляд відеодосліду “Розчинення твердих речовин у воді”
Слайд 17
Розгляньте схему та поясніть, які речовини відносять до малорозчинних,
розчинних і нерозчинних.
Класифікація твердих та рідких речовин за розчинністю

Слайд 18
Пояснення викладача.
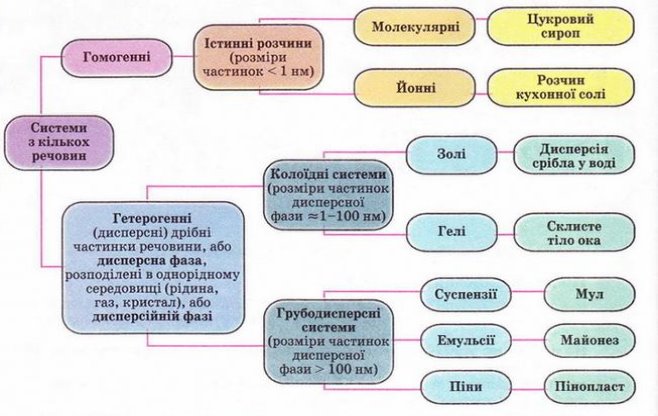
Слайд 19
Викладач:
Кількісно здатність розчинятися у воді визначається фізичною величиною – розчинністю.
Розчинність — це здатність речовини розчинятися у воді або іншому розчиннику. Розчинність виражають максимальною кількістю грамів речовини, яку можна розчинити в 100 г розчинника при даній температурі. Розчинність іноді називають коефіцієнтом розчинності.
Добре розчинні речовини - розчинність перевищує 10 г на 100 г розчинника (сульфатна, нітратна, оцтова кислоти, ацетон, гліцерин).
Розчинні речовини - якщо розчинність речовин від 1 до 10 г на 100 г розчинника (бром).
Малорозчинні речовини - розчинність від 0,001 до 1 г на 100 г розчинника (азот, кальцій карбонат).
Як Ви вважаєте, чи можна прискорити процес розчинення речовин?
Очікувана відповідь:
Для прискорення розчинення можна розчин нагріти, а також перемішати.
Слайд 20
Викладач:
Отже, за розчинністю розчини класифікуються:
- Розчини низькомолекулярних і високомолекулярних сполук;
- Електроліти і неелектроліти.
Пояснення викладача.
Слайд 21
Викладач:
Для різних речовин було експериментально розраховано й побудовано залежності розчинності від температури і тиску. Як бачимо, дійсно, для більшості твердих і рідких речовин розчинність збільшується зі збільшенням температури, але для газоподібних речовин з підвищенням температури розчинність, навпаки, зменшується. Це пояснюється тим, що нагрівання прискорює рух молекул, внаслідок чого частина з них залишає розчин. Тож, коли виникає потреба розчинити якомога більше газуватої речовини у певному об’ємі води, слід вдатися до охолодження, а не до нагрівання розчину.
Слайд 22
Викладач:
Розчинність газів у рідинах істотно залежить від тиску. Усім вам добре відомі такі газовані напої, як мінеральна вода, кока-кола, лимонад тощо. Однією зі стадій їх виготовлення є насичення напоїв вуглекислим газом під тиском у кілька атмосфер. Коли ж пляшку відкорковують, тиск всередині неї знижується, завдяки цьому відбувається енергійне виділення “зайвого” газу. Отже, з підвищенням тиску розчинність газуватих речовин у воді збільшується.
Які ще фактори впливають на розчинність?
Слайд 23
Викладач:
На розчинність впливають різні екзогенні чинники.
Вплив екзогенних чинників на розчинність речовин
- Якщо процес розчинення відбувається ендотермічно, то з підвищенням температури розчинність зростає, а якщо екзотермічно, то – зменшується.
- При розчиненні твердих речовин у воді, об’єм системи звичайно змінюється незначно. Тому розчинність речовин, які знаходяться в твердому стані, практично не залежить від тиску. На розчинність твердих речовин суттєво впливає температура.
- Рідини можуть розчинятися в рідинах. З підвищенням температури взаємна розчинність рідин збільшується доти, поки не буде досягнута температура, при якій обидві рідини змішуються в будь-яких пропорціях.
- взаємне розчинення рідин не супроводжується значною зміною об’єму.
- Взаємна розчинність рідин мало залежить від тиску і помітно зростає лише при дуже високих тисках (порядку тисяч атмосфер).
Слайд 24
Викладач:
Під час перегляду досліду Ви мали змогу переконатися, що розчинність залежить від природи розчинника і розчиненої речовини (виконується принцип: “подібне розчиняється у подібному”). Тверді речовини з полярними або іонними кристалічними гратками (солі, кислоти) добре розчиняються в полярних розчинниках. Ідеальним розчинником для таких речовин є вода. Неполярні тверді і рідкі речовини добре розчиняються в органічних неполярних розчинниках (бензин, бензол, толуол тощо)
Висновок:
Розчинність речовини — це її здатність переходити у розчин.
Розчинність дорівнює концентрації речовини у насиченому розчині. Вона залежить від природи розчиненої речовини і розчинника та зовнішніх чинників — температури і тиску.
Питання №3. Сутність процесу розчинення.
- Метод вивчення: пояснювально-демонстраційний, опора на життєвий досвід.
Викладач:
- Що ж відбувається з речовинами в процесі утворення розчинів?
- Процес розчинення – це фізичне чи хімічне явище?
З’ясуємо це переглянувши фрагмент відеофільму.
Перегляд фрагменту відеофільму
“Загальні властивості розчинів”.
Слайд 25
Викладач:
Як Ви бачили, на прикладі продемонстрованих у фільмі дослідів, процес розчинення речовин супроводжується одночасно фізичними (дифузією і перемішуванням частинок розчиненої речовини і розчинника) та хімічними (зміною кольору розчину, виділенням або поглинанням тепла) процесами.
Висновок:
Розчинення — це складний фізико-хімічний процес.
При фізичному явищі руйнується кристалічна ґратка і відбувається дифузія молекул розчиненої речовини.
При хімічному явищі в процесі розчинення молекули розчиненої речовини реагують з молекулами розчинника.
Питання №4. Способи вираження складу розчинів.
- Метод вивчення: пояснювально-ілюстративний, розв’язування вправ.
Викладач:
Слайд 26
Склад розчину кількісно визначається концентрацією: співвідношенням кількості розчиненої речовини і розчинника.
Існують різні способи вираження концентрації розчинів.
Найчастіше використовується масова частка розчиненої речовини (відсоткова концентрація), яка показує, скільки грамів розчиненої речовини міститься в 100г розчину і обчислюється за формулою:
С% = ![]() (%); звідки
(%); звідки
mречовини = ![]() , mрозчину =
, mрозчину = ![]()
Молярна концентрація (См) - показує, скільки молів розчиненої
речовини міститься в 1 л розчину і дорівнює відношенню кількості розчиненої речовини до об’єму розчину: См = ![]() , звідки
, звідки
mречовини = ![]() , а V =
, а V = ![]()
Молярна концентрація еквівалента (нормальна концентрація) СN показує, скільки моль-еквівалентів речовини міститься в 1 л розчину і визначається за формулою: СN = ![]() , [ моль-екв. /л ], звідки
, [ моль-екв. /л ], звідки
mречовини = СN Мекв V , (г) Vрозчину = ![]() , (л)
, (л)
Молярні маси еквівалентів визначають за формулою:
Mекв. речовини =![]() ,
,
де М - молярна маса речовини;
Е - n- валентність (для елементів);
- основність (для кислот);
- кислотність (для основ);
- заряд атома металу х кількість атомів металу (для солей)
4. Закріплення знань, формування вмінь, навичок, компетенцій.
- Метод вивчення: розв’язування задач.
Розв’язування розрахункових задач за алгоритмом
Викладач:
Задачі на розчини посідають особливе місце в курсі хімії. Їхнє значення неможливо переоцінити. Адже поняття розчинів використовують в курсі органічної, неорганічної та загальної хімії.
Характеристикою розчину є кількість речовини, яка міститься в певній масі або об’ємі розчину. Ця характеристика називається концентрацією. Концентрація може бути масовою (у частках або відсотках) або об’ємною (молярною чи нормальною).
За масами розчинника і розчиненої речовини можна визначити масу і концентрацію розчину.
За масою розчинника можна знайти масу розчину заданої концентрації і масу розчиненої речовини, яку потрібно розчинити в певній масі розчинника, щоб утворився розчин заданої концентрації.
За масою розчиненої речовини можна знайти масу розчину заданої концентрації і масу розчинника, в якому треба розчинити задану кількість речовини, щоб утворився розчин заданої концентрації.
За масою розчину заданої концентрації можна визначити маси розчинника і розчиненої речовини, потрібні для приготування певної маси розчину заданої концентрації.
Знаючи густину розчину, можна перерахувати масову концентрацію на молярну або нормальну і навпаки.
За таблицею розчинності можна знайти масу речовини, яка викристалізується при охолодженні певної маси насиченого при даній температурі розчину, і масу речовини, яку треба розчинити в насиченому при даній температурі розчині при нагріванні його до іншої температури, щоб утворився насичений при цій температурі розчин.
Слайд 27
Викладач:
Обчислення масової частки і маси речовини в розчині
Масова частка розчиненої речовини в розчині (ω (%) (р.р.)) – це відношення маси розчиненої речовини до загальної маси розчину.
Розчинник
![]()
![]()
![]()
![]()
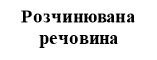

Слайд 28
Опорні формули:
ω (р.р.) = ![]() , якщо концентрація у частках від одиниці.
, якщо концентрація у частках від одиниці.
ω % (р.р.) = ![]() , якщо концентрація у відсотках.
, якщо концентрація у відсотках.
ω (%) (р.р.) – масова частка розчиненої речовини
m (р.р.) – маса розчиненої речовини
m (розчину) – маса розчину
m (розчину) = m (р.р.) + m (Н2О) чи іншого розчинника
Слайд 29
Якщо відомий об’єм розчину і його густина, то масу розчину знаходять за формулою
m (розчину) = V ∙ρ
Виходячи з вищезазначеного, формула набуває вигляду:
ω(%) (р.р.) = ![]()
Слайд 30
Приклад
Обчислити масову частку цукру в розчині, приготовленому при розчиненні 20 г цукру в 180 г води.
![]()
|
Дано: |
Розв’язання: |
|
m (р.р.)=20 г
ω(%) (р.р.) - ? |
1. Записуємо формулу для обчислення масової частки
ω (%) (р.р.)= 2. Підставляємо значення:
ω (%) (р.р.)= |
|
|
|
|
Відповідь: масова частка цукру 10% |
|
Слайд 31
- Робота з опорним робочим конспектом.
Задача 1. З метою запобігання потемнінню картоплю сульфітують: протягом 5 хв. оброблять водним розчином бісульфіту натрію концентрацією 0,5-1 % .
Яку масу бісульфату натрію (NaНSO3) необхідно взяти для приготування 500 г 0,5 % розчину?
![]() Дано: Розв’язування:
Дано: Розв’язування:
mрозчину = 500 г Використовуємо формулу:
С =0,5 % С% = ![]()
![]() mNaHSO3=? 0,5% =
mNaHSO3=? 0,5% = ![]()
m NaHSO3 =![]()
Відповідь: необхідно взяти 2,5 г бісульфату натрію.
Задача 2. Для дезінфекції обладнання, інвентарю кондитерського цеху, прибирального інвентарю використовують 2% розчин хлорного вапна.
Визначте молярну концентрацію розчину хлорного вапна (Са(СlO)Cl), якщо в 10 л розчину міститься 200 г Са(СlO)Cl?
![]() Дано: Розв’язування:
Дано: Розв’язування:
m Са(СlO)Cl -200г
V =10 л Використовуємо формулу:
![]() См =? См =
См =? См = ![]()
М(Са(СlO)Cl) = 40+ 35,5 + 16 + 35,5 = 127 г/моль
См = ![]()
Відповідь: молярна концентрація розчину хлорного вапна 0,16 моль/л.
Задача 3. Для визначення кислотності хліба методом кислотно-основного титрування використовують робочий розчин натрій гідроксиду. Скільки грамів натрій гідроксиду (NаОН) потрібно взяти для приготування 250 мл 1 н розчину.
![]()
Дано: Розв’язування:
Сн = 1н
V =250 мл=0,25 л Використовуємо формулу:
![]() m(NaОН) =? Сн =
m(NaОН) =? Сн = ![]() , звідки
, звідки
mречовини = m(NaОН) = ![]() ,
,
Мекв (NaОН) =![]()
m(NaОН) = ![]() .
.
Відповідь: потрібно взяти 10 г натрій гідроксиду.
Задача 4 (з коментуванням). Для засолу огірків використовують 7% водний розчин кухонної солі (хлориду натрію NaCl). Саме такий розчин в достатній мірі подавляє життєдіяльність хвороботворних мікроорганізмів та пліснявого грибка, и в той же час не перешкоджає процесам молочнокислого бродіння.
Розрахуйте масу солі і води для виготовлення 1 кг такого розчину?
![]() Дано: Розв’язування:
Дано: Розв’язування:
mрозчину = 1 кг (1000 г)
СNaCl =7 % Використовуємо формулу:
![]() mNaCl=? С% =
mNaCl=? С% = ![]()
mводи=? 7% = ![]() , звідки
, звідки
mречовини = ![]()
mрозчинника = mрозчину - mречовини = 1000г – 70 г = 930г
Відповідь: потрібно взяти 930 г води та 70 г натрій хлориду.
Слайд 32
5. Підсумки заняття. Аналіз роботи студентів на занятті (самооцінювання).
- Форма роботи: 5-ти бальна оцінка роботи студентів на занятті.
Слайд 33
6. Рефлексія.
Викладач.
- На занятті ми навчилися…
- Хотілось би дізнатись докладніше про …
- У житті використаю …
- У професійній діяльності використаю …
Слайд 34
7. Повідомлення домашнього завдання.
1. Робота з питаннями, які виносяться на самостійне опрацювання.
Питання, що виносяться на самостійне вивчення.
- Розчини в природі. Вимоги Конституції України до охорони природи.
- Класифікація розчинів.
2. Опрацювати тестові завдання з опорного конспекту до заняття.
“Перевірте свої знання”.
3. Індивідуальне завдання:
В.1 Задача №13 опорного конспекту;
В.2 Задача №14 опорного конспекту;
В.3. Задача №15 опорного конспекту.
4. Підготуватися до практичної роботи.
5. Творче завдання:
Підготувати презентацію на тему “Розчини у нашому житті”
Слайд 35
Викладач. ДЯКУЮ ВСІМ ЗА УВАГУ.
ЛІТЕРАТУРА:
1. М.М.Петров, Л.А. Михилев, Ю.Н. Кукушкин ”Неорганическая химия”,
с.128-145.
2. Г.П. Хомченко “Посібник з хімії для вступників до вузів” - К.: А.С.К.:
2005.– с. 131-134.
3. Конституція України.
4. Фізична і колоїдна хімія, - Методичні вказівки. Вінниця, ВДАІ с.42.
5. Білявський Г.О. Фурдій Р.С.,- Основи екологічних знань, К.Либідь, 1997
с.90-94, 119-124.
6. Комплекс самостійного вивчення з навчальної дисципліни:
“Неорганічна хімія”.
1


про публікацію авторської розробки
Додати розробку
