Розробка уроку «Кількість речовини. Розрахунки за хімічними формулами».
Тема: Узагальнення і систематизація знань з теми:
«Кількість речовини. Розрахунки за хімічними формулами».
Мета: Узагальнити та систематизувати знання про кількість речовини, молярну масу, молярний об’єм, відносну густину газів.
Закріпити вміння та навички обчислень за хімічними формулами; розв’язування задач.
Виховувати відчуття взаємоповаги і єдності, творчій підхід до навчання, культуру колективної праці.
Тип уроку: узагальнення і систематизація знань, умінь та навичок. Урок-подорож.
Форми роботи: фронтальна бесіда, робота в парах, індивідуальна робота, робота з картками, робота в зошитах, робота з підручником.
Обладнання: Періодична система хімічних елементів Д.І.Менделєєва, картки з завданнями, картки з формулами, портрет видатного хіміка А.Авогадро, ІКТ презентація.
Хід уроку
- Організаційний момент.
Психологічний настрій учнів.
У- уважні,
Р- розумні,
О-організовані,
К-кмітливі.
ІІ. Повідомлення теми уроку, мету формулюють учні.
Тема нашого уроку «Узагальнити та систематизувати знання про кількість речовини, молярну масу, молярний об’єм, відносну густину газів».
Які завдання поставимо перед собою на сьогоднішній урок? Так, безперечно, головним нашим завданням буде «Узагальнити та систематизувати знання про кількість речовини, молярну масу, молярний об’єм, відносну густину газів» та розв’язувати задачі.
ІІІ. Узагальнення й систематизація знань, умінь і навичок учнів.
Зупинка 1. Кількість речовини
- Виступ учнів.
(повідомлення про Амедео Авогадро).
1. Як позначається кількість речовини.
- В яких одиницях вимірюється кількість речовини.
- Чи є прилади для вимірювання кількості речовини.
- За якими формулами обчислюється кількість речовини.
- Алгоритм обчислення задач за відомою кількістю, масою, об’ємом, густиною.
- Яка схема скороченого запису умови задачі.
АЛГОРИТМРОЗВ’ЯЗУВАННЯ ЗАДАЧ
за хімічними формулами
1. Прочитати текст задачі.
2. Записати скорочено умову задачі.
3. Записати формули для обчислення.
4. Обчислити за формулами.
5. Записати відповідь.
Схема скороченого запису умови задачі
|
Дано: |
Розв’язання |
||
|
Відомо |
|
|
|
|
|
|
|
|
|
Знайти ? |
|
|
|
|
|
Відповідь: |
||
3. Прийом «Взаємоперевірка». Відповіді записуються на дошці.
- Розповідь вчителя.
Кількість речовини
Стала Авогадро настільки велика, що складно й уявити. Ось деякі приклади, що показують велич цього числа.
У пустелі Сахара міститься менше, ніж 3 моль найдрібншіих піщинок.
Якщо об’єм футбольного м’яча збільшити в NA разів, то в ньому поміститься земна куля. Якщо в NA разів збільшити діаметр м’яча, то в ньому поміститься найбільша галактика, що має сотні мільярдів зірок.
Під час кожного вдиху людини до її легенів потрапляє кілька молекул кисню та азоту, які були в останньому видиху Юлія Цезаря.
Якщо взяти 1 моль доларових папірців, вони вкриють усі материки Землі щільним шаром завтовшки 2 км.
- Розв’язування задач.
- (усно).
|
Назва речовини |
Кількість речовини |
Кількість молекул (атомів) |
|
Кисень О2 |
2 моль |
|
|
Гелій Не |
1 моль |
|
|
Магній Мg |
4 моль |
|
- Розв’язування задач (біля дошки). Робота в парах.
Робота в зошитах.

Задача 2

Зупинка 2. Молярна маса
- Прийом «Лови помилку».
(Обрати правильно записану формулу та визначення ).
- Молярна маса – хімічна величина.
- Молярна маса – показує масу 1 моль речовини.
- Молярна маса позначається буквою Р.
- Молярна маса вимірюється в кг.
- Молярна маса чисельно дорівнює відносній молекулярній масі та атомній масі.
Вибрати правильну формулу.
-
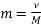 ;
; 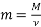 ;
; 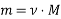
2. Розв’язування задач з наступним обговоренням результату.
(пояснення вчителя).
- Обчисліть кількість атомів Оксигену в молекулярному кисні масою 64 г.
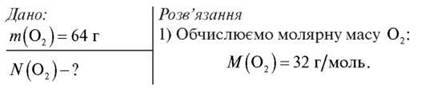
2) За формулою n = m/Мm обчислюємо кількість речовини O2:
![]()
3) 3 формули n = N/NA випливає: N = n · NA.
Обчислюємо число молекул O2:
N(O2) = 2 моль · 6,02 · 1023 молекул/моль = 12,04 · 1023 молекул.
4) Оскільки молекула O2 складається з двох атомів Оксигену, то
N(O2) = 2 · N(O) = 2 · 12,04 · 1023 = 24,08 · 1023 (атомів).
Відповідь: 24,08 · 1023 атомів.
3. Робота з підручником.
(Задача 2 на ст. 88)
Зупинка 3. Молярний об’єм
1. Питання –відповідь.
- сформулювати закон Авогадро про молярний об’єм;
- як позначається і чому дорівнює молярний об’єм за нормальних умов;
- записати формули для визначення молярного об’єму;
- Виступ учнів
- Менделєєв - один з батьків повітряплавання;
- Чому злітають кулі.
- Розв’язування задач.
- Пояснення вчителя;
- Практика на прикладах.
Обчисліть, який об’єм займе кисень за нормальних умов кількістю речовини 0, 5 моль.
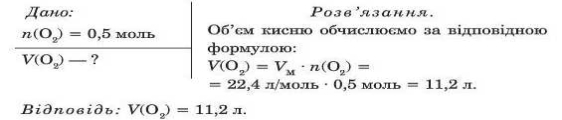
4. Знайти відповідності
1. Mr (SO2) А. 64 г.
2. m (SO2) Б. 64 л
3. V (SO2) В. 64 г/моль.
4. Vm Г. 64
5. M (SO2) Д. 22,4 л/моль
Зупинка 4. Відносна густина газів
- Продовж речення
- відносні густину газів позначають ........;
- відносні густина газів це відношення......;
- відносна густина за воднем....;
- відносна густина за киснем.....;
- відносна густина за повітрям......
- Виступ учнів
- «Двері в пекло»;
- Болотняний газ;
- Магія хімії. «Собача печера».
- Індивідуальне розв’язування задач з наступним обговоренням результату.

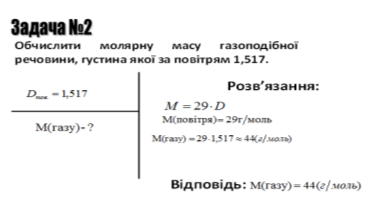
Задача 3.
Обчисліть відносну густину карбон (ІV) оксиду за воднем та повітрям.

ІV. Підсумок уроку. Рефлексія.
1. Заповни таблицю.
|
Фізична величина |
Позначення |
Формули |
Одиниці вимірювання |
|
|
М |
|
|
|
Кількість речовини |
|
|
|
|
|
Vm |
|
|
|
|
|
|
|
V. Домашнє завдання.
Повторити формули для розв’язання задач.
Я спробував
У мене вийшло
Мене здивувало
Мені захотілося
Було цікаво
Було важко
Я виконував завдання
Я зрозумів, що тепер я зможу
Я відчув, що Я навчився
Я зміг
Я спробував
У мене вийшло
Мене здивувало
Мені захотілося


про публікацію авторської розробки
Додати розробку
