Розробка уроку на тему: "Бензен, як представник ароматичних вуглеводнів.."
Метою уроку є ознайомити учнів з бензеном як представником гомологічного ряду – аренів, особливостями утворення ароматичного хімічного зв'язку; формувати уявлення про взаємний вплив атомів у молекулі бензену; розвивати вміння складати структурні формули на прикладі гомологів бензену, ізомерії гомологів бензену; розширити знання про систематичну номенклатуру на прикладі гомологів та ізомерів ароматичного ряду; ознайомити з фізичними та хімічними властивостями бензену та його гомологів.
Тема уроку: Бензен, як представник ароматичних вуглеводнів.
Мета уроку: ознайомити учнів з бензеном як представником гомологічного ряду – аренів, особливостями утворення ароматичного хімічного зв’язку; формувати уявлення про взаємний вплив атомів у молекулі бензену; розвивати вміння складати структурні формули на прикладі гомологів бензену, ізомерії гомологів бензену; розширити знання про систематичну номенклатуру на прикладі гомологів та ізомерів ароматичного ряду; ознайомити з фізичними та хімічними властивостями бензену та його гомологів.
Тип уроку: вивчення нового матеріалу.
Хід уроку
I Організація класу
II Перевірка домашнього завдання.
ІІІ Актуалізація опорних знань.
IV Мотивація навчальної діяльності
V. Вивчення нового матеріалу
Арени – це органічні сполуки, молекули яких мають 6-членне циклічне угруповання атомів Карбону, котре називають бензеновим ядром, або бензеновим кільцем.
Інша назва – ароматичні вуглеводні. Прямого відношення до запахів (ароматів) цей термін не має. У давні часи пахучі (ароматні) речовини отримували із природних джерел. Наприклад, ванілін – основна діюча речовина ванілі – є похідною бензойної кислоти, з якої Е. Мітчерліх отримав бензен. Не всі пахучі речовини є ароматичними, так само не всі ароматичні сполуки мають приємний аромат і навіть будь-який запах взагалі. Перші представники гомологічного ряду ароматичних вуглеводнів мають дійсно приємний запах, однак сьогодні відома значна кількість сполук цієї групи, які мають неприємний запах. Отже, цей термін – це швидше данина історії.
Арени або ароматичні вуглеводні – це сполуки, молекули яких містять стійкі циклічні групи атомів (бензенові ядра) з особливим характером хімічних зв'язків.
Загальна формула ароматичних вуглеводнів — CnH2n-6.
Вивчаючи конденсовані залишки світильного газу, який одержували з кам’яного вугілля, М. Фарадей у 1825 р. виділив вуглеводень з температурою кипіння 80 °С і визначив співвідношення Карбону й Гідрогену в ньому як 1:1. У 1834 р. Е. Мітчерліх шляхом нагрівання солей бензойної кислоти одержав подібний вуглеводень і дав йому назву бензин. Згодом Ю. Лібіх запропонував називати цю речовину бензеном.
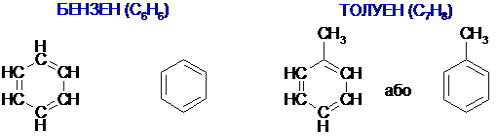
Молекулярна формула бензену — C6H6.
Бензен мав своєрідний запах і виявляв дивні хімічні властивості. Незважаючи на свою «ненасиченість», бензен важко вступав у реакції приєднання, але легко давав реакції заміщення атомів Гідрогену. Тому бензен та його похідні виокремили в спеціальний клас, який назвали «ароматичні вуглеводні», або «арени».
Поширена структурна формула бензену, запропонована в 1865 р. німецьким ученим А. Кекулє, являє собою цикл із подвійними й одинарними зв’язками між атомами Карбону, що чергуються:
Прості представники (одноядерні арени):
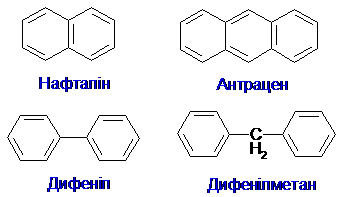
Багатоядерні арени: нафталін С10Н8, антрацен С14Н10 і ін.
Ароматична молекула означає її підвищену стійкість, обумовлену делокалізацією p-електронів в циклічній системі.
Критерії ароматичності аренів:
1. Атоми Карбону в sp2-гібридизованому стані утворюють циклічну систему.
2. Атоми Карбону розташовуються в одній площині (цикл має плоску будову).
3. Замкнута система зв'язаних зв'язків містить
Номенклатура аренів
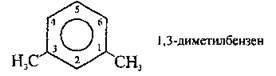
Нумерація відбувається за годинниковою стрілкою. Для нумерації атомів Карбону в бензеновому ядрі дотримуються правил:
- для гомологів бензену, які містять два однакові замісники, послідовність нумерації атомів Карбону вибирають таким чином, щоб локанти були найменшими:
-
якщо замісники різні, використовують алфавітний порядок:
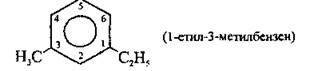
- У дизаміщених гомологах бензину для утворення тривіальних назв використовують префікси, які виділяють курсивом і відокремлюють дефісом:
|
Локанти замісників |
Префікси |
|
1,2 |
Орто – (о-) |
|
1,3 |
Мета – (м-) |
|
1,4 |
Пара – (п-) |
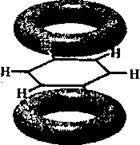
Особливості будови молекули бензену
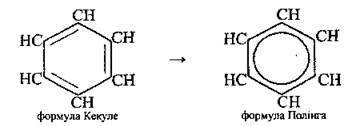
Молекула бензену – шість атомів Карбону (секстет) і шість атомів Гідрогену розміщені в одній площині й утворюють правильний шестикутник з кутом 120°. Незважаючи на ненасиченість зв’язків (бензен можна розглядати як циклогексатриен), така структура виявляє аномально високу стабільність (приблизно як і в циклогексану). Цю властивість називають ароматичністю1. Як уже вказувалось, термодинамічна стійкість бензенового ядра пояснюється спряженням і делокалізацією всіх шести π-електронів:
Тому зараз у хімічній літературі частіше користуються не формулою Ф. Кекуле2, а формулою Л. Полінга:
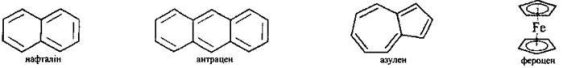
Крім бензену, його гомологів і похідних, ароматичні кільця мають інші карбоциклічні сполуки: т. зв. конденсовані аналоги бензену (нафталін, антрацен), а також азулен, фероцен – одна з найвідоміших металоорганічних сполук:
Ароматичними є також гетероциклічні сполуки – пірол, піридин, фуран, тіофен, індол, пурин3 (їхні гомологи і похідні) та багато інших речовин:
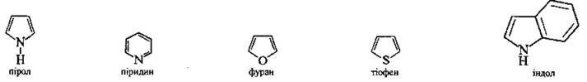
Гетероциклічними називають сполуки циклічної будови, у цикли молекул яких, окрім атомів Карбону, входять атоми інших елементів. Ці атоми називають гетероатомами.
Властивості бензену
За стандартних умов бензен – безбарвна речовина з характерним запахом, у воді не розчиняється, сама є добрим розчинником, токсична.
Ароматичний зв’язок визначає хімічні властивості бензену та інших аренів. Бензенове ядро стабілізується 6π-електронною системою, яка є стійкішою, ніж звичайний π-зв’язок. Тому реакції приєднання менш характерні, ніж для ненасичених вуглеводнів.
|
Приєднання (відбувається важче, ніж у ненасичених вуглеводнів) |
||
|
|
Гідрування (гідрогенізація) |
|
|
|
Галогенування (Сl2, Вr2) |
|
|
Заміщення (найхарактерніші реакції, які відбуваються легше, ніж у насичених вуглеводнів) |
|
|
|
|
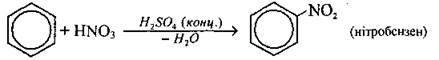
Нітрування |
|
|
|
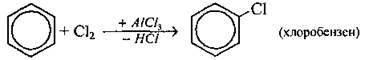
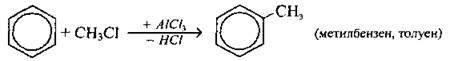
Галогенування |
|
|
|
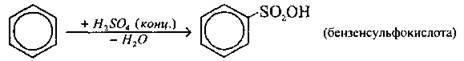
Сульфування |
|
|
|
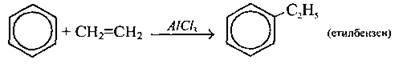
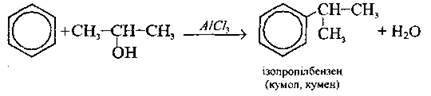
Алкілування алкенами |
|
|
|
Алкілування галогеноалканами |
|
|
|
Алкілування спиртами |
|
|
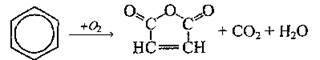
Окиснення |
||
|
Повне |
|
Бензен стійкий до окиснювачів, на повітрі горить, виділяючи кіптяву; у кисні згоряє повністю |
|
Часткове |
|
За наявності каталізатора V2O5 та t = 450°С окислюється до малеїнового ангідриду |
Орієнтувальна дія замісників, наявних у молекулі бензину
|
Замісники І роду (електронодонорні) (орто – та параорієнтанти) |
Замісники II роду (елекгроноакцепторні) (метаорієнтанти) |
|
|
|
Добування бензену
Бензен і його гомологи можуть міститись у нафті, а також серед продуктів коксування кам’яного вугілля: коксовий газ містить пари бензену і толуену, а кам’яновугільна смола – бензен, толуен, ксилени і феноли. Бензен (толуен і ксилоли) отримують каталітичним риформінгом і піролізом бензинових фракцій нафти. Гомологи бензену одержують також каталітичним крекінгом нафтопродуктів.
1. Дегідрування циклоалаканів над підігрітою платиною:
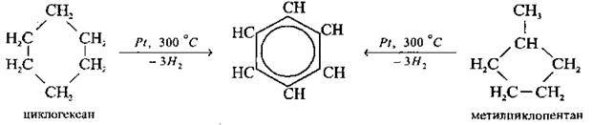
2. Дегідроциклізація алканів над оксидними каталізаторами:
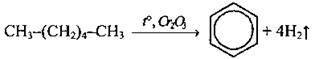
3. Циклічна тримеризація ацетилену:
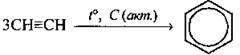
Застосування бензену
Бензен входить до десяти найважливіших сполук органічної хімії. Значну частину бензену використовують в органічному синтезі:
– етилбензену (компонента високооктанових бензинів, вихідної речовини у виробництві старену, каучуків);
– кумолу (проміжного продукту у виробництві фенолу, ацетону та інших сполук);
– циклогексану (сировини для отримання капролактаму, адипінової кислоти і циклогексанону; розчинника ефірних олій, лаків, фарб, екстрагента у фармацевтичній промисловості);
– нітробензену (розчинника, окиснювача, продукту для виробництва аніліну та інших сполук);
– барвників, лікарських препаратів, розчинників, отрутохімікатів (пестицидів).
Значну частину (іноді до 50%) бензинів становлять ароматичні сполуки, зокрема бензен, Стратегічним завданням є зменшення вмісту бензену (до 1 %) через його високу канцерогенність (при хронічних отруєннях).
Фізичні властивості бензену та його гомологів
Бензен — безбарвна рідина із запахом, Тпл = 5,5 °С, Ткип = 80 °С, не розчиняється у воді, є чудовим неполярним розчинником.
Його найближчі гомологи — безбарвні рідини зі специфічним запахом. Ароматичні вуглеводні легші від води й у ній не розчиняються, однак добре розчиняються в органічних розчинниках — спирті, ефірі, ацетоні.
Фізичні властивості деяких аренів наведено в таблиці.
|
Назва |
Формула |
t°пл, °С |
t°кип, °С |
d420 |
|
Бензен |
C6H6 |
+5,5 |
80,1 |
0,8790 |
|
Толуен (метилбензен) |
С6H5СН3 |
-95,0 |
110,6 |
0,8669 |
|
Етилбензен |
С6H5С2Н5 |
-95,0 |
136,2 |
0,8670 |
|
Ксилен (диметилбензен) |
С6H4(СН3)2 |
|
|
|
|
орто- |
-25,18 |
144,41 |
0,8802 |
|
|
мета- |
-47,87 |
139,10 |
0,8642 |
|
|
пара- |
13,26 |
138,35 |
0,8611 |
|
|
Пропілбензен |
С6H5(СН2)2CH3 |
-99,0 |
159,20 |
0,8610 |
|
Кумол (ізопропілбензен) |
С6H5CH(СН3)2 |
-96,0 |
152,39 |
0,8618 |
|
Стирол (вінілбензен) |
С6H5СН = CH2 |
-30,6 |
145,2 |
0,9060 |
VI. Підбиття підсумків уроку
1. Застосування бензену та його гомологів.
• Отрутохімікати.
• Розчинники.
• Вибухові речовини.
• Добавки до пального.
2. Складіть формули гомологів бензену складу C8H10 і назвіть їх.
3. Порівняйте будову й фізичні властивості етену, етину й бензену.
VII. Домашнє завдання


про публікацію авторської розробки
Додати розробку