Розробка уроку на тему: «Узагальнення знань про хімічні властивості основ»
Тема: «Узагальнення знань про хімічні властивості основ»
Навчально-освітня мета: узагальнити і відкоригувати вміння учнів складати формули основ, рівняння хімічних реакцій за участі лугів та нерозчинних основ; закріпити уявлення про виявлення лугів за допомогою індикаторів; продовжувати розвивати мовленнєві навички, уміння розв’язувати різні завдання, роботи висновки; створити умови для бажання активно навчатися.
Тип уроку: узагальнення та коригування знань.
Навчальне обладнання: періодична система хімічних елементів Д.І. Менделєєва, таблиця розчинності, штативи з пробірками.
Реактиви: набір індикаторів, розчини лугів.
Хід уроку
І. Організаційний момент.
Привітання.
ІІ. Актуалізація опорних знань.
1. Метод «Мікрофон».
Учні по черзі відповідають на запитання:
1. На які групи поділяються речовини?
2. На які класи поділяються складні речовини?
3. Як розрізняють класи сполук?
4. Що таке основи?
5. Які бувають основи?
6. Що таке луги?
7. Звідки можна дізнатися про розчинність основ у воді?
8. Від чого залежить кількість гідроксильних груп в основі?
9. Чому луги називають їдкими?
10. Що треба зробити, якщо луг потрапив на шкіру?
11. Що таке індикатори?
12. Як вони змінюють забарвлення в лужному середовищі?
13. Яку хімічну реакцію називають обміном?
14. З чим можуть взаємодіяти луги?
15. Які властивості характерні для нерозчинних основ?
16. Яка формула гідроксогрупи? Яка її валентність?
17. Як дати назву основам?
2. Вправа «Упізнай мене».
Учитель показує картку з формулами основ NaOH, Ca (OH)₂, Сu (OH)₂, Al (OH)₃, Fe (OH)₃, Mg (OH) ₂
Учні дають назву, класифікують основи, вказують валентність металу.
3. Вправа «Склади формулу».
Fe (II), Cu (I), Ba (II), Sr (II), Li (I)
Учні ланцюжком записують на дошці формули основ, дають назву за сучасною українською номенклатурою.
4. Вправа «Третій зайвий». (Формули записані на дошці).
У кожному стовпчику формул основ знайдіть зайву. Поясніть свій вибір.
NaOH
Cu (OH)₂
Ca (OH)₂
Cu (OH) ₂
Fe (OH) ₂
KOH
Ba (OH)₂
Mg (OH)₂
Li OH
5. Вправа «Хрестики-нулики»
Виграшний шлях складають формули нерозчинних основ, назвіть їх.
|
H₂ SO₄ |
Al₂O₃ |
Al (OH)₃ |
|
Mg (OH) ₂ |
Cr(OH)₂ |
NaOH |
|
Cu (OH) ₂ |
CO₂ |
P₂O₅ |
6. Взаємоперевірка.
Учні обмінюються зошитами, перевіряють 4 та 5 завдання.
ІІІ. Узагальнення та коригування знань.
Робота біля дошки. (Один учень виконує завдання на дошці, перевіряємо всі разом).
1. Складіть рівняння реакцій хімічних властивостей лугів і нерозчинних основ. «Оживіть схему».
а) луг + кислота →сіль + вода
NaOH + ? → NaCl + ?
б) луг + кислотний оксид → сіль + вода
? + ? → Na₂CO₃ + H₂O
в) луг + сіль (розчин) → нерозчинна основа + інша сіль
KOH + CuSO₄ → ? + ?
г) нерозчинна основа → оксид металевого елемента + H₂O
Cu (OH)₂ → ? + ?
2. Визначте луг за допомогою індикаторів і поясніть свої спостереження. Поясніть правила безпеки при роботі з лугами. Доповніть узагальнюючу схему.
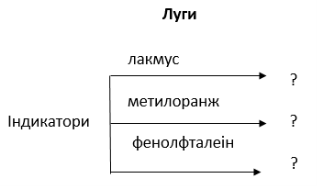
3. На дошці зображено схему. Складіть рівняння можливих реакцій та порахуйте суму всіх коефіцієнтів, які стоять в можливих хімічних реакціях перед формулами лугу.
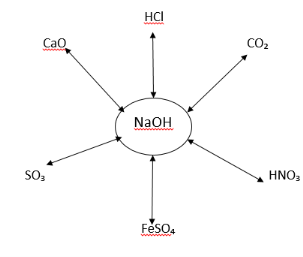
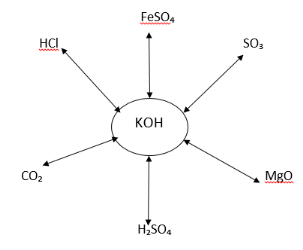
4. Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення речовин; запишіть цю схему в загальному вигляді.
а) K→K₂O→KOH→ K₂SO₄
б) Cu (OH)₂ → CuO →CuCl₂
(метал → основний оксид → основа → сіль
нерозчинна основа → основний оксид → сіль).
5. Розв’яжіть задачу з використанням рівнянь хімічних реакцій.
У реакцію з хлоридною кислотою вступив метал Al масою 20 г. Обчислити об’єм водню, що виділився (н.у.), масу солі, що утворилася, кількість речовини кислоти, що вступила в реакцію.
IV. Підбиття підсумків
- Висновки
- Оцінювання учнів
- Рефлексія «Вільний мікрофон». Закінчіть речення:
Я знаю…
Я вмію…
Сьогодні на уроці цікавим було…
V. Домашнє завдання
«Мобільне навчання»
За допомогою мобільних телефонів або планшетів знайдіть інформацію прикладів використання основ для покращення властивостей води та ґрунту.


про публікацію авторської розробки
Додати розробку
