Урок "Ковалентний зв’язок, його утворення. Полярний і неполярний ковалентний зв’язок"
Тема: Ковалентний зв’язок, його утворення. Полярний і неполярний ковалентний зв’язок
Мета:
навчальна: сформувати поняття ковалентного хімічного зв’язку та розглянути механізм утворення ковалентного зв’язку, його види, визначити особливості подвійного та потрійного зв’язку; формувати вміння складання електронно-крапкових формул та схем утворення хімічного зв’язку; формувати вміння застосовувати одержанні знання для визначення типу хімічного зв’язку за хімічною формулою речовини;
розвивальна: розвивати творчий підхід до роботи як засіб виховання стійкого інтересу до предмета; стимулювати активну пізнавальну діяльність; створити емоційний настрій і збудити інтерес до засвоєння нових знань, самостійного вирішення проблем; розвивати вміння працювати в парах (малих групах);
виховна: виховувати культуру поведінки та спілкування; виховувати дбайливе ставлення до обладнання та майна кабінету
Обладнання: періодична таблиця хімічних елементів Д.І.Менделєєва, картки із завданнями для роботи в парах, презентація засобами МS Роwег Роіnt, медіа-центр.
Базові поняття та терміни: хімічний зв’язок, ковалентний зв’язок, спільна електронна пара, спарені електрони, неспарені електрони, зовнішній енергетичний рівень, електронно-крапкові формули, структурні формули
Форми роботи: робота в парах – гра «Розсипані атоми», «Знайди помилку», урок з використанням інформаційно-комунікаційних технологій.
Тип уроку: вивчення нового матеріалу
Хід роботи
1.Організаційний етап
Привітання, налаштування на робочий лад
Інтерактивний прийом «До успіху»
Усміхніться один одному, подумки побажайте успіхів на цілий день.
Для того, щоб працювати на уроці гарно і виконати всі завдання будьте старанні та уважні.
2.Актуалізація опорних знань
Вправа «Знайди помилку» (Слайд 2)
1.Взаємодію між атомами, молекулами, йонами, завдяки якій частинки
утримуються разом називають мобільним зв’язком.
2.Хімічний зв’язок утворюється за рахунок дії сил приклеювання та відштовхування.
3.Нова молекула може утворитися, якщо при взаємодії атомів їхня енергія збільшується.
4.Атом складається з негативно зарядженого ядра та позитивно заряджених електронів
5.Електронегативність – це здатність атома притягувати до себе атоми та
молекули.
6.Метали мають вищу електронегативність ніж неметали.
7.Електронегативність елементів у періодах зменшується зліва направо
8. Бдагородні (Інертні) гази мають високу електронегативність
9. Атоми металів легко приєднують валентні електрони.
10. Електронегативність у групах знизу вгору зменшується.
Ключ: 1. Хімічний. 2. Кулонівських сил – притягання та відштовхування. 3. Зменшується. 4. Позитивно заряджене ядро та негативно заряджені електрони. 5. До себе е– (електронну густину). 6.Нижчу. 7. Збільшується. 8. Вони інертні. 9. Віддають 10. Зростає.
ІІІ. Мотивація навчальної діяльності
Історична довідка (Слайд 3)
У 1907 р. російський вчений Микола Олександрович Морозов, а в 1916 р. американський фізико-хімік Джилберт Льюїс висловили припущення, що хімічний зв’язок може утворюватись, якщо виникає спільна пара електронів, що одночасно належить двом атомам.
Слово вчителя: чи були вірними припущення вчених про те, що хімічний зв’язок обумовлений утворенням спільної електронної пари ми зараз і з’ясуємо.
ІV. Вивчення нового матеріалу
Існує кілька типів хімічного звꞌязку: ковалентний, йонний, металічний та інші. (Слайд 4)
- Утворення ковалентного зв’язку. Ковалентний неполярний зв’язок
І для початку пригадаємо електронну форму і графічну схему будови атома Н.
Учень на дошці записує електронну та графічну будови атома Гідрогену і робить висновок про його здатність утворювати хімічні зв’язки.
11 Н +1 )1 1S1
Розповідь вчителя: при утворенні хімічного зв’язку атоми прагнуть до того, щоб на їх зовнішньому енергетичному рівні було два або вісім електронів. Цього можна досягти декількома способами. Найпоширеніший з них полягає в об’єднанні неспарених електронів у спільні електронні пари. Приналежні одночасно обом атомам.
При зображенні утворення хімічного зв’язку прийнято позначати електрони зовнішнього енергетичного рівня крапкою або хрестиком:
Розглянемо, як же утворюється хімічний зв’язок в молекулі водню. (Слайд 5)
В утворенні молекули водню беруть участь два атоми Гідрогену, які намагаються добудувати свій зовнішній енергетичний рівень за рахунок іншого атома. Кожен атом намагатиметься притягнути на свою електронну оболонку додатковий електрон і таким чином отримати електронну конфігурацію найближчого інертного газу – Неону. Під час взаємного притягання ядер атомів та електронних оболонок дві s-орбіталі перекриваються і в місцях перекривання утворюється підвищена електронна густина.
Утворення молекули водню можна записати у вигляді схеми: Н• + •Н → Н : Н
такі формули наз. формулами Льюїса, або електронно-крапковими формулами
(Учні записують)
Таким чином, кожний атом Н віддає свій е– у спільне користування. При цьому утворюється спільна пара. Що одночасно належить рівною мірою обом атомам Н.
Хімічний зв’язок, що виникає в результаті утворення спільних електронних пар, наз. ковалентним. (Учні записують)
Спільну електронну пару, що обумовлює хімічний зв’язок, можна позначити рискою. Таким чином виходить структурна формула (Слайд 6).
У молекулі водню електронна густина хімічного зв’язку, як вже вище згадувалось, знаходиться на однаковій відстані від обох ядер і в однаковій мірі належить обом атомам.
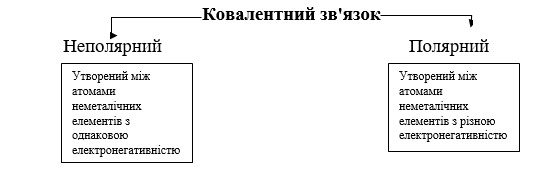
Хімічний зв’язок, в якому відсутнє зміщення спільних електронних пар в бік одного з атомів, наз. ковалентним неполярним. (Учні записують) (Слайд 7)
Характерний для атомів з однаковою електронегативністю, неметалічних елементів
Слово вчителя: Складемо схему утворення зв’язку молекули фтору (F2). (Слайд 8)
Утворення подвійного і потрійного зв’язку
При взаємодії атомів, кожний з яких має кілька неспарених електронів, утворюється кілька спільних електронних пар. Якщо утворюється 2 спільні електронні пари, то зв’язок подвійний, три – потрійний (Слайди 9.10)
Фізхвилинка(Слайд 11 )
2.Утворення зв’язку між різними атомами неметалів. Ковалентний полярний зв’язок
Ковалентний зв’язок також може утворюватися між атомами різних хімічних елементів. Розглянемо його на прикладі молекули гідроген флуориду.
У цій молекулі атом Гідрогену за рахунок неспареного електрона атома Хлору завершує перший енергетичний рівень, а атом Хлору за рахунок атома Гідрогену завершує другий енергетичний рівень. Таким чином, утворюється спільна електронна пара.
![]()
Оскільки атоми Гідрогену та Хлору володіють різною електронегативність, то їхня спільна електронна густина хімічного зв’язку буде зміщена в сторону більш електронегативного атома, тобто атома Хлору. Таким чином на атомі Хлору виникатиме частковий негативний заряд («-»), а на атомі Гідрогену частковий позитивний заряд (« +»), молекула стає полярною, виникає диполь. (Слайд 12 )
Хімічний зв’язок, в якому одна чи кілька спільних пар зміщені в бік одного з атомів, наз. ковалентним полярним зв’язком. (Учні записують)
Характерний для атомів з різною електронегативністю, неМе елементів (Слайд 13,14)
V. Закріплення нового матеріалу
Завдання 1. Який тип звꞌязку зображений на кожному із малюнків? Чому? (Слайд 15)
Слово вчителя: Таким чином, виділяють два типи ковалентного звязку – полярний і неполярний.
Учні разом з вчителем складають опорну схему (Слайд 14 )
Завдання 2. Виберіть і запишіть речовини з ковалентним полярним і неполярним звязком (Слайд 15)
Завдання 3. Гра «Розсипані атоми»:
На кожну парту роздаються картки з атомами зображеними з електронними формулами. Учні повинні скласти формули речовин таким чином, щоб не залишилось ні одного вільного атома. Результати записують в картки і здаються для перевірки. Декілька учнів (що першими виконали) озвучують відповідь перед всім класом.
VІ. Оцінювання роботи учнів
VIІ. Домашнє завдання (Слайд 16)
Опрацювати параграф 16
Завдання після параграфа. Скласти кросворд «Ковалентний зв’язок».

про публікацію авторської розробки
Додати розробку
