Розв'язування розрахункових задач
Розв’язування розрахункових задач
Мета уроку: удосконалювати вміння учнів записувати рівняння хімічних реакцій за генетичним рядком хімічних перетворень; повторити властивості спиртів і фенолів; вдосконалювати хімічну мову, знання номенклатури, термінології; зміцнити теоретичні знання під час виконання практичних завдань з хімії; розвивати вміння прогнозувати, порівнювати, узагальнювати; розвивати самостійне мислення учнів та поглибити інтерес до предмету; розвивати міжпредметні зв’язки; виховувати вміння працювати в колективі.
Тип уроку: застосування знань, умінь, навичок.
Обладнання. Картки із завданнями
Форми роботи: фронтальна робота, індивідуальна робота, групова робота, самостійна робота.
Девіз. Розум полягає не тільки в знанні, але й у
вмінні застосовувати знання на ділі.
Аристотель.
Хід уроку
І. Організація класу
Поділ учнів на три групи за навчальними здібностями
(1група – І і ІІ рівні, 2 група – ІІІ рівень, 3 група – ІV рівень).
ІІ. Актуалізація опорних знань
Хімічна розминка. Завдання «Так» чи «Ні»
- Спирти можуть бути органічного і неорганічного походження.
- Метанол найпростіший представник насичених одноатомних спиртів.
- Тривіальна назва водного розчину фенолу- карболова кислота.
- Характеристична група у спиртів та фенолу – одинакові.
- Спирти взаємодіють із лугами.
- Якісна реакція на фенол – це взаємодія з ферум (ІІІ) хлоридом.
- Гліцерол – отруйна речовина.
- Гліцерол –двохатомний спирт.
- Фенол не взаємодії з галогенами.
- Формула етанолу - С2Н5ОН.
- Метанол та етанол використовують у харчовій промисловості.
- Фенол небезпечний для живих організмів.
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
Н |
Т |
Т |
Т |
Н |
Т |
Н |
Н |
Н |
Т |
Н |
Т |
ІІІ. Мотивація навчальної діяльності та визначення мети, завдання уроку
ІV. Застосування набутих знань на практиці
Учні працюють в групах виконуючи завдання.
- Записати рівняння реакцій, що лежать в основі хімічного перетворення:
1 група. етен→ етанол→ вуглекислий газ
2 група. глюкоза → етанол→ етен→ вуглекислий газ
3 група. бензен→бромобензен →фенол→ 2,4,6-трибромофенол
2. Розв’язати задачу
![]() 1 група. Який об’єм повітря витратиться під час спалювання етанолу кількістю 5 моль?
1 група. Який об’єм повітря витратиться під час спалювання етанолу кількістю 5 моль?
Дано: 5моль хл
ν(С2Н5ОН) = 5моль С2Н5ОН + 3О2 → 2СО2 + 3H2O
![]() 1моль 3∙22,4л
1моль 3∙22,4л
V(пов.) - ? 1) V(О2) : х = 5∙3∙22,4 = 336л
2)V(пов.) =336/0,21= 1600л.
Відповідь: 1600л.
![]() 2 група. Який об’єм водню виділиться при взаємодії 320 г метанолу з 280 г натрію?
2 група. Який об’єм водню виділиться при взаємодії 320 г метанолу з 280 г натрію?
Дано: 320г 280г хл
m(СН3ОН) = 320г 2СН3ОН + 2Na → 2СН3ОNa + Н2
m(Na)= 280г 2∙32г 2∙23г 22,4л
-
 ν(СН3ОН) : ν (Na) = 2,5 : 3 Na дано з надлишком
ν(СН3ОН) : ν (Na) = 2,5 : 3 Na дано з надлишком
V(Н2) - ? 2) V(Н2) : х= 56л
Відповідь: 56л.
![]() 3 група. З 56,25 кг технічного хлоробензену, масова частка домішок в якому становить 20% , гідролізом добули 22,56 кг фенолу. Знайдіть практичний вихід фенолу.
3 група. З 56,25 кг технічного хлоробензену, масова частка домішок в якому становить 20% , гідролізом добули 22,56 кг фенолу. Знайдіть практичний вихід фенолу.
Дано: m(C6H5Cl)=56,25 кг
ω(дом.)=20% C6H5Cl +Н2О → C6H5OH + НCl
m пр.(C6H5OH)=22,56 кг
![]() Знайти:
Знайти:
η(C6H5OH) - ?
ω(C6H5Cl)=100%-ω(дом.)=100%-20%=80%
ω(C6H5Cl)=56,25кг·0,8=45кг
ν(C6H5Cl)=m/M=45кг/112,5кг/моль=0,4моль
M(C6H5Cl)=6·12+5+35,5=112,5г/моль
За р.р. ν(C6H5Cl)=ν(C6H5OH)
ν(C6H5ОН)=0,4моль
M(C6H5OH)=12·6+5+16+1=94г/моль
m(C6H5OH)=0,4моль·94кг/моль=37,6г
η(в)=mпр./m(теор.)·100%
η(C6H5OH)=22,56 кг/37,6кг·100%
Відповідь. η(C6H5OH)=60%
Якщо залишається час можна запропонувати ще одну задачу.
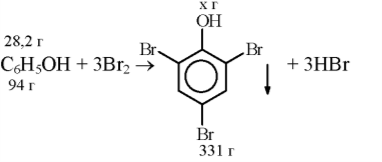
Під час бромування фенолу масою 28,2 г отримали осад масою 79,44 г . Обчисліть вихід продукту реакції від теоретично можливого . Відповідь: 80%
![]()
V. Підсумок уроку
Виставлення оцінок.
VІ. Домашнє завдання
Повторити §§13-15
- Скласти кросворд з ключовими словами «Спирти» або «Фенол» (І рівень).
- Розв’язати задачу(ІІІ- ІV рівні). Калій фенолят отримали взаємодією фенолу масою 4,7 г і з розчином масою 120 г з масовою часткою КОН 14%. Яка маса калій феноляту? Відповідь: 6,6 г
- Для допитливих учнів . Знайти відповідь на питання. «Що таке мелініт або «гіркий мед» ? Які він ще має синоніми?»
(Відповідь. "Шимозе", пікринова кислота, або тринітрофенол- барвник і вибухова речовина).
Завдання для груп
1 група.
- Записати рівняння реакцій, що лежать в основі хімічного перетворення :
етен→ етанол→ етанова кислота
2. Задача. Який об’єм повітря витратиться під час спалювання етанолу кількістю 5 моль?
2 група.
- Записати рівняння реакцій, що лежать в основі хімічного перетворення:
глюкоза → етанол→ етен→ вуглекислий газ
![]() 2. Задача. Який об’єм водню виділиться при взаємодії 320 г метанолу з 280 г натрію?
2. Задача. Який об’єм водню виділиться при взаємодії 320 г метанолу з 280 г натрію?
3 група
1. Записати рівняння реакцій, що лежать в основі хімічного перетворення: бензен→бромобензен →фенол→ 2,4,6-трибромофенол
- Задача. З 56,25 кг технічного хлоробензену, масова частка домішок в якому становить 20% , гідролізом добули 22,56 кг фенолу. Знайдіть практичний вихід фенолу.
-
Дякую!


про публікацію авторської розробки
Додати розробку
