Розв´язування розрахункових задач на обчислення масової частки розчиненої речовини.
Клас 9 Дата
Урок №8
Тема: Розв´язування розрахункових задач на обчислення масової частки розчиненої речовини.
Мета: формування предметних компетентностей закріпити вміння обчислювати масову частку розчиненої речовини, сформувати вміння розв´язувати задачі на розбавлення розчинів, змішування розчинів, а також задачі з використанням масової частки розчиненої речовини при розв´язуванні задач за рівняннями реакцій; розвивати вміння аналізувати, уявляти хімічні процеси, що відбуваються при змішуванні розчинів; вчити застосовувати графічні способи розв´язування задач.
Обладнання: опорні схеми, періодична система елементів Д.І.Менделеєва, картки з завданнями для групової роботи.
Тип уроку: урок застосування знань і розвитку умінь.
Методи: бесіда, робота в групах, парах, тестування.
Хід уроку
І. Організація класу.
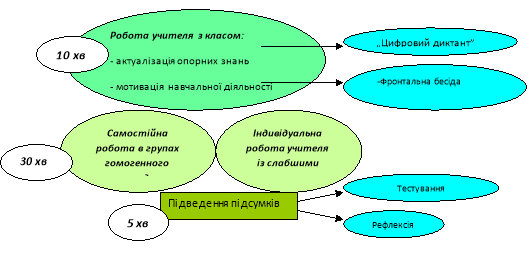
ІІ. Актуалізація опорних знань.
Цифровий хімічний диктант. Так -1, Ні - 0
Правильне кодове дванадцятизначне число після хімічного диктанту пишуть на дошці. Число правильних відповідей = оцінка.
хімічний диктант:
- Емульсії та суспензії – неоднорідні суміші.(Так)
- Колоїдні системи відносяться до грубодисперсних систем. (Ні)
- Суміш крейди з водою – суспензія. (Так)
- Розчин складається із молекул розчинника та розчиненої речовини . (Ні)
- У розчині, який складається із 70 г спирту та 30 г води, розчинником буде вода. (Ні)
- Щоб перевести насичений розчин у ненасичений, треба випарити частину розчину. (Ні)
- Щоб перевести концентрований розчин у розбавлений, треба додати розчинника. (Так)
- Кальцій карбонат – нерозчинна речовина.(Так)
- Насичений розчин завжди буде концентрованим. (Ні)
10)Розчинність кристалічного мідного купоросу зростає із підвищенням
температури. (Так)
11)Розчинність вуглекислого газу збільшується при пониженні температури і
підвищенні тиску. (Так)
12) Речовини з йонним зв”язком краще розчиняються в полярних
розчинниках.(Так)
Кодове число відповідей: 101000110111.
ІІІ. Мотивація навчальної діяльності.
Пригадайте, за якою формулою ми обчислювали масову частку розчиненої речовини; об´єм розчину. (Учні пишуть формули на дошці)
Мета сьогоднішнього уроку :
- Закріпити вміння розв´язувати задачі на масову частку розчиненої речовини;
- навчитися розв´язувати задачі на розведення розчинів;
- навчитися розв´язувати задачі на змішування розчинів з використанням правила „хреста”;
- застосувати набуті вміння при розв´язуванні задач за рівняннями реакцій.
ІV. Застосування знань, формування нових умінь
1. Розв´язування задач на розведення та змішування розчинів.
Задача.
До 750 г 25%-ого розчину солі долили 250 г води. Знайти масову частку солі у розчині після розбавлення.
Намалюємо малюнок згідно умови задачі.
![]()
![]()
 250 г Н2О
250 г Н2О
![]()
![]()
750 г р-ну 750г+250г=1000г
W2 - ?
- Чи змінилася маса розчиненої речовини в розчині після розбавлення?
- Ні.
- А чи можемо знайти масу розчиненої речовини?
- Так. Для цього масу розчину помножимо на масову частку.
- А що змінилося після розбавлення?
- Маса розчину збільшилася.
- Тепер можемо знайти масову частку р.р. після розбавлення .
Ось ми й склали план розв´язування задачі .
![]() Дано: т1(р-ну)=750 г 1) Яка маса солі у вихідному розчині?
Дано: т1(р-ну)=750 г 1) Яка маса солі у вихідному розчині?
W1 (солі)=25% т(солі)= W(солі)·т(р-ну)
т (Н2О) = 250 г т(солі)=0,25·750 г = 187,5 г
![]() 2) Яка маса нового розчину?
2) Яка маса нового розчину?
Знайти: W2(солі) т(р-ну)= 750 г +250 г = 1000 г.
3) Яка масова частка солі в новому розчині?
W2(солі) = ![]() або 18,5%
або 18,5%![]()
![]() або 22,5%
або 22,5%
Відповідь: 22,5%
- Розв”язування задач за правилом „хреста”.
При розв”язуванні задач на отримання розчину із заданою масовою часткою розчиненої речовини шляхом змішування двох розчинів з відомою масовою часткою (%)користуються правилом „хреста”. Суть цього методу полягає в тому, що спочатку записується значення масової частки розчину, який потрібно приготувати, зліва вгорі від нього – більше значення масової частки вихідного розчину, зліва внизу – менше значення масової частки другого вихідного розчину. Потім в напрямку діагоналей знаходять різниці цих чисел. Отримані числа показують, у якому співвідношенні потрібно змішувати вихідні розчини.
![]()
![]()
![]() W1 W3 - W2 m1
W1 W3 - W2 m1
![]()
![]() W3
W3
W2 W1 - W3 m2
Задача.
Обчислити маси розчинів з масовими частками калій гідроксиду 10% та 50%, необхідні для приготування 800 г розчину з масовою часткою калій гідроксиду 25%.
![]() Дано: W1 (КОН)=10% 1. Які масові співвідношення вихідних розчинів?
Дано: W1 (КОН)=10% 1. Які масові співвідношення вихідних розчинів?
W2 (КОН)=50%
т3(р-ну )=800г 50 15 – 3 в.ч.
W3 (КОН)=25%
![]()
![]()
![]()
![]() 25
25
Знайти: т1(р-ну КОН)
![]() т2(р-ну КОН) 10 25 – 5 в.ч.
т2(р-ну КОН) 10 25 – 5 в.ч.
2. Із скількох вагових частин складається маса 25%-
ого розчину?
3 +5 = 8 (в.ч.)
3. Яка маса припадає на 1 в.ч.?
800 г : 8 =100 г
4. Які маси вихідних розчинів?
т1(р-ну КОН)= 5 · 100 г = 500 г
т2(р-ну КОН)= 3 · 100 г = 300 г
Відповідь: 500 г; 300 г.
ІV. Удосконалення умінь розв´язувати задачі.
Формуються групи гомогенного складу, які одержують диференційовані завдання. Група найсильніших учнів – варіант А, група учнів з достатнім рівнем знань – варіант В. з середнім рівнем – варіант С.
Учні розв’язують задачі на обчислення масової частки розчиненої речовини, допомагаючи один одному і разом вирішуючи спірні питання . В разі необхідності допомогу групам надає учитель.
Варіант А
- Яку масу мідного купоросу (купрум(ІІ) сульфату пентагідрату) можна
добути із 300 г розчину купрум(ІІ) сульфату з масовою часткою солі
20%?
- Обчисліть маси розчинів з масовими частками калій гідроксиду 10% та 50%, необхідні для приготування 800 г розчину з масовою часткою калій гідроксиду 25%.
- Скласти умову задачі за малюнком, розв´язати її.
![]()
![]()
![]()
![]()
![]()
![]()
![]() 40 мл р-ну 30 мл р-ну
40 мл р-ну 30 мл р-ну
ρ =1,5г/мл ρ =1,3г/мл
Варіант В.
- До розчину сульфатної кислоти об”ємом 400 мл , густина якого 1,1 г/мл , а масова частка кислоти 15%, додали 60 г води. Визначити масову частку розчиненої речовини у розчині.
- Яка маса осаду утвориться при взаємодії 200 г розчину з масовою часткою натрій гідроксиду 10% із розчином купрум(ІІ) сульфату?
- Скласти умову задачі за малюнком, розв´язати її.
![]()
![]()
![]()
![]()
![]()
![]()
![]() 500 г р-ну 200 г р-ну
500 г р-ну 200 г р-ну
Варіант С.
- Яка маса калій гідроксиду та води міститься у 800 г 40%-ого розчину?
- Обчислити масову частку калій хлориду у розчині, якщо в результаті випарювання 300 г 6%-ого розчину його маса зменшилася на 150 г.
4. Скласти умову задачі за малюнком, розв´язати її.
![]()
Х г солі
![]()
![]()

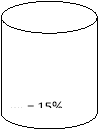
W2 = 30%
600 г р-ну
Учні, які раніше справилися з розв´язуванням задач, виконують тестові завдання.
- Виберіть твердження, що характеризує розчин: а)речовина у рідкому агрегатному стані; б)хімічна сполука; в)однорідна суміш речовин; г)гетерогенна система, що складається з кількох речовин.
- Виберіть твердження, яке визначає масову частку розчиненої речовини в розчині як відношення: а)маси розчину до його об”єму; б)маси розчиненої речовини до маси розчину; в)маси розчину до маси розчиненої речовини; г)маси розчиненої речовини до маси розчинника.
- Виберіть твердження, яке визначає густину розчину як відношення: а)маси розчиненої речовини до об'єму розчину; б)маси розчиненої речовини до маси розчину; в)маси розчину до об'єму розчину; г) маси розчинника до маси розчину.
- Позначте символ та одиниці вимірювання масової частки розчиненої речовини: а)φ ; б)W ; в)%; г) г/моль.
- Масова частка розчиненої речовини в розчині, утвореному при розчиненні 40 г речовини в 160 г води становить: а)0,25; б)0,20; в)0,40; г)0,15.
- Встановіть відповідність:
Склад розчину Масова частка розчиненої речовини
|
а |
|
|
б |
|
|
в |
|
|
г |
|
а) 4 моль NаОН і 640 г води 1. 9,8%
б) 30 г солі і 170 г води 2. 12,7%
в) 4,48 л НСl і 50 мл води 3. 20%
г) 0,3 моль Н2SО4 і 270,6 г води. 4. 0,15
Перевіривши тестові завдання , завдання навчальної частини семінару , учитель виставляє остаточну оцінку кожному учню.
ІІІ. Домашнє завдання.
Повторити тему „Розчини”. Виконати диференційоване домашнє завдання.
Варіант А.
- Яку масу залізного купоросу слід розчинити у 186,1 мл води для одержання розчину з масовою часткою ферум(ІІ) сульфату 3,8%?
- Визначте маси розчинів з масовими частками розчиненої речовини 10% та 30%, необхідні для приготування 300 г розчину цієї речовини з масовою часткою 15%.
Варіант В.
- Обчислити масову частку розчиненої речовини в розчині, який утвориться при додаванні 20 г алюміній хлориду до 280 г 5%-го розчину цієї солі.
- Водень об´ємом 200 л (н.у.) було піддано реакції синтезу з хлором. Після закінчення реакції утворений хлороводень розчинили у 1348 мл води. Розрахуйте масову частку речовини в розчині.
Варіант С.
- У лабораторії провели випарювання 1,2 кг розчину з масовою часткою солі 28%. Після випарювання розчин мав масу 1 кг. Якою стала масова частка солі в розчині після випарювання?
- Яку масу барій хлориду та який об´єм води треба взяти для приготування 200 г 2%-го розчину?
-
Дякую!
-
Дякую
-
Дякую!

про публікацію авторської розробки
Додати розробку
