Швидкість хімічної реакції
9 клас. І семестр.
Загальна тема: Хімічні реакції.
Тема уроку: Швидкість хімічної реакції.
Мета: Сформувати уявлення про швидкість хімічних реакцій і причини від яких вони залежать. Продовжити формувати поняття хімічної реакції і систематизувати отримані знання, розвивати мислення, увагу, пам’ять, уміння спостерігати. Сформувати поняття каталізатор та каталітична реакція. Прививати бажання здобувати нові знання, розвивати світогляд, і формувати цілісну картину світу. Вчитися використовувати свої знання на практиці. Формувати міжпредметні зв’язки.
Тип уроку: урок засвоєння нових знань.
Форма проведення: лекція зі створення проблемних ситуацій.
Обладнання і матеріали: інтерактивна дошка, хімічні реактиви ,лабораторній посуд.
на столі вчителя: 2 ложечки, штатив для пробірок, 4 пробірки, спиртівка, сірники, реактиви.
на столах в учнів: штатив для пробірок, 5 пробірок, ложечка; пробірко тримач, спиртівка, сірники.
Реактиви:
на столі вчителя: порошок цинку, порошок заліза, манган(IV) оксид, розчин гідроген пероксиду (3%), розведена хлоридна кислота.
на столах в учнів: розведена хлоридна кислота гранули цинку, розведена хлоридна кислота, вода; купрум (II) оксид порошок цинку.
ПЛАН УРОКУ
І. Організаційний етап.
ІІ. Актуалізація опорних знань
ІІІ. Мотивація навчальної діяльності
IV. Вивчення нового матеріалу
- Поняття про швидкість реакції.
-
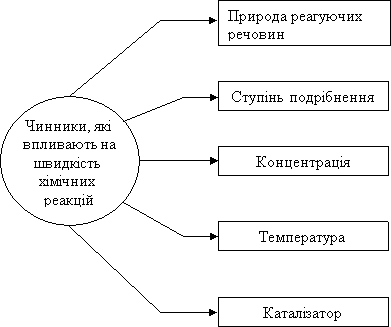
Фактори, що впливають на швидкість реакції:
- природа реагуючих речовин;
- концентрація;
- площа стикання реагентів;
- температура;
- наявність каталізатора.
- V. Закріплення знань
VI. Підбиття підсумків
VII. Домашнє завдання
ХІД УРОКУ
І. Організаційний етап
Доброго дня шановні учні! Сьогодні у вас цікавий урок. Ви звикли до традиційних уроків хімії. А сьогодні урок у вас особливий, сповнений цікавими фактами. Ми будемо мандрувати країною хімічних знань Хімляндією, робити для себе нові відкриття а також застосовувати вже отримані вами знання. В результаті подорожі ми повинні будемо пояснити, як наша сьогоднішня подорож стосується нашого організму. Тому прошу, будьте уважними! Тож, не підведіть! Тоді вперед, розпочинаємо.
ІІ. Актуалізація опорних знань
Але перш ніж потрапити в хімічну країну ми повинні відкрити її кордони. А для цього нам необхідно відповісти на декілька питань і відкрити коди країни.
Бесіда:
– Дайте визначення поняттю "Хімічна реакція". //Хімічна реакція – це перетворення одних речовин на інші при незмінності ядер атомів//
– Які ознаки протікання хімічних реакцій? //Виділення або поглинання тепла, світла, електричної енергії; поява чи зникнення запаху, виділення газу, випадання осаду та інше//
– Назвіть відомі вам типи хімічних реакцій. //Розкладу, сполучення, заміщення та обміну//
– Встановіть відповідність
– 1.Реакції розкладу 2HCl + Zn = ZnCl2 + H2
– 2.Реакції сполучення 2Mg + O2 = 2MgO
– 3.Реакції обміну 2KMnO4 = K2MnO4 + MnO2 + O2
– 4.Реакції заміщення 2NaOH + H2SO4 = Na2SO4 + 2H2O
ІІІ. Мотивація навчальної діяльності
Подивіться будь ласка які цікаві речі відбуваються
Іржавіння заліза, спалах бензину, вибух пороху, випадання осаду , горіння дерева.
Як ви думаєте що відбувається з однаковою швидкістю? А. що може вливати на швидкість хімічних реакцій ? Вже це мі сьогодні з’ясуємо.
VI. Вивчення нового матеріалу.
- Поняття про швидкість реакції.
Швидкість реакції, яка відбувається в однорідній суміші, визначають за зміною кількості речовини реагенту ( продукту ) в одиниці об’єму суміші за одиницю часу.
Давайте спробуємо розібратися що в пливає на швидкість хімічної реакції. Оскільки ми в Хімляндії то з’ясовувати чинники, які впливають на швидкість хімічної реакції ми будемо експериментально. Але наша казкова країна вимагає від нас чітких, правил а саме виконання правил техніки безпеки.
- Уважно читайте етикетку на посудині з речовиною, яку берете для досліду.
- Реактиви беріть у кількостях зазначених в інструкціях.
- Обережно працюйте зі скляним посудом.
- При нагріванні спочатку прогрійте всю пробірку, а потім нагрівайте те місце, де міститься речовина.
- Кислоти небезпечні при потраплянні на шкіру або в очі.
Ну що ж правила Хімляндії знаємо, можемо приступати до досліджень.
Демонстрація :
Беремо 2 пробірки і в невеликих кількостях кладемо метали, в першу цинк, а в другу залізо. Добавляємо в кожну пробірку не велику кількість соляної кислоти. Спостерігаємо за інтенсивністю реакції і робимо висновки. Порівнюємо розміщення металів у ряді напруг металів. Отже кожна реакція відбувається з різною швидкістю.
Наступний дослід ви виконуєте самостійно. Але перед цим давайте згадаємо, що називається концентрацією і з’ясуємо чи можна зменшити концентрацію розчину. По закінченню досліду ви повинні з’ясувати, чи впливає концентрація на швидкість хімічної реакції.
Дослід:
Беремо дві пробірки і кладемо в них по гранулі цинку. В першу пробірку добавляємо п’яти відсоткову соляну кислоту, а в другу двадцяти відсоткову соляну кислоту, спостерігаємо і робимо висновки.
Збільшення швидкості реакції пояснюється тим, що збільшується концентрація частинок у реакційній суміші. Отже і кількість зіткнень із частинками іншого реагенту зростає.
Дослід №2
Беремо пробірку і насипаємо цинковий порошок та добавляємо соляну кислоту п’яти відсоткову. Порівнюємо перший і другий дослід.
Робимо висновки.
Швидкість реакції пояснюється тим, що в реакції беруть участь атоми цинку та Йони гідрогену, а ця взаємодія можлива лише на поверхні металу.
Дослід №3
В дві пробірки насипаємо по пів грама порошку купрум два оксиду і наливаємо по два мілілітри хлоридної кислоти п’яти відсоткової.
Одну пробірку залишаємо іншу гріємо. Спостерігаємо робимо висновки.
Реакція збільшується бо зростає швидкість руху молекул в рідині та інтенсивність коливань у твердій речовині.
Демонстрація :
Беремо дві пробірки і наливаємо розчин гідроген пероксиду.
В одну з пробірок добавляємо манган чотири оксид.
Спостерігаємо робимо висновок.
Каталізатори це речовини які збільшують швидкість хімічної реакції але самі при цьому не використовуються


V. Закріплення знань.

VІ. Підбиття підсумків.
Швидкість хімічної реакції залежить від багатьох факторів.
VІІ. Домашнє завдання.
1. Опрацювати §16
2. Виконати вправи 6–8 на ст. 119-120


про публікацію авторської розробки
Додати розробку
