Система уроків у 8 класі по темі "Періодичний закон та періодична система хімічних елементів Д.І.Менделєєва.Будова атома"
Розвиток пізнавальної активності учнів на уроках хімії та використання педагогічного програмного засобу «Хімія. 9 клас» з використанням робочого зошиту О.А.Іванащенко «Робочий зошит з хімії. 8 клас»
Система уроків у 8 класі з теми «Періодичний закон та періодична система хімічних елементів Д.І.Менделєєва. Будова атома»
|
ІІІ. |
Розвиток пізнавальної активності учнів та використання педагогічного програмного засобу «Хімія» Система уроків у 8 класі з теми «Періодичний закон та періодична система хімічних елементів Д.І.Менделєєва»
|
|
|
|
Історичні відомості про спроби класифікації хімічних елементів. |
|
|
|
Поняття про лужні, інертні елементи, галогени. |
|
|
|
Періодичний закон та періодична система хімічних елементів Д. І. Менделєєва. |
|
|
|
Будова атома: ядро і електронна оболонка. Склад атомних ядер (протони і нейтрони). Протонне число. |
|
|
|
Сучасне формулювання періодичного закону. Ізотопи (стабільні та радіоактивні). |
|
|
|
Поняття про радіус атома. Стан електронів у атомі. Енергетичні рівні та підрівні. Структура періодичної системи |
|
|
|
Будова електронних оболонок атомів хімічних елементів. |
|
|
|
Будова електронних оболонок атомів хімічних елементів. |
|
|
|
Взаємозв'язок між розміщенням елементів у періодичній системі і властивостями хімічних елементів, простих речовин, сполук елементів з Гідрогеном та Оксигеном. Лабораторний дослід: 11. Дослідження характеру гідратів оксидів Натрію, Алюмінію, Сульфуру(УІ). |
|
|
|
Структура періодичної системи у світлі теорії будови атома. |
|
|
|
Характеристика хімічних елементів малих періодів за їх місцем у періодичній системі та будовою атома. |
|
|
|
Характеристика хімічних елементів малих періодів за їх місцем у періодичній системі та будовою атома. Значення періодичного закону. |
|
|
|
Життя і наукова діяльність Д. І. Менделєєва. |
|
УРОК 1
Тема: Історичні відомості про способи класифікації хімічних елементів. Поняття про лужні метали.
Мета: уроку: проаналізувати тематичне оцінювання та здійснити коригування знань учнів з теми «Класи неорганічних сполук»; розкрити необхідність наукової класифікації хімічних елементів і показати недосконалість перших спроб класифікації елементів; розширити знання про хімічні елементи, характерні ознаки простих речовин, утворених металами й неметалами.
Тип уроку: засвоєння нових знань.
Форми роботи: розповідь учителя, фронтальна евристична бесіда, робота з навчальною літературою.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, плакат «Приклади спроб класифікації хімічних елементів», ППЗ до теми «Періодичний закон та періодична система хімічних елементів Д.І.Менделєєва».
ХІД УРОКУ
І.Організація класу.
Вступне слово вчителя, загальні відомості про місце досліджуваної теми в курсі хімії в школі, оголошення теми, плану й основних цілей теми.
II. Актуалізація опорних знань
- Вправа «Мікрофон»
• Як називається найменша неподільна частинка хімічного елемента, що входить до складу молекул простих і складних речовин? (Атом)
• Що таке хімічний елемент? (Тип атомів, що характеризуються певною сукупністю властивостей)
• Що таке молекули? (Це дрібні частинки, з яких складаються речовини та які мають усі властивості цієї речовини)
- Фронтальна бесіда щодо класифікацію хімічних елементів і речовин.
- Вправа «Незакінчене речення».
Оксиди — складні речовини, що складаються з двох елементів…
Основи — складні речовини, до складу яких входять атоми металів…
Кислоти — складні речовини, що складаються з атомів Гідрогену…
Солі — складні речовини, утворені атомами металів...
Відносна атомна маса елемента показує, у скільки разів маса його атома більша за … маси атома Карбону-12.
Відносна молекулярна маса — це фізична величина, що показує, у скільки разів маса молекули більша за 1/12 маси атома …
- Розв’язування вправ (робота в парах).
Завдання 1.Обчисліть відносні молекулярні маси таких речовин:алюміній сульфату, кальцій ортофосфату.
Завдання 2.Визначте валентність атомів хімічних елементів у молекулах: MgO, НСl, Na2O, Аl2O3, H2S.
Завдання 3.Запишіть формули сполук Цезію, Барію, Селену з Оксигеном.
III. Вивчення нового матеріалу
1.Робота з педагогічним програмним засобом.
Урок «Спроби класифікації хімічних елементів. Поняття про лужні елементи»
2. Діяльність вчителя в ході використання ППЗ.
1.Першими металами, на які людина звернула увагу, були самородні мідь і золото. Люди бронзового століття довідалися про існування заліза — більш твердого металу, ніж бронза. Важливу роль у розвитку хімії як науки відіграли філософи Давньої Греції.
— Які елементи-стихії виділяли давні греки?
Давні греки вважали, що основними елементами є вода, земля, повітря й вогонь. Кожен з елементів-стихій є носієм двох властивостей. Схема Аристотеля передбачала чотири комбінації: вогонь — гарячий і сухий, повітря — гаряче й вологе, земля — холодна й суха, вода — холодна й волога.
За 300 р. до н. е. в Олександрії були відомі сім небесних тіл, що постійно змінюють своє положення й тому названих «планетами» («мандрівними зірками»), І відомі сім металів: золото, срібло, мідь, залізо, олово, свинець і ртуть. Чому б не об'єднати їх у пари? Саме тоді золото почали співвідносити із Сонцем, срібло — із Місяцем, мідь — із Венерою тощо.
У XVIII столітті були відкриті такі газоподібні елементи, як азот, водень, кисень і хлор, і такі метали, як кобальт, платина, нікель, манган, вольфрам, молібден, уран, титан і хром. До 70-х pp. позаминулого століття було вже відомо понад 60 хімічних елементів. У хімії, як і в інших природничих науках (ботаніка, зоологія), у міру накопичення фактів виникла необхідність у їхній класифікації.
Спочатку вчені намагалися розділити всі хімічні елементи на дві групи — метали й неметали.
— Які елементи називаються металами? неметалами?
В основу розподілу простих речовин були покладені як фізичні властивості (металевий блиск, хороша електро- й теплопровідність для металів і відсутність металевого блиску й відносно погана тепло- й електропровідність для неметалів), так і хімічні (здатність утворювати: для металів — переважно основні оксиди й відповідні їм гідроксиди — основи, для неметалів — кислотні оксиди й відповідні їм гідроксиди — кислоти). Неметали, на відміну від металів, утворюють із воднем леткі сполуки. Типові метали в сполуках з Оксигеном проявляють низьку валентність (I, II, III), тоді як типові неметали — високу (VII, VI, V, IV).
2. Поняття про групи подібних елементів
Учені-хіміки робили також спроби класифікувати хімічні елементи, об'єднуючи їх в окремі групи відповідно до їхніх властивостей.
1. Лужні метали
Англійський хімік Г. Деві під час електролізу лугу КОН відкрив новий елемент, який він назвав потассіум, оскільки англійці називали КОН їдким поташем. Деві кинув калій у воду й очікував, що метал має негайно опуститися на дно. Але калій повівся інакше. З гучним шипінням цей метал забігав по поверхні води. Потім пролунав оглушливий вибух, і над потассіумом спалахнуло лілове полум’я. Так він і носився по воді, поки не перетворився на їдкий луг.
Про цезій і рубідій, відкриті іншими вченими, писали, що це легкі сріблясті метали, які так само, як літій і калій, загорялися на повітрі, бігали по воді з полум’ям і тріском, навіть більш несамовито, ніж калій і натрій. Усі лужні метали зберігають під шаром гасу. Солі Рубідію і Цезію не відрізняються від звичайної кухонної солі. їдкий цезієвий луг та їдкий рубідієвий луг були слизькими на дотик і мильними, подібно до їдкого натру та їдкого калі.
3.Діяльність учнів в робочих зошитах в ході використання ППЗ.
Лужні метали – найактивніші метали.
До родини лужних елементів належать металічні елементи: __________, які в періодичній системі розміщені в _____________________________________
Загальна характеристика лужних елементів(учні заповнюють таблицю):
|
Хімічний елемент |
Порядковий номер |
Відносна атомна маса, Аг |
Валентність |
Формула |
Характер оксидів та гідратів оксидів |
||
|
Символ |
Назва |
оксиду |
гідрату оксиду |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Властивості лужних металів
|
Назва простої речовини |
Фізичні властивості |
Здатність окиснюватися |
Хімічна активність |
|||
|
тпл, ° с |
Ткип, ° С |
Густина, г/см3 |
Загоряються під час нагрівання |
Посилюється від Літію до Цезію |
||
|
Літій
|
180,54 |
1350 |
0,53 |
|||
|
Натрій |
97,96 |
883,1 |
0,97 |
|||
|
Калій |
63,65 |
774 |
0,86 |
|||
|
Рубідій |
39,30 |
705 |
1,52 |
Самозаймаються при 25 °С |
||
|
Цезій |
28,60 |
688 |
1,89 |
|||
|
Висновки. (Закінчить речення, вписавши потрібні слова або словосполучення із другої колонки) |
||||||
|
Прості речовини літій, натрій, калій, рубідій, цезій — |
метали сріблясто-білого кольору з характерним металічним блиском; неметали жовтого кольору; тверді, важкі, тугоплавкі; легкі, м’які, легкоплавкі |
|||||
|
|
||||||
|
Зі збільшенням відносної атомної маси: а) температури плавлення та кипіння б) густина в) хімічна активність |
зменшується; збільшується; посилюється; послаблюється |
|||||
|
Лужні елементи утворюють |
основні оксиди складу Е20 та відповідні їм гідроксиди — луги Е0Н; основні оксиди складу Е0 та гідроксиди — складу Е(ОН)2 |
|||||
|
|
||||||
|
|
||||||
|
Лужні елементи в природі трапляються |
у вільному стані; тільки у вигляді сполук |
|||||
ІV.ЗВМ.
Виконання завдань в робочому зошиті:
1.Запишіть рівняння реакцій взаємодії металів з указаними речовинами:
|
Метал |
з водою: |
з киснем: |
із сіркою : |
|
Літій |
|
|
|
|
Натрій |
|
|
|
|
Калій |
|
|
|
2. Напишіть рівняння реакцій, за допомогою яких можна здійснити такий ланцюжок перетворень: Літій-літій оксид - літій гідроксид.
Відповідь:
1)____________
2)____________
3)____________
3. Який об’єм водню (н. у.) виділиться під час взаємодії з водою металічного літію масою 14 г? Яку кількість речовини натрію треба взяти для реакції з водою, щоб виділився такий самий об’єм водню?
|
Дано: |
Розв’язання |
|
|
|
V. Підсумки.
1. Які перші спроби класифікації хімічних елементів вам відомі?
2. Що покладено в основу класифікації хімічних елементів?
3. Чи періодично повторюються властивості елементів?
4.Яке значення має класифікація хімічних елементів для відкриття періодичного закону? Для розвитку сучасної науки?
VІ. Домашнє завдання
Опрацювати параграф 26 ,
Вправа 1-2(1-6 бали), 3 (7-9 балів), 3,4 (12 балів)
Творче завдання. Підготувати інформацію про одну з груп хімічних елементів: «Галогени», «Лужні метали», «Інертні елементи». Скласти кросворд з назвами цих елементів.
Тема: Поняття про галогени, інертні гази.
Мета уроку: розширити знання учнів про хімічні елементи та їхні властивості на прикладі природних родин хімічних елементів ( інертні елементи, галогени); розкрити залежність властивостей усередині груп галогенів та інертних газів від порядкового номера елемента.
Тип уроку: засвоєння нових знань.
Форми роботи: розповідь учителя, робота з навчальними таблицями, демонстраційний експеримент.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів; ППЗ.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання, мотивація навчальної діяльності
Розглядаємо кросворди з назвами хімічних елементів, які підготували учні, і на дошці розділяємо їх на три групи: лужні метали, галогени, інертні елементи.
Зараз на дошці представлений один зі способів класифікації хімічних елементів за приналежністю до природних родин хімічних елементів.
Проблемне завдання:Наскільки схожі ці елементи за фізичними й хімічними властивостями всередині родини? Чим відрізняються один від одного? Який зв’язок існує між елементами різних груп? Спробуємо відповісти на ці питання на сьогоднішньому уроці.
III . Вивчення нового матеріалу.
1.Педагогічний програмний засіб.
Урок «Поняття про галогени та інертні гази»
2. Діяльність вчителя в ході використання ППЗ.
1. Галогени — типові неметали, у періодичній системі розташовані в VII групі головної підгрупи. їх назва походить від слів галос — «сіль» і ген — «той, що народжує». Назвіть їх.
F, Cl, Br, I, At
Властивості галогенів
Фтор — газ ясно-зеленого кольору, дуже отруйний. Багато вчених, які працюють із ним, постраждали від цього. Найбільш активний неметал (у флуорі навіть вода горить), реагує з воднем за значного охолодження в темряві.
Хлор — важкий газ зеленого кольору з різким запахом, отруйний, за звичайних умов реагує з воднем дуже повільно, а за температури або на світлі — з вибухом:
Н2 + Сl2 ![]() 2НСl
2НСl
Бром — важка темно-коричнева рідина, дуже активний неметал, але менш активний, ніж хлор. З воднем реагує виключно за нагрівання.
Іод — темно-фіолетові кристали, активний неметал, найменш активний у ряді галогенів, реакція з воднем навіть за нагрівання оборотна.
Флуор, Хлор, Бром, Іод — представники родини подібних за властивостями елементів, які називають галогенами. Типова валентність — І.
У ряді: F, Cl, Br, I, At tкип ° tплавл ° збільшуються, активність зменшується (найбільш активний — Флуор).
2. Інертні елементи
Інертні елементи — це елементи головної підгрупи VIII групи періодичної системи. Назвіть їх.
Не, Ne, Аr, Кr, Хе, Rn
У 1868 році француз Жансе й англієць Лок'єр під час вивчення сонячних протуберанців відкрили спектр нового хімічного елемента, що не належав жодному з відомих на земній кулі. «Небесний» елемент назвали Гелієм. Через 25 років Релей виявив у звичайному повітрі домішок, який не вступав у хімічні реакції. Цей елемент назвали Аргон («ледачий»).
Незабаром Гелій був виявлений у мінералах, що містять Уран і Торій. Гелій виявився найлегшим після водню газом.
У 1897 році англієць Рамзай передбачив існування ще однієї газоподібної речовини, що мала перебувати між Гелієм і Аргоном. Це виявився відкритий у 1898 році Неон. А потім у короткий строк Рамзай та його співробітник Траверс виявили в земній атмосфері ще два елементи — Криптон («таємний») і Ксенон («прихований»).
До складу повітря, крім кисню й азоту, входять ще п'ять газоподібних простих речовин: гелій Не, неон Me, аргон Аr, криптон Кr, ксенон Хе. Тривалий час не вдавалося одержати сполуки цих елементів. їх назвали інертними газами.
Хімічні сполуки Не та Ne не відомі, тому їх називають інертними, у той час як Кr і Хе утворюють хімічні сполуки. Аr, Кr і Хе утворюють також клатрати.
З кожним роком розширюється сфера застосування інертних газів. Легкість і негорючість гелію використовують для заповнення ним повітряних куль і дирижаблів. В інертному середовищі аргону здійснюють електрозварювання металів, що легко окислюються. Неоном, аргоном, криптоном і ксеноном заповнюють електричні лампочки. Суміш гелію з киснем застосовують для дихання під час підводних робіт. Якщо крізь розріджені інертні гази пропускати електричний струм, то вони випромінюють світло різного забарвлення. Наприклад, аргон дає синє світіння, неон — червоне, тому їх використовують для світлових реклам і в маяках.
Діяльність учнів в робочих зошитах в ході використання ППЗ.
Галогени – найактивніші неметали. До родини галогенів належать неметалічні елементи ___________________________________________________________, які в Періодичній системі розміщені в _________________________________.
Загальна характеристика галогенів (учні заповнюють таблицю)
|
Хімічний елемент
Символ Назва |
Порядковий номер |
Відносна атомна маса, Аr |
Вищі оксиди |
Тип оксидів |
Леткі сполуки Гідрогеном |
|
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
|
|
|
|
|
|
Фізичні властивості галогенів (заповніть таблицю)
|
Проста речовина |
Формула |
Фізичні властивості |
|
|
||
|
Агрегатний стан |
Колір |
Тпл, °С |
Т °С1 кип |
Густина |
||
|
Фтор |
|
|
|
-220 |
-188 |
1,696 г/л |
|
Хлор |
|
|
|
-101 |
-34 |
3,21г/л |
|
Бром |
|
|
|
-7 |
+58 |
3,12 г/см |
|
Йод |
|
|
|
+114 |
+186 |
4,93 г/см |
Проаналізуйте наведену інформацію та зробіть висновки.
1.Прості речовини галогени мають___________ будову.
2.Зі збільшенням відносної молекулярної маси сполук: а) агрегатний стан галогенів закономірно змінюється від_______________________________
б) температура плавлення та кипіння галогенів_________ ; густина_____
Хімічні властивості галогенів_______________________________________
Напишіть рівняння відповідних реакцій. Назвіть продукти реакції.
|
Реагенти |
Водень |
Магній |
|
Флуор |
|
|
|
Хлор |
|
|
|
Бром |
|
|
|
Йод |
|
|
Висновок. Галогени реагують з воднем, утворюючи_______________________;
галогени реагують з____________________________________ утворюючи солі
Валентність галогенів у сполуках з Гідрогеном та металічними елементами
дорівнює_______________.
Хімічна активність галогенів у ряду F2, С12, Вг2,12___________________________
Інертні елементи.
До родини інертних елементів належать:______________________________ ,
які в Періодичній системі розміщені в_________________________________.
ІV.ЗВМ.
Виконання завдань в робочому зошиті:
Задача. Яка маса солі утвориться внаслідок взаємодії хлору об’ємом 33,6 л (н. у.) з алюмінієм?
V. Підсумки.
Вправа «Коректор»
- Лужні метали – це малоактивні речовини.
- Галогени знаходяться у головній підгрупі І групи.
- Інертні гази – найактивніші речовини.
Проблемне запитання.
- Чи залежать властивості усередині груп галогенів та інертних газів від порядкового номера елемента?
VІ. Домашнє завдання
Опрацювати параграф 27-28,
Вправа 1-2(1-6 бали), 3 (7-9 балів), 3,4 (12 балів) стр.130
Завдання. Дізнайтеся з літератури, сайтів Інтернету про історію відкриття, склад, будову, хімічну активність інертних газів. Напишіть невелике
повідомлення.
УРОК 3
Тема: Періодичний закон і періодична система хімічних елементів Д. І. Менделєєва.
Мета уроку: ознайомити учнів зі структурою Періодичної системи хімічних елементів Д. І. Менделєєва (малі й великі періоди, групи й підгрупи), з довгою й короткою формою періодичної системи хімічних елементів; продовжити формування уявлень учнів про періодичну зміну властивостей хімічних елементів, виходячи з їх положення в періодичній системі; показати загальну залежність і розвиток неорганічної природи; продовжити формування знань про загальні закони природи.
Тип уроку: засвоєння нових знань.
Форми роботи: розповідь учителя, індивідуальна робота з періодичною системою хімічних елементів, фронтальна робота з періодичною системою, демонстрація.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва (коротка і довгоперіодна форми).
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання, актуалізація опорних знань
1.Завдання класу
(Четверо учнів працюють біля дошки.)
1. Дати порівняльну характеристику лужних металів.
2. Дати порівняльну характеристику галогенів.
3. Здійснити перетворення:
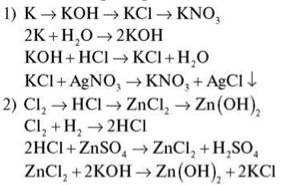
2.Фронтальна бесіда
• Які вчені вдавалися до спроб класифікувати хімічні елементи?
• Як змінюється валентність у вищому оксиді в елементів:
♦ від Li до С;
♦ від Na до СІ?
• Як змінюється характер оксидів цих елементів?
Висновок. Властивості елементів та їхніх сполук повторюються. Періодична залежність означає, що властивості елементів повторюються.
• Яку властивість атомів поклав в основу класифікації Д. І. Менделєєв?
• Як Д. І. Менделєєв сформулював періодичний закон?
Властивості простих тіл, а також форма і властивості сполук елементів перебувають у періодичній залежності від величини атомних мас елементів.
III. Вивчення нового матеріалу
1.Педагогічний програмний засіб.
Урок «Періодичний закон. Періодична система хімічних елементів Д. І. Менделєєва – графічний вираз періодичного закону. Поняття про періоди та групи»
2. Діяльність вчителя в ході використання ППЗ.
Спробуємо з'ясувати, чому суть відкриття Д. І. Менделєєва. Розглянемо таблицю сучасної Періодичної системи хімічних елементів Д. І. Менделєєва.
Горизонтальні ряди елементів, у межах яких властивості елементів змінюються послідовно (наприклад, ряд з восьми елементів від Літію до Неону або від Натрію до Аргону), Д. І. Менделєєв назвав періодами.
Періоди бувають великі й малі. Малі періоди складаються з одного ряду (1, 2, 3)
великі періоди — з двох рядів (4, 5, 6).
Група — це вертикальний ряд подібних за властивостями елементів. Група поділяється на підгрупи: головну й побічну. Головна підгрупа містить елементи й малих, і великих періодів, побічна — елементи виключно великих періодів.
• Як змінюються металічні й неметалічні властивості елементів і характер їх оксидів у малих періодах?
У всіх періодах зі збільшенням відносних атомних мас (зліва направо) спостерігається ослаблення металічних і посилення неметалічних властивостей. У великих періодах металічні властивості елементів ослабляються зі зростанням порядкового номера повільніше, ніж у малих періодах, тому в парних рядах розташовані метали.
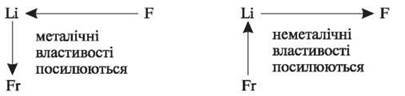
• Як змінюються металічні властивості лужних металів і неметалічні властивості галогенів залежно від відносної атомної маси?
У головних підгрупах (згори вниз) зі збільшенням відносних атомних мас посилюються металічні властивості елементів і слабшають неметалічні.
• Як змінюється максимальна валентність елементів у вищому оксиді? Вища валентність елементів у сполуках з Оксигеном (за деякими винятками) відповідає номеру групи. Елементи побічних підгруп можуть виявляти й іншу валентність. Наприклад, Купрум — елемент І групи побічної підгрупи — утворює оксид Сu2O. Однак найпоширенішими є сполуки двовалентного Купруму (Au(+3), F(—1), О(—2), N(+4) та ін.).
• Як змінюється валентність елементів неметалів у сполуках з Гідрогеном?
Елементи головних підгруп IV—VII груп утворюють також леткі сполуки з Гідрогеном. Валентність елементів у сполуках з Гідрогеном визначається різницею між числом 8 і номером групи.
3.Діяльність учнів в робочих зошитах ході використання ППЗ.
Періодичний закон було відкрито в_________ році російським ученим_______
На час відкриття Періодичного закону було відомо ___ хімічних елементів.
Елементи, подібні за властивостями, було об’єднано в групи______________
В основу класифікації елементів було покладено: а)_______________________________ б)____________________________
У Періодичній системі елементи розташовано в порядку___________________
Застосуйте знання про основні класи неорганічних сполук, склад і властивості речовин і заповніть таблицю.
Зміна властивостей хімічних елементів, утворених ними простих і складних речовин
|
|
|
Групи |
||||||
|
|
|
І |
ІІ |
III |
ІV
|
V |
VI |
VII |
|
|
Елемент |
Lі |
Ве |
В |
С |
N |
О |
F |
|
2 період |
Аr |
|
|
|
|
|
|
|
|
Проста речовина |
|
|
|
|
|
|
|
|
|
Вищий оксид |
|
|
|
|
|
— |
|
|
|
Валентність елемента |
|
|
|
|
|
|
|
|
|
Тип оксиду |
|
|
|
|
|
— |
|
|
|
Відповідний гідрат оксиду |
|
|
|
|
|
— |
|
|
|
Летка сполука з Гідрогеном |
— |
— |
— |
|
|
|
|
|
|
|
Елемент |
Na |
Mg |
А1 |
Si |
Р |
S |
Cl |
|
3 період |
Аr |
|
|
|
|
|
|
|
|
Проста речовина |
|
|
|
|
|
|
|
|
|
Вищий оксид |
|
|
|
|
|
|
|
|
|
Валентність елемента |
|
|
|
|
|
|
|
|
|
Тип оксиду |
|
|
|
|
|
|
■ ‘1 |
|
|
Відповідний гідрат оксиду |
|
|
|
|
|
|
|
|
|
Летка сполука з Гідрогеном |
— |
— |
— |
|
|
|
|
|
Висновки. Зі збільшенням відносних атомних мас відбувається періодичне повторення властивостей елементів, простих речовин, складу і властивостей сполук, а саме:
від Літію до Флуору та від Натрію до Хлору
а) металічні властивості___________ , а неметалічні_____________________
б) валентність елементів за Оксигеном ________________________________
в) валентність неметалічних елементів за Гідрогеном____________________
г) основні властивості вищих оксидів та відповідних гідратів оксидів____________,а кислотні — _____________________________________.
Періодичність — це повторення, тому ряди елементів назвали періодами. Періодичний закон Д. І. Менделєєва:___________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
ПЕРІОД —___________________________________________________________
МАЛІ (1-, 2-, 3-й) містять________________________ елементів
ПЕРІОДИ
ВЕЛИКІ (4-, 5-, 6-й) містять______________________ елементів
ГРУПА — це_____________________________________________________
ГРУПА
|
А |
|
Б |
|
головна підгрупа |
|
побічна підгрупа |
|
входять елементи |
|
входять елементи |
|
періодів |
|
періодів |
VIII група має особливу будову. Запишіть у колонки символи елементів 1-6 періодів, що утворюють головну і побічну підгрупи VIII групи.
VIII ГРУПА
|
А 1 період |
|
Б |
|
2 |
|
|
|
3 |
|
|
|
4 |
|
|
|
5 |
|
|
|
6 |
|
|
Закономірності Періодичної системи.
- У періодах із зростанням відносних атомних мас елементів спостерігається поступове послаблення _________________ властивостей
і посилення ______________________________________________властивостей.
- У групах розміщено хімічні елементи, які_________ за властивостями
та складом сполук — оксидів, гідратів оксидів, летких сполук з Гідрогеном.
- У головних підгрупах із зростанням відносних атомних мас елементів спостерігається поступове послаблення_________________ властивостей і посилення _________________________________________ властивостей.
- У періодах валентності елементів_________________________________
- У групах вища валентність елементів, як правило, дорівнює___________
- Валентність неметалічних елементів IV—VII груп у сполуках з Гідрогеном дорівнює різниці між числом 8 і_______________________________
ІV.ЗВМ.
Тренувальні вправи
- Укажіть порядкові номери елементів, що належать до одного періоду:
А 20, З0, 38 Б 19, 20, 29
В 7, 8, 16 Г 9, 17, 35
- Укажіть символи хімічних елементів однієї групи й однієї підгрупи Періодичної системи Д. І. Менделєєва:
А S, О, Те Б S, Sе, Сг
В Сг, Sе, Мо Г S, О, Сг
- Укажіть символи хімічних елементів малого періоду Періодичної системи Д. І. Менделєєва:
А Ті, Сг, Fе Б Nа, К, Rb
В Sі, Ті, РЬ Г Na, Р, СІ
- Укажіть групу речовин, яка містить лише інертні елементи:
А Не, Ni, Со, Ne Б Хе, Nе, Не, Кr
В Аг, Вг2,12, Rn Г F2, С12, Вг2, і2
- Укажіть елемент, який утворює просту речовину молекулярної будови:
А Магній Б Алюміній
В Флуор Г Калій
- Розташуйте елементи в порядку посилення їх металічного характеру:
А Магній Б Алюміній
В Натрій Г Силіцій
- Розташуйте елементи в порядку послаблення їх неметалічного характеру:
А Бром Б Флуор
В Йод Г Хлор
- Укажіть найактивніший металічний та найактивніший неметалічний елементи 3 періоду:
А Купрум, Бром Б Літій, Флуор
В Натрій, Аргон Г Натрій, Хлор
9. Д. І. Менделєєв передбачив існування у природі невідомих на той час хімічних елементів та описав їх властивості. Вчений назвав їх Екаалюмінієм, Екасиліцієм та Екабором. Всі три елементи було відкрито ще за життя Д. І. Менделєєва. Укажіть сучасні назви цих елементів.
А Скандій, Галій, Германій
Б Хром, Селен, Ванадій
В Ферум, Купрум, Рубідій
Г Силіцій, Бор, Алюміній
10.Визначте хімічний елемент, формула сполуки якого з Гідрогеном ЕН2
А Бром Б Сульфур В Йод Г Хлор
V. Підсумки.
- Як ви розумієте слова «Періодичному закону руйнування не загрожує, а лише надбудову обіцяє?»
VІ. Домашнє завдання. Опрацювати параграф 29-30
Варіант І
1. Назвіть елемент 4 періоду, VI групи головної підгрупи.
2. Складіть формулу вищого оксиду елемента № 32.
3. Назвіть елемент 4 періоду, що має формулу сполуки з Гідрогеном HR.
4. Назвіть елемент, розташований у II групі, відносна молекулярна маса гідроксиду якого дорівнює 58.
Варіант II
1. Де в періодичній системі розташований елемент № 26?
2. Складіть формулу леткої сполуки з Гідрогеном для елемента № 8.
3. Назвіть елемент 5 періоду, що має формулу вищого оксиду RO3.
4. Назвіть елемент, розташований у IV групі, відносна молекулярна маса сполуки з Гідрогеном якого — 211.
Варіант III
1. Назвіть найактивніший метал 4 періоду.
2. Складіть формулу вищого оксиду елемента № 3.
3. Назвіть елемент 5 періоду, що має формулу сполуки з Гідрогеном HR.
4. Назвіть елемент, розташований у III групі, відносна молекулярна маса вищого оксиду якого дорівнює 102.
Варіант IV
1. Назвіть найактивніший метал IV групи головної підгрупи.
2. Складіть формулу леткої сполуки з Гідрогеном для елемента № 33.
3. Назвіть елемент 5 періоду, що має формулу вищого оксиду R2O7.
4. Назвіть елемент, розташований у І групі, відносна молекулярна маса гідроксиду якого дорівнює 40.
Варіант V
1. Назвіть найактивніший неметал 5 періоду.
2. Складіть формулу вищого оксиду елемента № 15.
3. Назвіть елемент 2 періоду, що має формулу сполуки з Гідрогеном RH4.
4. Назвіть елемент, розташований у IV групі, відносна молекулярна маса вищого оксиду якого дорівнює 60.
Варіант VI
1. Назвіть найактивніший неметал V групи головної підгрупи.
2. Складіть формулу леткої сполуки з Гідрогеном для елемента № 9.
3. Назвіть елемент 3 періоду, що має формулу вищого оксиду RO.
4. Назвіть елемент, розташований у III групі, відносна молекулярна маса вищого оксиду якого дорівнює 70.
12 балів. Один з передбачених Д. і. Менделєєвим елементів четвертого періоду утворює оксид, який містить 34,8 % Оксигену. Який це елемент?
УРОК 4
Тема: Будова атома: ядро і електронна оболонка. Склад атомних ядер (протони і нейтрони). Протонне число.
Мета уроку: продовжити знайомство з періодичною системи хімічних елементів Д. І. Менделєєва; на основі знань про будову атома розкрити фізичний зміст порядкового номера елемента; розширити знання учнів про радіоактивність і будову атома; підвести учнів до сучасного формулювання періодичного закону; формувати вміння характеризувати хімічні елементи за положенням у періодичній системі хімічних елементів, обчислювати кількості протонів, нейтронів і електронів у атомі; формувати уявлення про матеріальну єдність світу й можливість його пізнання.
Тип уроку: засвоєння знань, умінь і навичок.
Форми роботи: розповідь учителя, індивідуальні повідомлення учнів, фронтальна робота.
Обладнання: періодична система хімічних елементів Д. І. Менделєєва, плакат зі схемами ядерних реакцій, ППЗ.
ХІД УРОКУ
I. Організація класу
II.АОЗ, мотивація навчальної діяльності
1. Фронтальна бесіда.
1. Що називається періодом? Що мають спільного й чим відрізняються великі періоди від малих?
2. Що називається групою?
3. Розкажіть про структуру періодичної системи хімічних елементів.
4. Як змінюються властивості хімічних елементів у періодах і головних підгрупах?
5. Порівняйте неметалічні властивості елементів: О і С; F і В; Si і S.
6. Порівняйте металічні властивості елементів: Аl і Ga; Rb і Мо; Са і Ва.
2. Перевірка домашнього завдання (письмово фронтально).
Варіант І
1. Назвіть елемент 4 періоду, VI групи головної підгрупи.
2. Складіть формулу вищого оксиду елемента № 32.
3. Назвіть елемент 4 періоду, що має формулу сполуки з Гідрогеном HR.
4. Назвіть елемент, розташований у II групі, відносна молекулярна маса гідроксиду якого дорівнює 58.
Варіант II
1. Де в періодичній системі розташований елемент № 26?
2. Складіть формулу леткої сполуки з Гідрогеном для елемента № 8.
3. Назвіть елемент 5 періоду, що має формулу вищого оксиду RO3.
4. Назвіть елемент, розташований у IV групі, відносна молекулярна маса сполуки з Гідрогеном якого — 211.
Варіант III
1. Назвіть найактивніший метал 4 періоду.
2. Складіть формулу вищого оксиду елемента № 3.
3. Назвіть елемент 5 періоду, що має формулу сполуки з Гідрогеном HR.
4. Назвіть елемент, розташований у III групі, відносна молекулярна маса вищого оксиду якого дорівнює 102.
Варіант IV
1. Назвіть найактивніший метал IV групи головної підгрупи.
2. Складіть формулу леткої сполуки з Гідрогеном для елемента № 33.
3. Назвіть елемент 5 періоду, що має формулу вищого оксиду R2O7.
4. Назвіть елемент, розташований у І групі, відносна молекулярна маса гідроксиду якого дорівнює 40.
Варіант V
1. Назвіть найактивніший неметал 5 періоду.
2. Складіть формулу вищого оксиду елемента № 15.
3. Назвіть елемент 2 періоду, що має формулу сполуки з Гідрогеном RH4.
4. Назвіть елемент, розташований у IV групі, відносна молекулярна маса вищого оксиду якого дорівнює 60.
Варіант VI
1. Назвіть найактивніший неметал V групи головної підгрупи.
2. Складіть формулу леткої сполуки з Гідрогеном для елемента № 9.
3. Назвіть елемент 3 періоду, що має формулу вищого оксиду RO.
4. Назвіть елемент, розташований у III групі, відносна молекулярна маса вищого оксиду якого дорівнює 70.
12 балів. Один з передбачених Д. і. Менделєєвим елементів четвертого періоду утворює оксид, який містить 34,8 % Оксигену. Який це елемент?
III . Вивчення нового матеріалу.
1.Педагогічний програмний засіб.
Урок «Поняття про радіоактивність та будову атома»
2. Діяльність вчителя в ході використання ППЗ.
Вступне слово вчителя
Періодичний закон і періодична система хімічних елементів вплинули на розвиток науки й техніки: вони послужили теоретичним фундаментом спрямованого пошуку й відкриття за минуле століття 46 нових елементів зі 111 відомих сьогодні. Крім того, закон Д. І. Менделєєва став поштовхом до досліджень будови атома, які змінили наші уявлення про закони мікросвіту й привели до практичного втілення ідеї використання ядерної енергії.
Однак до моменту відкриття періодичного закону уявлення про молекули й атоми лише почали стверджуватися. Причому атом уважався не лише найменшою, але й елементарною (тобто неподільною) частинкою. Прямим доказом складності будови атома було відкриття мимовільного розпаду атомів деяких елементів, названа радіоактивністю. У 1896 р. французький фізик А. Беккерель виявив, що матеріали, які містять Уран, засвічують у темряві фотопластинку, іонізують гази, спричиняють світіння речовин, що флуоресціюють. Надалі з’ясувалося, що цю здатність має не лише Уран. Титанічні зусилля, докладені для переробки величезних мас уранової смоляної руди, дозволили П. Кюрі та М. Склодовській-Кюрі відкрити два нові радіоактивні елементи: Полоній і Радій.
У 1903 році П’єр і Марія Склодовська-Кюрі разом одержали Нобелівську премію з фізики за відкриття радіоактивності. Після смерті чоловіка М. Склодовська-Кюрі продовжила дослідження й у 1911 році за одержання чистого Радію була удостоєна Нобелівської премії в галузі хімії. Уівіть собі дамські рукавички, які завжди носила М. Склодовська-Кюрі, щоб прикрити руки, безжалісно понівечені Радієм. А поруч, не вмовкаючи, тріскотить лічильник Гейгера. Відвідувачі Всесвітньої виставки в Брюсселі ціпеніли, коли дивилися на ці рукавички. Ще в 1958 році — через півстоліття! — вони відчували від цих рукавичок не запах тонких парфумів, а «голос» того самого Радію, якого безстрашно торкалися руки відважної жінки.
Повідомлення учнів
1. Відкриття радіоактивності.
2. Досліди Резерфорда.
3. Роботи П. Кюрі та М. Склодовської-Кюрі.
Узагальнення вчителя (матеріал пропонується використати на уроці за наявності вільного часу)
Радіоактивність — це здатність деяких елементів випромінювати, такі елементи названі радіоактивними.
α-випромінювання — це випромінювання позитивно заряджених частинок (ядра Гелію 42He).
β-випромінювання — це випромінювання негативно заряджених частинок (електрони).
γ-випромінювання — це випромінювання електромагнітних хвиль. Випромінювання характеризується іонізуючою можливістю проникнення (визначається шляхом, який частинка може пройти в речовині до остаточної зупинки).
α-частинка — на 1 см2 утворюється 25 тис. пар іонів, довжина шляху — 2—3 см і зупиняється (від а-випромінювання може захистити картон).
β-частинка — на 1 см2 утворюється 100 тис. пар іонів, довжина шляху — кілька метрів (може захистити цегляна стіна).
γ-частинка — найбільша можливість випромінювання й довжина пробігу (можуть захистити двометрові стіни, свинець).
|
Умови випромінювання |
Доза |
Ефект |
|
Хронічне: упродовж кількох років |
0,5 Зв (50 Бер) |
Хронічна променева хвороба (катаракта — захворювання очей) |
|
Гостре одноразове |
>1 Зв (100 Бер) |
Гостра променева хвороба |
|
Гостре одноразове |
>450 Бер |
Смерть |
ГДД для людей: 0,1 Бер на рік.
Норми для продуктів харчування: від 50 до 100 Бк на 1 кг (кількість атомів, що розпадаються за одиницю часу).
У 1911 р. англійський учений Е. Резерфорд довів з допомогою досліду, що в центрі атома є позитивно заряджене ядро. Ядра атомів складаються з протонів і нейтронів (загальна назва — нуклони). Кількість протонів у ядрі дорівнює порядковому номеру елемента, а сума чисел протонів і нейтронів відповідає його масовому числу. Навколо ядра замкненими орбітами обертаються електрони. їх число дорівнює позитивному заряду ядра. Атом у цілому електронейтральний.
Нейтрон — нейтральна частинка, що не має електричного заряду.
Протон — позитивно заряджена частинка. Заряд протона дорівнює заряду електрона, але протилежний за знаком. І ті, й інші мають масу, що приблизно дорівнює 1 а.о.м.
Порядковий номер = заряд ядра атома = кількість протонів = кількість електронів
n = Аr - р
3.Діяльність учнів в робочих зошитах в ході використання ППЗ.
Атом це — ________________________________________________________
У 1911 р. Е. Резерфорд запропонував ядерну (або планетарну) модель будови атома.
Складові атома Протонне число___________
Нуклонне число (А)________
Ядро: протони (11р) +нейтрони ( 01n)= нуклони
АТОМ
електронна оболонка ►електрони (-10е)
Використовуючи підручник та знання з курсу хімії 7 класу, заповніть таблицю. Характеристика частинок, що входять до складу атома:
|
Частинка |
Місце розміщення в атомі |
Система атомних одиниць |
||
|
назва |
символ |
Маса, а. о. м. |
Заряд, о. е. з.* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Висновки.
|
Порядковий номер елемента (Z) в Періодичній системі вказує__________________________________________ |
Z = N(p+) = N(e) |
|
Заряд ядра позитивний і дорівнює______________________________________________________________________ |
N (p+) |
ІV.ЗВМ.
Виконання завдань в робочому зошиті:
1.Заповніть таблицю:
|
Маса атома зосереджена в_______ і дорівнює _________ |
А = N(р+) +N(01n) |
|
1 Кількість нейронів у ядрі дорівнює________________________ |
N(01n)=А- N(р+) |
|
Склад атома можна схематично представити так: 11Nа° [(11 р+ 12п°)+1111е]0 |
|
2. Зобразіть схематично склад атома будь-якого одного хімічного елемента. Періодичний закон Д. І. Менделєєва (сучасне формулювання):_____________
________________________________________________________________________________________________________________________________________
V. Підсумки.
- Ядро складається …
- Електронна оболонка розміщується навколо …
- Склад атомних ядер :__________
- Протонне число є основною характеристикою ___________.
VІ. Домашнє завдання
Опрацювати параграф 31
Вправа 3-4(1-6 бали), 3-5 (7-9 балів), 3-6(12 балів) стр.146
УРОК 5
Тема. Сучасне формулювання періодичного закону Ізотопи
Мета уроку: розширити знання про періодичний закон і періодичну систему хімічних елементів Д. І. Менделєєва; формувати поняття про ізотопи (стабільні й нестабільні); дати уточнене визначення поняттю «хімічний елемент» виходячи зі знань періодичного закону — фундаментального закону природи; дати сучасне формулювання періодичного закону
Тип уроку: засвоєння нових знань, умінь і навичок.
Форми роботи: розповідь учителя, фронтальна робота з навчальною літературою.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ППЗ.
ХІД УРОКУ
I. Організація класу
II.АОЗ, мотивація навчальної діяльності
1.Фронтальна бесіда.
— Чому явище радіоактивності було сприйняте як катастрофа періодичного закону й періодичної системи?
У результаті розпаду атомів радіоактивних елементів утворювалися атоми вже відомих елементів, але з іншими атомними масами. А періодична система була побудована на основному понятті «хімічний елемент» — це вид атомів з однаковою атомною масою. Але закон не можна знищити чи створити. Людина може лише відкрити закон! Система була вираженням закону природи.
III . Вивчення нового матеріалу.
1.Педагогічний програмний засіб.
Урок «Склад атомних ядер. Ізотопи стабільні та радіоактивні»
2. Діяльність вчителя в ході використання ППЗ.
У результаті експериментальних досліджень було встановлено, що, наприклад, у природному кисні, крім атомів Оксигену з масою 16, є також атоми Оксигену з масою 17 і 18. їх співвідношення таке:
![]()
Виявилося, що інші елементи також складаються з атомів з різною масою. Так, у природній воді, крім атомів Гідрогену з масою 1, є також атоми Гідрогену з масою 2; співвідношення чисел цих атомів таке:
![]()
В ядерних реакціях також одержано Гідроген з атомною масою 3: 31H. Причому «важка вода» шкідлива для живих організмів. Тож притчі про «живу» і «мертву» воду мають реальне наукове пояснення.
Учні розглядають таблицю «Ізотопи деяких елементів, виявлених у земній корі».
|
Назва елемента |
Число ізотопів |
Масові числа |
|
Гідроген |
3 |
1,2, 3 |
|
Оксиген |
3 |
16, 17, 18 |
|
Хлор |
2 |
35, 36 |
|
Кальцій |
6 |
40,42,43,44,46,48 |
|
Ферум |
4 |
54, 56, 57, 58 |
|
Уран |
3 |
234, 235, 238 |
Різновиди атомів того самого хімічного елемента, що мають однакове число протонів у ядрі, але різну масу, називають ізотопами. «Ізотоп» означає «той, що займає те саме місце».
Розглянемо характеристики ізотопів Гідрогену й Оксигену.
|
816О |
817О |
818О |
p1 = p2 = p3 N = 8, 9, 10 |
|
p = 8 |
p = 8 |
p = 8 |
|
|
e = 8 |
e = 8 |
e = 8 |
|
|
n = 8 |
n = 9 |
n = 10 |
|
|
|
|
|
|
|
11H (Протій) |
12H (Дейтерій) |
13H (Тритій) |
|
|
p = 1 |
p = 1 |
p = 1 |
|
|
e = 1 |
e = 1 |
e = 1 |
|
|
n = 1 – 1 = 0 |
n = 2 – 1 = 1 |
n = 3 – 1 = 2 |
|
У природі існують хімічні елементи ізобари — атоми, що мають однакове атомне число, але різні величини зарядів ядра, наприклад:
4018Аr і 4019К.
Атомні маси елементів у періодичній системі є середнім значенням масових чисел природних сумішей ізотопів. Тому вони не можуть, як пропонував Д. І. Менделєєв, служити головною характеристикою атома, а отже, й елемента. Такою характеристикою, як ми тепер знаємо, є заряд ядра. Він визначає число електронів у нейтральному атомі, які розподіляються цілком визначено навколо ядра. Характер же розподілу електронів визначає хімічні властивості атомів. Зазначені міркування дозволили дати нове визначення хімічного елемента:
Хімічний елемент — це сукупність атомів з однаковим зарядом ядра. А також уточнити формулювання періодичного закону:
Властивості елементів, а також властивості й форми їхніх сполук перебувають у періодичній залежності від заряду ядра атома елемента.
Чому ж атомні маси більшості елементів дробові? З'ясувалося, що слід розмежовувати поняття «відносна атомна маса» і «відносна атомна маса елемента». Значення відносних атомних мас ізотопів дуже близькі до цілих чисел. Відносні ж атомні маси елемента як сукупності ізотопів виражаються дробовими числами. Наприклад, відносна атомна маса елемента Хлору — 35,5. Відмінність цих понять неважко зрозуміти. Відносна атомна маса елемента розраховується з урахуванням масової частки ізотопів у природі.
Елемент Хлор складається з двох ізотопів з відносними атомними масами, дуже близькими до 35 і 37. Ізотопу 1735Сl в природній суміші міститься 15%, а ізотопу 1737Сl — 25 %. Звідси середня відносна атомна маса елемента Хлору дорівнює
Ar = 35 · 0,75 + 37 · 0,25 = 35,5
Отже, атомна маса елемента тим більша, чим більше важких ізотопів входить до складу елемента.
Можна пояснити аномалію в положенні в періодичній системі Калію й Аргону, розрахувавши їх відносну атомну масу з урахуванням природних ізотопів:
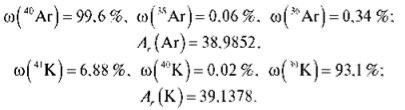
Ізотопи поділяються на стабільні й радіоактивні. Натрій, Алюміній, Флуор не мають стабільних ізотопів. У Стануму їх десять.
Якщо всі ізотопи елемента є радіоактивними, то його відносна атомна маса в періодичній системі зазначена у квадратних дужках. Розрізняють природні радіоактивні ізотопи (Уран) та ізотопи штучного походження — радіонукліди, що утворюються в результаті випробувань атомної зброї, під час роботи ядерних виробництв.
Небезпечні ізотопи: 3890Sr (заміщає в кістках Са), 35137Cs, 53113І. Радіоактивні ізотопи в процесі радіоактивного випромінювання розпадаються на атоми інших елементів, унаслідок чого відбувається ядерна реакція, що супроводжується шкідливим випромінюванням:
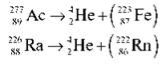
Швидкість радіоактивного випромінювання характеризується періодом напіврозпаду й може тривати від частки секунди до мільярдів років. Більш докладно явище радіоактивності ви вивчатимете в курсі фізики. У хімічних реакціях радіоактивні перетворення атомів не відбуваються.
3.Діяльність учнів в робочих зошитах в ході використання ППЗ.
ІЗОТОПИ
Атоми одного елемента містять однакову кількість протонів електронів, але не завжди однакову кількість нейтронів.
Ізотопи — це різновиди атомів одного хімічного елемента, які мають
Однаковий______________, але різні нуклонні числа (різну кількість_________)
Нуклід — це вид атомів з певним нуклонним числом.
Ізотопи — це нукліди одного елемента.
Позначення нуклідів:13Аl, де 13 – нуклонне число, 27- протонне число.
27
|
Приклади нуклідів |
Приклади ізотопів |
||
|
Позначення |
Назва |
Позначення |
Назва |
|
1531Р, або 31Р |
Фосфор-31 |
816О, або 8 16О |
Оксиген-16 |
Хімічний елемент____________________________________________________
___________________________________________________________________
ІV.ЗВМ.
Виконання завдань в робочому зошиті:
1. Заповніть таблицю за зразком:
|
Моделюємо ядро атома |
Кількість в атомі |
Нуклонне число, А |
Позначення нукліду |
Назва нукліду |
|
|
протонів |
нейтронів |
||||
|
|
1 |
0 |
1 |
11Н |
Гідроген-1. або Протій |
|
|
|
|
|
12Н |
|
|
|
|
|
|
13Н |
|
|
|
|
|
|
24Не |
|
|
|
|
|
|
|
Гелій-3 |
2.Задача. Елемент Хлор являє собою суміш ізотопів — нуклідів 35С1 і 37С1.
За поширенням у природі на перший припадає 75,4% усіх атомів Хлору, на другий — 24,6% . Обчисліть відносну атомну масу Хлору.
|
Дано: |
Розв’язання |
|
А1 = 35 Х1 = 75,4 % (0,754) А2 = 37 Х2 = 24,6 % (0,246) |
Аг (СІ) = 0,754 • 35 + 0,246 • 37 = 35,453 Відповідь: А r (СІ) = 35,5 |
|
А r (СІ) = ? |
3.Самостійна робота.
І варіант. Природний Бор складається з ізотопів 10В (атомна частка 19,57 %) і
11В (атомна частка 80,43 %). Визначте відносну атомну масу елемента.
ІІ варіант. Природний Купрум складається з ізотопів 63Си (атомна частка 73 %) і65Си (атомна частка 27 %). Визначте відносну атомну масу елемента.
|
Дано: |
Розв’язання |
|
|
|
4.«За» і «проти» використання ядерної енергії
|
Використання радіонуклідів |
Небезпека радіонуклідів |
|
|
|
V. Підсумки.
1. Чим формулювання періодичного закону, запропоноване Д. І. Менделєєвим, відрізняється від сучасного формулювання цього закону?
2. Як можна перетворити свинець на золото?
3. Що таке ізотопи? Як вони розміщаються в періодичній системі хімічних елементів?
4. Чому елементи з великою атомною масою в природі зустрічаються нечасто?
5. Що ще ви хотіли б дізнатися в цій темі?
VІ. Домашнє завдання
Опрацювати параграф 32
Вправа 2(4-6 бали), 3 (7-9 балів), 5(12 балів) стр.151
УРОК 6
Тема: Стан електронів у атомі. Поняття про радіус атома.
Мета уроку: ознайомити учнів з рухом електронів у атомах; увести нові поняття (електронна орбіталь, енергетичний рівень, квантові числа, напрямок орбіталі в просторі, спін); показати учням двоїсту природу електрона, утворення орбіталей під час руху електронів навколо ядра; пояснити істотну відмінність між хімічною та ядерною реакціями, дати поняття про радіус атома.
Тип уроку: засвоєння нових знань.
Форми роботи: фронтальне опитування, розповідь учителя, робота з навчальною схемою.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, проектор, навчальна схема,ППЗ.
ХІД УРОКУ
I. Організація класу
II.АОЗ, мотивація навчальної діяльності
1. Вправа «Мікрофон»
1. Дайте сучасне формулювання періодичного закону.
2.Чи суворо регламентовано будовою атома положення кожного елемента в періодичній системі.
3. Заповніть таблицю:
Зв’язок періодичної системи й будови атома
|
Поняття в періодичній системі |
Визначення |
Зв’язок з будовою атома |
|
Порядковий номер елемента |
|
|
|
Період |
|
|
|
Група |
|
|
|
Відносна атомна маса |
|
|
|
Порядковий номер елемента |
Число, що визначає положення елемента в періодичній системі |
Заряд ядра, число протонів, число електронів |
|
Період |
Горизонтальний ряд хімічних елементів у періодичній системі |
? |
|
Група |
Вертикальний ряд хімічних елементів у періодичній системі |
? |
|
Відносна атомна маса |
Фізична величина, що показує, у скільки разів маса атома більша, ніж маса атома 12С |
Сума протонів і нейтронів |
У таблиці залишилися два питання, які ми заповнимо протягом уроку. А для цього нам необхідно розглянути, як поводиться електрон в атомі та що залежить від радіуса атома.
III . Вивчення нового матеріалу.
1.Педагогічний програмний засіб.
Урок «Поняття про радіус атома. Рух електронів в атомі»
2. Діяльність вчителя в ході використання ППЗ.
1.Поняття про радіус атома.
Атомний радіус для вільного атома визначається розмірами його електронної оболонки і дорівнює середній відстані між ядром атома та найвіддаленішою орбітальною електронною оболонкою атома.
Радіуси атомів залежать від____________________________________________
1. Зміна радіусів атомів у періодах.
Наприклад, заряд ядра атома Натрію +11, і на зовнішньому рівні він іу (заряд = -1), а заряд ядра атома Хлору +17, і на зовнішньому рівні він л (сумарний заряд = -7). Чим більші заряди, тим більші сили притяганні ними і, як наслідок, менша відстань між зарядженими частинками, між ядром і зовнішніми електронами.
Висновок. У періодах із зростанням заряду ядра радіуси атомів _____________
2.Зміна радіусів атомів у групах.
Наприклад, елементи Літій та Рубідій розміщуються в одній і тій самій групі та підгрупі, мають по 1 електрону на зовнішньому рівні, але різняться кількістю енергетичних рівнів.
Висновок. У головних підгрупах із зростанням заряду ядра (зверху вниз) радіуси атомів _______________________________________________________
2. Стан електронів в атомі.
Електрон — це частинка, маса спокою якої — mе = 9,1 · 10-31 кг, заряд — qe = —1,6 · 10-19 Кл.
У теорії будови атома Резерфорда передбачалося, що рух електрона навколо ядра відбувається за певною траєкторією — орбітою, і в кожен момент часу ми можемо знайти його. Але насправді це було помилкою. Виявилося, що рух електрона значно складніший. Швидкість його обертання навколо ядра настільки велика, що в масштабах атома поняття траєкторії втрачає зміст. Тому не можна розглядати електрон як частинку, що рухається та положення якої в просторі точно відоме в будь-який момент часу. Можна лише вказати деяку частину простору навколо ядра, в якому перебування електрона є найбільш імовірним. Ця частина простору навколо ядра називається електронною хмариною, або електронною орбіталлю.
Електронна орбіталь — це простір навколо ядра атома, в якому найбільш імовірне перебування електрона.
Електронні орбіталі різняться за формою й напрямком у просторі. (Проектуємо на екран або показуємо на плакаті форми електронних орбіталей.) Ці електронні орбіталі різної форми позначаються літерами s, р, d,f.
Для опису форми орбіталей використовують орбітальне квантове число 1. Воно набуває позитивних цілочислових значень від 0:
l = 0— сферична форма електронної орбіталі (s-орбіталь);
l = 1 — гантелеподібна форма електронної орбіталі (p-орбіталь);
l = 3 — d-орбіталь;
l = 3 — f-орбіталь.
Електронні орбіталі, що є більш складними, ніж f-орбіталі, в атомах, описаних у періодичній системі на сьогодні, не використовуються.
Положення орбіталі в просторі можна визначити в системі координат. Орієнтація орбіталі в просторі описується магнітним квантовим числом ml. Умовно кожен підрівень поділяється на квантові комірки за напрямками орбіталі в просторі.
На s-підрівні така квантова комірка лише одна, умовно позначається □ або _.
На p-підрівні їх три ![]()
На d-підрівні їх п'ять ![]()
На f-підрівні їх сім ![]()
Кожна квантова комірка може розмістити лише два електрони. Крім руху навколо ядра, електрон має ще і власний обертовий рух навколо своєї осі. Цей рух описує спінове квантове число (або спін, від слова «веретено»). Набуває два значення: +1/2 або -1/2. Для запису ми використовуємо умовну позначку електронів ![]() або
або ![]() .
.
У квантовій комірці можуть знаходитись або один електрон, або два електрони, але з протилежними спінами ![]() .
.
Рух електрона в атомі складніший, ніж здається на перший погляд. Сьогодні ми спробували відповісти на деякі питання руху електронів у атомі.
• Чому негативні електрони не падають на позитивно заряджене ядро? (Тому що електрони обертаються навколо ядра з величезною швидкістю)
• Що необхідно електрону, щоб обертатися з такою швидкістю й утримуватися біля ядра, а не полетіти? (Відповідний запас енергії)
Моделі атомів передбачають розташування електронів на різних відстанях від ядра. Електрони з більшими чи меншими запасами енергії розташовуватимуться ближче до ядра?
Енергія розподіляється між електронами порціями. Тому розташування електронів навколо ядра обмежується енергетичними рівнями. Кількість енергетичних рівнів у атомі описується головним квантовим числом п і дорівнює номеру періоду, в якому знаходиться атом.
Наприклад: 126С +6 )2 )4
ІV.ЗВМ.
Діяльність учнів в робочих зошитах.
1.Будова електронних оболонок атомів хімічних елементів
Доповніть речення:
Електрон — це_____________________________________________________
Кількість електронів в атомі завжди дорівнює___________________________
Рух електрона в атомі не можна описати певною траєкторією, а можна лише розглядати певний об’єм простору навколо ядра, в якому перебуває електрон.
Атомна орбіталь — це________________________________________________
Заповнення електронами енергетичних рівнів відбувається поступово, в по рядку зростання енергії електронів:
- у межах одного рівня першим заповнюється s-підрівень, а другим р-підрівень;
- спочатку електронами заповнюється перший енергетичний рівень, потім другий, після його заповнення починає заповнюватися третій рівень
Використовуючи схему 1, обчисліть максимальну кількість електроні кожному енергетичному рівні та підрівні, заповніть таблицю:
|
Номер енергетичного рівня, п |
1 |
2 |
3 |
4 |
|
Можливі підрівні в межах рівня |
|
|
|
|
|
Максимальна кількість електронів на енергетичному рівні (2п ), та підрівнях (у дужках) |
|
|
|
|
|
|
|
|
|
|
Зразок |
1s22s22р2 |
|
|
|
6С(+6) 2) 4) |
[Не] 2s22р2 |
|
|
|
Схема |
Електронна |
|
|
|
будови атома |
формула |
|
|
Електрони останнього (зовнішнього) енергетичного рівня називають валентними, вони визначають валентні можливості та властивості елемента.
Кількість електронів на зовнішньому енергетичному рівні в атомах елементів головних підгруп збігається з номером групи.
V. Домашнє завдання
Опрацювати параграф 33-34, вивчити висновки в зошиті стр.87.
Тема. Будова електронних оболонок атомів. Енергетичні рівні й підрівні
Мета уроку: розширити уявлення учнів про будову атомів; навчити складати електронні формули, схеми розподілу електронів по квантових комірках для елементів I—III періодів; формувати вміння учнів визначати електронну будову атома за його положенням у періодичній системі; формувати уявлення учнів про єдину природу матеріального світу.
Тип уроку: засвоєння вмінь і навичок.
Форми роботи: розповідь учителя, фронтальна бесіда, індивідуальна робота.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва,
ППЗ.
ХІД УРОКУ
I. Організація класу
II.АОЗ, мотивація навчальної діяльності
1.Фронтальна бесіда
• Як визначити кількість електронів у атомі?
• Чому атоми електронейтральні, адже вони складаються з позитивних протонів, негативних електронів і нейтральних нейтронів?
• Чому говорять, що електрон має двоїсту природу?
• Чи всі електрони в атомі однакові?
• Чим вони відрізняються?
• Що таке орбіталь?
• Які форми може мати електронна хмарина?
• Яка максимальна кількість електронів може перебувати:
♦ на s-підрівні;
♦ на p-підрівні;
♦ на d-підрівні?
• Як розподіляються електрони в атомі?
• Яка кількість енергетичних рівнів може бути в атомі?
• Як визначити їх кількість за положенням у періодичній системі?
• Як визначити кількість електронів на зовнішньому енергетичному рівні?
• Як розподіляються електрони по енергетичних рівнях?
2. Перевірка домашнього завдання – обговорення висновків.
- У межах одного періоду зі зростанням заряду ядра добавляється по одному електрону на зовнішньому рівні, й властивості простих речовин плавно змінюються від металічних до неметалічних.
- Під час переходу з одного рівня на інший спостерігається різкий стрибок у зміні властивостей, тому що утворюється новий рівень, який тільки починає заповнюватися.
- Причиною періодичної повторюваності властивостей хімічних елементів та утворених ними сполук є те, що періодично повторюється кількість електронів на зовнішньому енергетичному рівні.
- Зовнішня 8-електронна оболонка є для атома вигідною й стійкою (<електронний октет»)-
- Кожний атом намагається заповнити свій зовнішній енергетичний рівень і набути оболонку інертного елемента.
- Чим більше електронів на зовнішньому енергетичному рівні, тим легше атом приєднуватиме електрони, яких не вистачає до завершення, від інших атомів у сполуці й набуватиме електронної оболонки наступного інертного елемента.
Для атомів неметалічних елементів характерна здатність приєднувати електрони на зовнішній рівень (неметалічні властивості).
- Чим менше електронів на зовнішньому рівні (1, 2, 3 е), тим легше атом віддаватиме свої зовнішні електрони іншим атомам у сполуці й набуватиме електронної оболонки попереднього інертного елемента.
Для атомів металічних елементів характерна здатність віддавати зовнішні електрони (металічні властивості).
- Інертні елементи, атоми яких мають завершений зовнішній енергетичний рівень, не можуть віддавати або приєднувати електрони, тому вони хімічно неактивні й не можуть сполучатися один з одним та іншими елементами.
III . Вивчення нового матеріалу.
1.Педагогічний програмний засіб.
Урок « Будова електронних оболонок атомів елементів І-ІІІ періодів»
2. Діяльність вчителя в ході використання ППЗ.
На енергетичних рівнях розташовуються електрони з близьким значенням енергії.
На кожному енергетичному рівні може перебувати суворо визначене число електронів. Максимальна кількість електронів на кожному рівні обчислюється за формулою: N = 2n2.
Разом з учнями заповнюємо таблицю.
|
Номер рівня |
Максимальна кількість електронів |
Підрівні |
|
1 |
2 |
s |
|
2 |
8 |
s, p |
|
3 |
18 |
s, p, d |
|
4 |
32 |
s, p, d, f |
|
5 |
50 |
s, p, d, f g |
Разом з учнями записуємо формулу заповнення електронами орбіталей. 3.Діяльність учнів в робочих зошитах ході використання ППЗ.
Доповніть речення:
- З погляду електронної будови атомів поясніть, чому 1-й період містить два елементи.
- Як змінюється будова зовнішнього енергетичного рівня атомів елементі
періоду зі зростанням заряду ядра?
- Як змінюється будова зовнішнього рівня атомів елементів 3-го періоду? _
- Порівняйте будову електронних оболонок атомів Літію, Натрію та Калію.
- Порівняйте будову електронних оболонок атомів Флуору та Хлору.
- Знайдіть подібні ознаки будови зовнішніх енергетичних рівнів атомів Неону та Аргону.
VІ.ЗВМ.
1.Показати електронну будову атомів елементів 3-4 періодів – 2-3 елементи.
2. За допомогою схем будови атомів та електронних формул поясніть:
1) на яку частинку перетвориться атом Магнію, якщо він віддасть свої два зовнішні електрони – на дошці виконує вчитель;
2)атом Натрію, якщо він віддасть свій зовнішній електрон;
3) атом Сульфуру, якщо він приєднає на свій зовнішній рівень 2 електрони.
V. Домашнє завдання
Опрацювати параграф 35, впр.3,4 стр. 165, впр.5(на 12 балів)
УРОК 8
Тема. Будова електронних оболонок атомів
Мета уроку: розвивати навички складання електронних формул, схем розподілу електронів по квантових комірках для елементів I—III періодів; продовжити формування вмінь і навичок учнів з визначення електронної будови атома за його положенням у періодичній системі та знаходження хімічних елементів у періодичній системі за електронною формулою атома; формувати уявлення учнів про завершений і незавершений енергетичний рівень, заповнену, вільну квантову комірку.
Тип уроку: застосування знань, умінь і навичок.
Форми роботи: групова робота, самостійна робота.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва.
ППЗ.
ХІД УРОКУ
I. Організація класу
II.АОЗ, мотивація навчальної діяльності
1.Робота в парах
Пропонуємо учням з наведених формул вибрати елементи, в яких зовнішній енергетичний рівень цілком заповнений електронами (завершений).
Це Гелій, Неон, Аргон — інертні елементи.
— Який енергетичний рівень можна вважати завершеним?
Решта атомів у цій таблиці має незавершений зовнішній енергетичний рівень.
Пропонуємо учням за схемами будови атомів і розподілом електронів по квантових комірках вибрати хімічні елементи, в яких на зовнішньому рівні є вільні квантові комірки. (Учні по черзі називають елементи, правильні відповіді записуємо на дошці.)
Літій — три комірки.
Бор — дві комірки.
Карбон — одна комірка.
А тепер підрахуйте, скільки в цих атомах квантових комірок, що містять два спарені електрони. За результатами досліджень на уроці заповнюємо таблицю:
|
Назва елемента |
Кількість вільних комірок |
Кількість спарених електронів |
Кількість неспарених електронів |
|
Літій |
3 |
1 |
1 |
|
Берилій |
3 |
2 |
- |
|
Бор |
1 |
2 |
1 |
|
Карбон |
- |
2 |
2 |
|
Нітроген |
- |
2 |
3 |
|
Оксиген |
- |
3 |
2 |
|
Флуор |
- |
4 |
1 |
|
Неон |
- |
5 |
- |
Завдання для самостійної роботи. На прикладі цих елементів доповніть таблицю хімічними елементами IV періоду.
III. Застосування знань, умінь і навичок
Керована практика
Завдання 1. За електронною формулою хімічного елемента знайдіть цей елемент у періодичній системі, назвіть його:
a) 1s12s12p1;
б) 1s22s1;
в) 1s22s22p13s23p2;
г) 1s22s22p6.
Завдання 2. Хімічний елемент розташований у III періоді, VI групі. Напишіть схему будови й електронну формулу цього елемента.
Завдання 3. Укажіть, які елементи мають нижченаведений розподіл електронів по енергетичних рівнях:
а) 2е1е;
б) 2е2е;
в) 2е8еЗе.
Завдання 4. Запишіть рівняння реакції між простими речовинами, утвореними елементами А і Б, атоми яких мають такі електронні формули:
A - 1s22s22p63s2;
Б - 1s22s22р63s23р5.
Завдання 5. Подумайте, скільки різних видів молекул карбон(ІV) оксиду можна скласти з ізотопу 12С і трьох ізотопів Оксигену: 16О, 17O, 18O. Обчисліть молярні маси цих оксидів.
IV. Керована практика
(Самостійна робота за варіантами)
Варіант І
1. Визначте положення атомів у періодичній системі хімічних елементів та обчисліть число протонів, нейтронів, електронів в атомах елементів:
а) Карбон;
б) Калій;
в) Ферум.
2. Напишіть схему будови атома й електронну формулу запропонованих атомів, укажіть кількість вільних квантових комірок, кількість спарених і неспарених електронів:
а) Оксиген;
б) Фосфор;
в) Магній.
3. Просту речовину, утворену хімічним елементом, електронна формула зовнішнього енергетичного рівня якого — ...3s23p1, спалили в кисні масою 3,2 г. Обчисліть масу простої речовини, що витратили в результаті реакції.
Варіант II
1. Визначте положення атомів у періодичній системі хімічних елементів та обчисліть число протонів, нейтронів, електронів в атомах елементів:
а) Хлор;
б) Кальцій;
в) Кобальт.
2. Напишіть схему будови атома й електронну формулу запропонованих атомів, укажіть кількість вільних квантових комірок, кількість спарених і неспарених електронів:
а) Алюміній;
б) Берилій;
в) Неон.
3. Просту речовину, утворену хімічним елементом, електронна формула зовнішнього енергетичного рівня якого — ...3s23р3, спалили в кисні масою 3,2 г. Обчисліть масу простої речовини, що витратили в результаті реакції.
V. Підбиття підсумків уроку
1. Які питання у вас викликали запропоновані завдання?
2. Що ще ви хотіли б дізнатися про будову атомів?
3. Чи можна вважати протон, нейтрон, електрон неподільними частинками? (Ні, але ці питання вивчає ядерна фізика. Перетворення, що відбуваються в результаті хімічних реакцій, стосуються лише електронної будови атомів.)
Опрацювати параграф 35
Творче завдання. Підготувати повідомлення про сучасні дослідження з вивчення будови атомів.
УРОК 9
Тема: Взаємозв'язок між розміщенням елементів у періодичній системі та властивостями хімічних елементів, простих речовин, сполук елементів з Гідрогеном і Оксигеном
Мета уроку: розширити знання про взаємозв'язок між розміщенням хімічних елементів у періодичній системі, будовою їхніх атомів та їх фізичними й хімічними властивостями; показати залежність між положенням хімічного елемента в періодичній системі хімічних елементів і складом, будовою і властивостями простих речовин, утворених цими елементами, складом, будовою і властивостями сполук цих елементів із Гідрогеном і Оксигеном.
Тип уроку: застосування знань, умінь і навичок.
Форми роботи: хімічний диктант, робота в парах, фронтальна евристична бесіда.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця електронегативностей, ППЗ.
ХІД УРОКУ
I. Організація класу
II.АОЗ, мотивація навчальної діяльності
Хімічний диктант (робота з періодичною таблицею)
1. Назвіть елемент II періоду, що має на зовнішньому енергетичному рівні два електрони.
2. Назвіть елемент III групи, останній заповнюваний електронами енергетичний рівень якого — третій.
3. Назвіть елемент, у якого на п'ятому енергетичному рівні знаходиться один електрон.
4. Назвіть елемент, у якого на другому зовнішньому енергетичному рівні знаходиться п'ять електронів.
5. Назвіть елемент III періоду, що в сполуках з Гідрогеном проявляє валентність
6. Назвіть елемент IV періоду, що має завершений зовнішній енергетичний рівень.
7. Назвіть елемент III періоду, який у сполуках з Оксигеном має вищу валентність IV.
8. Назвіть елемент VI групи, останній заповнюваний електронами енергетичний рівень якого — другий.
9. Назвіть елемент III періоду, що має один валентний електрон.
10. Назвіть елемент головної підгрупи VI групи, що має п'ять енергетичних рівнів.
III . Вивчення нового матеріалу.
1.Педагогічний програмний засіб.
Урок «Залежність властивостей елементів від періодичної зміни електронних структур атомів»
2. Діяльність вчителя в ході використання ППЗ.
— Розкажіть, як змінюються властивості хімічних елементів у періодах і групах.
У періодах
На початку періоду розташовуються типові метали. Назвіть їх.
На зовнішньому енергетичному рівні — один-два електрони. Поступово в періоді зліва направо зі збільшенням порядкового номера металічні властивості слабшають і зрештою зникають, поступаючись місцем неметалічним.
Метали можуть легко віддавати електрони, що знаходяться на зовнішньому рівні. Ця властивість також поступово слабшає, елементи втрачають здатність витісняти з кислот і з води водень, утворювати основні оксиди й основи. І навпаки, з'являється здатність утворювати кислотні оксиди й кислоти, леткі водневі сполуки та інші характерні для неметалів властивості.
У кінці періодів розміщуються типові неметали. Назвіть їх.
На зовнішньому рівні знаходяться переважно чотири-сім електронів. Цей перехід від металів до неметалів зі зростанням порядкового номера елемента в періоді відбувається поступово. При цьому в деяких елементів у середині періоду зберігаються ознаки металів і одночасно з'являються властивості неметалів. Сполуки цих елементів проявляють амфотерні властивості: Алюміній, Скандій, Титан.
У чому ж причина такої послідовної зміни властивостей у періоді? У зміні будови атома.
Хімічні властивості елементів визначаються поводженням електронів зовнішнього енергетичного рівня.
Якщо на зовнішньому рівні атома мало електронів (один-три), то він у процесі утворення хімічних сполук може легко віддавати електрони, тобто проявляє металічні властивості. Якщо ж на зовнішньому рівні багато електронів (чотири-сім), атом легко приймає ще електрони до завершення цього енергетичного рівня, тобто проявляє неметалічні властивості. Максимальна кількість електронів на зовнішньому рівні — вісім. Такий енергетичний рівень мають інертні елементи. Назвіть їх.
Здатність атомів віддавати та приєднувати електрони кількісно визначається електронегативністю атомів (американський учений Полінг, 1932 p.).
Електронегативність — фізична величина, що показує здатність атомів певного елемента притягувати до себе електрони атомів інших хімічних елементів у хімічних сполуках. (Розглядаємо з учнями таблицю електронегативностей хімічних елементів.)
Умовно за одиницю прийнято електронегативність Літію. Відповідно розраховано решту. Найбільшу електронегативність має атом Флора — 4,1. Електронегативність зменшується в періодах справа наліво, у групах — згори вниз. Аналогічно змінюються металічні й неметалічні властивості елементів. У періодах посилюються неметалічні та слабшають металічні властивості, у групах слабшають неметалічні й посилюються металічні властивості.
3.Діяльність учнів в робочих зошитах в ході використання ППЗ.
Доповніть речення: У періодах зліва направо атомні радіуси елементів _____,
а в головних підгрупах зверху вниз______________________________________
І. Зміна металічних і неметалічних властивостей елементів.
Завдання 1. Запишіть електронні формули зовнішнього енергетичного рівня атомів елементів 3-го періоду:
|
Номер групи |
І |
II |
III |
IV |
V |
VI |
VII |
VIII |
|
Елемент |
Nа |
Mg |
А1 |
Sі |
Р |
S |
Cl |
Аг |
|
Електронна формула |
|
|
..Зs23s1 |
|
|
|
|
|
|
|
Металічні елементи |
Неметалічні елементи |
||||||
Доповніть речення: У періодах зліва направо кількість електронів на зовнішньому рівні______________ , а атомний радіус___________________ ,
тому здатність віддавати електрони______________ , а здатність приєднувати
електрони________________________.
Висновок. Металічний характер елементів і хімічна активність металів у періодах зліва направо___________, а неметалічний характер елементів і хімічна активність неметалів _____________________________________.
Завдання 2. Запишіть електронні формули атомів елементів головної підгрупи І групи:
У головних підгрупах зверху вниз кількість електронів на зовнішньому
рівні __________________, а атомний радіус ________. Чим далі від
ядра розміщені зовнішні електрони, тим легше вони відриваються і, навпаки, важче приєднуватимуться електрони, яких не вистачає до завершення енергетичного рівня.
Висновок. Металічний характер елементів і хімічна активність металів у
головних підгрупах зверху вниз _______________, а неметалічний
характер елементів і хімічна активність неметалів________________________
II. Зміна властивостей вищих оксидів елементів та відповідних гідратів.
Лабораторний дослід 11.
Дослідження характеру гідратів оксидів натрію, алюмінію, сульфуру(ІV)
Мета:_________________________________________________________________________________________________________________________________
ХІД РОБОТИ
- У пробірку з 1-2 мл розчину натрій гідроксиду добавте краплю фенолфталеїну (ф/ф) та долийте хлоридної кислоти (стежте за зміною кольору індикатору).
- У пробірку налийте 1-2 мл розчину алюміній хлориду і добавляйте по краплинах розчин лугу до утворення драглистої маси. Вміст пробірки розділить на дві частини. До першої добавте розчин лугу до повного зникнення осаду, а до другої — розчин кислоти. Поясніть, чому в обох пробірках зник осад.
- У пробірку з 1-2 мл розчину сульфатної кислоти добавте краплю лакмусу и долийте розчин лугу (спостерігайте за зміною кольору індикатору).
Результати досліджень запишіть у таблицю. У висновку зазначте, який характер мають досліджені вами гідрати оксидів (основний, кислотний чи амфотерний).
|
Речовина, яку досліджують |
Реактив № 1 |
Спостереження |
Реактив № 2 |
Спостереження |
Висновки |
|
NаОН |
Ф/ф |
|
HCl |
|
|
|
А1(ОН)3 |
NаОН |
|
н2Sо4 |
|
|
|
Н2S04 |
Лакмус |
|
NаОН
|
|
_ |
Рівняння реакцій:_____________________________________________________
________________________________________________________________________________________________________________________________________
Завдання 3. Напишіть формули вищих оксидів та відповідних гідратів для елементів 3-го періоду і порівняйте основні й кислотні властивості цих сполук:
|
Елемент |
Nа |
Mg |
А1 |
Si |
Р |
S |
СІ |
|
Формула оксиду |
|
|
- ^ |
Зразок. Si |
|
|
|
|
Тип оксиду |
|
|
|
кислотний |
|
|
|
|
Відповідний гідрат оксиду |
|
|
|
Н2SіОз |
|
|
|
|
Сила основи або кислоти |
|
|
|
Слабка кислота |
|
|
|
Висновок. У періодах зліва направо основні властивості вищих оксидів та їх гідратів , а кислотні властивості .
Завдання 4. Запишіть формули вищих оксидів елементів головної підгрупи III групи та порівняйте основні й кислотні властивості цих сполук.
Висновок. У головних підгрупах зверху вниз основні властивості вищих оксидів та відповідних їм гідратів _____________________________________,
а кислотні властивості —______________________________________________
|
Елемент |
Формула оксиду |
Характер оксиду |
|
В |
|
|
|
А1 |
|
|
|
Ga |
|
|
|
In |
|
|
|
ТІ |
Tl2O3 |
Основний |
III. Сполуки елементів з Гідрогеном.
У Періодичній системі хімічних елементів міститься інформація про леткі сполуки елементів з Гідрогеном. Які елементи утворюють такі сполуки? Робота з таблицею «Сполуки елементів 3-го періоду з Гідрогеном».
|
Елемент |
Na |
Mg |
A1 |
Si |
P |
S |
Cl |
|
Формула сполуки |
NaH Na+H- |
MgH2 Mg2+H2- |
A1H3 |
SiH4 |
PH3 |
H2S |
HC1 |
|
Будова |
Й о н н а |
Атомна |
Молекулярна |
||||
|
Агрегатний стан |
Тверда речовина |
|
Газ |
|
|||
Висновок. 1. Елементи І—III груп головних підгруп Періодичної системи утворюють тверді гідриди, які за властивостями та будовою нагадують солі.
2. Сполуки типових неметалічних елементів з Гідрогеном складаються з молекул, це переважно газуваті речовини.
ІV.ЗВМ.
Виконання завдань в робочому зошиті:
Самостійна робота.
- Укажіть найактивнішій лужний елемент (І варіант); (і бал) найактивнішій металічний елемент 3-го періоду (II варіант):
ANa Б Cs BAI Г Fr Д Mg
- Укажіть найактивнішій неметалічний елемент 3-го періоду (І варіант); найактивнішій неметалічний елемент VII групи (II варіант):
АР Б Cl ВІ Г F Д Si
- У якої зі сполук основні (або кислотні) властивості виражено яскравіше? (2 бали) Підкресліть відповідну формулу:
І варіант. А Nа2O чи К2O Б Р205 чи С1207 В Н2S04 чи Н2 SеО4
ІІ варіант. А LіОН чи КОН Б SiO2 чи S03 В MgO чи ВаО
- Порівняйте металічні та неметалічні властивості в парах елементів
(2 бали) (відповідь обґрунтуйте з погляду електронної будови атомів):
І варіант. А Магній і Кальцій
II варіант. А Літій і Калій
Б Фосфор і Хлор Б Флуор і Нітроген
- За допомогою рівнянь хімічних реакцій доведіть: (2 бали)
І варіант, основні властивості барій оксиду
ІІ варіант, кислотні властивості сульфур(УІ) оксиду
- Напишіть рівняння реакцій, які підтверджують амфотерні властивості:
(3 бали)
І варіант. плюмбум(ІІ) оксиду
II варіант. берилій гідроксиду
Для кмітливих (12 балів)
Елемент утворює летку сполуку з Гідрогеном складу ЕН3. Атом цього елемента має на один енергетичний рівень більше, ніж атом найактивнішого неметаліч- ного елемента. Знайдіть цей елемент та складіть електронну формулу його атома в основному та збудженому станах. Які його валентні можливості?
V. Підсумки.Учитель підбиває підсумки роботи учнів на уроці, оцінює роботу учнів.
VІ. Домашнє завдання.Опрацювати параграф 35.
УРОК 10
Тема. Структура періодичної системи у світлі теорії будови атома
Мета уроку: розширити знання учнів про періодичну систему хімічних елементів; на підставі знань про будову атома й будови електронних оболонок атомів показати взаємозв’язок між розміщенням хімічних елементів у періодичній системі та їхніми властивостями; показати взаємозв’язок періодичної зміни електронних структур атомів хімічних елементів та їх властивостей.
Тип уроку: узагальнення й систематизація знань.
Форми роботи: фронтальне опитування, виконання тренувальних вправ.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання, актуалізація опорних знань
1.Фронтальне опитування (робота з періодичною системою хімічних елементів Д. І. Менделєєва)
1. Скільки енергетичних рівнів, заповнених електронами, мають атоми елементів з порядковими номерами:
а) 17;
б) 29;
в) 42?
Складіть схему будови атома й електронну формулу.
2. Напишіть електронні формули елементів:
а) Фосфор;
б) Калій;
в) Аргон;
г) Магній;
д)* Скандій.
3. Розподіліть на p-підрівні:
а) три електрони;
б) чотири електрони;
в) шість електронів.
4. Електронна формула атома має закінчення ...3р3. Напишіть повну електронну формулу цього елемента, визначте його порядковий номер і назву.
5. Складіть схему взаємозв'язку понять у періодичній системі й будови атомів. (Учні під керівництвом учителя складають схему.)
|
Поняття в періодичній системі |
Будова атома |
|
А. Порядковий номер елемента |
а) Величина заряду ядра; б) кількість протонів; в) кількість електронів |
|
Б. Номер періоду |
Число енергетичних рівнів, головне квантове число |
|
В. Номер групи |
а) Максимальна кількість електронів у атомі, які можуть брати участь в утворенні хімічних зв’язків (валентні електрони); б) для елементів головних підгруп — кількість електронів на зовнішньому рівні |
|
Г. Зміна властивостей у періодах |
а) Зростає заряд ядра — зростає порядковий номер; б) збільшується кількість електронів на зовнішньому рівні; в) збільшується сила притягання електронів зовнішнього рівня до ядра; г) число енергетичних рівнів однакове; д) спостерігається стискання енергетичних рівнів, радіус атомів незначною мірою зменшується; е) чим більша кількість електронів на зовнішньому рівні, тим важче атому віддавати електрони й тим легше приєднувати електрони інших атомів |
|
Д. Зміна властивостей у групах |
а) Зростає заряд ядра — зростає порядковий номер; б) збільшується число енергетичних рівнів; в) кількість електронів на зовнішньому рівні однакова; г) розмір атома збільшується; д) слабшає сила притягання електронів зовнішнього рівня до ядра; е) чим більший радіус атома й менша кількість електронів, тим легше атом віддає електрони й важче приєднує електрони інших атомів |
6. Інертні елементи мають таку електронну формулу зовнішнього енергетичного рівня: ns2np6. Запишіть електронні формули атомів Неону й Аргону. Проаналізуємо ці формули.
• Скільки вільних квантових комірок на зовнішньому рівні?
• Яка кількість неспарених електронів?
• Скільки пар електронів на зовнішньому рівні?
• Скільки електронів може приєднати атом?
• Чому?
Тому що зовнішній енергетичний рівень атомів Неону й Аргону завершений.
III. Практика на прикладах
Завдання 7. Складіть схему будови атома Натрію та іона Na+.
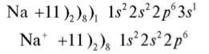
Схема будови якого атома така сама, як і іона Натрію?
Завдання 8. Складіть схему будови атома Флуору та іона F-.
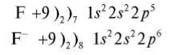
Схема будови якого атома така сама, як і іона Флуору?
Завдання 9. Самостійно побудувати схему будови атома та іона:
а) Магнію;
б) Хлору
Завдання 10. Подумайте і складіть схему будови іонів S-2, S+4, S+6. Порівняйте будови атома Сульфуру та іонів Сульфуру. Чим вони відрізняються? Чим вони подібні?
Завдання 11. У періодичній системі групи поділяються на головні й побічні. Вони включають елементи, подібні за будовою атома.
Елементи, в яких останній заповнюваний підрівень — s, називають s-елементами. В яких групах розташовуються s-елементи? (У I, II групах, головній підгрупі)
Завдання 12. Використовуючи періодичну систему хімічних елементів, наведіть приклади p-елементів.
Елементи, в яких останній заповнюваний електронами підрівень — р, називають p-елементами. В яких групах періодичної системи перебувають p-елементи? (У III—VIII групах, головній підгрупі)
Завдання 13. Використовуючи періодичну систему хімічних елементів, наведіть приклади p-елементів.
У побічних підгрупах розташовані елементи, в атомах яких електронами заповнюється (d-підрівень, — це d-елементи. На зовнішньому рівні в атомах цих хімічних елементах перебуває один-два s-електрони. Скільки таких елементів може бути в кожному періоді періодичної системи? Чому? Тому що максимальна кількість електронів на d-підрівні — 10.
Завдання 14. Використовуючи періодичну систему хімічних елементів, наведіть приклади d-елементів.
У нижній частині таблиці окремо розташовані два ряди хімічних елементів, що називаються лантаноїди й актиноїди. В якому періоді вони мають розташовуватися? Скільки таких елементів у кожному періоді? Чому? Елементи лантаноїди й актиноїди відрізняються від решти хімічних елементів тим, що в них заповнюється електронами f-підрівень, максимальна кількість електронів на f-підрівні — 14, тому й f-елементів у кожному періоді — 14.
Завдання 15. Використовуючи періодичну систему хімічних елементів, наведіть приклади f-елементів.
Завдання для закріплення (в парах).
1) Де в періодичній системі розташований елемент № 20? Складіть формулу його оксиду й гідроксиду. (СаО, Са(ОН)2 — II група, 4 період)
2) Назвіть елементи:
а) 4 період, IV група, головна підгрупа; (Ge)
б) 5 період, III група, побічна підгрупа. (Y)
3) Складіть формулу вищого оксиду й укажіть його характер для елементів № 23, 30, 34. (V2O3 (основний), ZnO (амфотерний), SeO3 (кислотний))
4) Складіть формули летких сполук із Гідрогеном для елементів № 15,35. (РН3, НВr)
5) Назвіть елементи 5 періоду, які мають формулу вищого оксиду R2O3. (Y, In)
6) Назвіть елемент 3 періоду, що має формулу сполуки з Гідрогеном H3R. (Р)
7) Назвіть елемент, розташований у V групі, відносна молекулярна маса вищого оксиду якого дорівнює 108. (N)
8) Назвіть елемент, розташований у IV групі, відносна молекулярна маса сполуки якого з Гідрогеном дорівнює 32. (Si)
IV. Підбиття підсумків уроку
1. Що нового ви дізналися сьогодні на уроці?
2. Чому в короткоперіодній формі періодичної системи є головні й побічні підгрупи? Чим відрізняються елементи, розташовані в головній і побічній підгрупах?
3. Яка максимальна кількість періодів може бути в періодичній системі?
4. Яка максимальна кількість груп може бути в періодичній системі? Чому?
5. Чому змінюються властивості хімічних елементів у періодах і групах?
V. Домашнє завдання. Опрацювати відповідний параграф підручника, відповісти на запитання, виконати вправи.
УРОК 11
Тема. Характеристика хімічних елементів за положенням у періодичній системі хімічних елементів і будовою атома
Цілі уроку: закріпити знання учнів про будову атома; формувати вміння й навички характеризувати елементи за положенням хімічних елементів у періодичній системі й будовою атома.
Тип уроку: засвоєння вмінь і навичок.
Форми роботи: фронтальна робота, групова робота.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця електронегативностей, алгоритм характеристики хімічних елементів за положенням у періодичній системі.
ХІД УРОКУ
І. Організація класу
II. Перевірка домашнього завдання, актуалізація опорних знань
Фронтальна робота
1. Скільки електронів необхідно віддати атому Магнію, щоб електронна конфігурація зовнішнього рівня в нього стала такою, як в атома Неону?
2. Не заглядаючи в періодичну систему хімічних елементів, розрахуйте, в якому періоді та групі розташований елемент із порядковим номером 25.
3. Заповніть графи в таблиці. (Учні заповнюють таблицю на дошці.)
|
№з/п |
Назва хімічного елемента |
Порядковий номер |
Період |
Група |
Електронна формула |
|
1 |
|
4 |
|
|
|
|
2 |
|
|
|
|
1s22s22р3 |
|
3 |
|
|
2 |
4 |
|
|
4 |
|
|
|
|
1s22s22p63s23p6 |
4. Скільки неспарених електронів в елемента 2 у таблиці?
5. Скільки спарених електронів на зовнішньому рівні в елемента 4 у таблиці?
6. Скільки електронів може приєднати елемент 3 у таблиці?
III. Вивчення нового матеріалу
Положення елемента в періодичній системі може багато розповісти про цей елемент, його сполуки, їхні властивості. Д. І. Менделєєв помітив цю закономірність і навіть зміг передбачити властивості ще не відкритих на той час хімічних елементів. Знання закономірностей зміни будови й властивостей атомів дозволяють передбачати будову та властивості елементів, їхніх сполук. Тому кількість відкритих елементів постійно збільшується.
Скористаємося алгоритмом, щоб охарактеризувати будь-який хімічний елемент за положенням у періодичній системі. (Кожен учень одержує алгоритм складання характеристики для роботи на уроці.)
Бланк характеристики елемента за положенням у періодичній системі
|
1. Символ, назва хімічного елемента |
|
|
2. Порядковий номер |
|
|
3. Відносна атомна маса |
|
|
4. Заряд ядра атома |
|
|
5. Загальна кількість електронів, протонів, нейтронів |
|
|
6. Номер періоду (великий, малий) |
|
|
7. Кількість електронних рівнів |
|
|
8. Номер групи, головна чи побічна підгрупа |
|
|
9. Кількість валентних електронів |
|
|
10. Схема будови атома |
|
|
11. Електронна формула |
|
|
12. Електронно-графічна схема будови атома |
|
|
13. Формула простої речовини, метал чи неметал |
|
|
14. Формула вищого оксиду, його характеристика |
|
|
15. Формула гідроксиду, його характеристика |
|
|
16. Формула леткої сполуки з Гідрогеном (якщо є) |
|
|
17. Порівняльна характеристика властивостей з елементами в підгрупі |
|
|
18. Порівняльна характеристика властивостей з елементами в періоді |
|
IV. Засвоєння вмінь і навичок
1. Разом з учнями заповнюємо на дошці таблицю характеристики хімічного елемента за положенням у періодичній системі на прикладі Карбону.
2. Учні об'єднуються в групи по три-чотири особи для складання характеристики елементів. Кожна група одержує номер хімічного елемента (№ 11, № 13, № 15, № 16). Учні виконують завдання упродовж 5—6 хвилин, потім зачитують і за необхідності записують на дошці результати, обговорюють у класі, виправляють помилки.
3. Розв'яжіть задачу. Відносна молекулярна маса вищого оксиду елемента VI групи за воднем дорівнює 40. Масова частка Оксигену в ньому — 60 %. Визначте цей елемент, охарактеризуйте його за положенням у періодичній системі.
Учитель підбиває підсумки роботи учнів на уроці, оцінює роботу груп.
Ми навчилися характеризувати хімічні елементи за їх положенням у періодичній системі хімічних елементів. Де можна надалі використати ці знання?
Опрацювати відповідний параграф підручника, відповісти на запитання, повторити будову атома.Охарактеризувати за алгоритмом хімічні елементи з порядковими номерами 14 і 19.
УРОК 12
Тема. Характеристика хімічних елементів за положенням у періодичній системі хімічних елементів і будовою атома
Цілі уроку: закріпити вміння й навички характеризувати елементи за їх положенням у періодичній системі й будовою атома; підготувати учнів до тематичного оцінювання з теми «Періодичний закон і періодична система хімічних елементів Д. І. Менделєєва. Будова атома».
Тип уроку: засвоєння знань, умінь і навичок.
Форми роботи: виконання тренувальних вправ, групова робота.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця електронегативностей, алгоритм характеристики хімічних елементів за положенням у періодичній системі.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання, мотивація навчальної діяльності
1. Двоє учнів записують характеристику за положенням у періодичній системі Силіцію й Калію.
2. З допомогою хімічних реакцій доведіть, що калій оксид є основним оксидом.
3. З допомогою хімічних реакцій доведіть кислотний характер силіцій(ІV) оксиду.
4. Назвіть два-три елементи, в яких неметалічні властивості виражені сильніше, ніжу Силіцію.
5. Назвіть два-три метали, сильніші за Калій.
6*. Складіть усі можливі формули води з атомів ізотопів Гідрогену й Оксигену й розташуйте їх у порядку зростання молярної маси.
III. Використання знань, умінь і навичок для виконання тренувальних вправ
Учні об'єднуються в групи, які одержують аналогічні завдання.
1. Розв'яжіть задачу та визначте хімічний елемент за запропонованими даними.
2. Дайте характеристику цього елемента за положенням у періодичній системі.
3. Напишіть електронну формулу іона, утвореного цим атомом, порівняйте її з електронною формулою атома.
Групові завдання
Група 1. Формула леткої сполуки елемента з Гідрогеном — ЕН3. Масова частка Гідрогену в ній — 17,6 %.
Група 2. Масова частка елемента II групи у вищому оксиді дорівнює 60%.
Група 3. Масова частка Оксигену у вищому оксиді елемента II групи дорівнює 28,6 %.
Група 4. Елемент VII групи утворює летку сполуку з Гідрогеном, масова частка елемента в якій дорівнює 97,3 %.
Група 5. Формула вищого оксиду елемента — Е2O3. Масова частка Оксигену дорівнює 47 %.
Групи виконують завдання, після закінчення роботи учні зачитують і наводять на дошці результати, за необхідності доповнюють і виправляють помилки.
IV. Підбиття підсумків уроку
Ми закріпили вміння й навички характеризувати хімічні елементи за їх положенням у періодичній системі хімічних елементів, характеризувати властивості простих і складних речовин, які утворюють ці елементи.
Учитель підбиває підсумки уроку, оцінює роботу груп.
Повторити матеріал про будову атома, періодичний закон. Підготуватися до тематичного оцінювання з теми «Періодичний закон і періодична система хімічних елементів Д. І. Менделєєва. Будова атома».
УРОК 13
Тема. Значення періодичного закону. Життя і діяльність Д. І. Менделєєва
Цілі уроку: розкрити роль Періодичного закону як фундаментального закону природи, доказу єдності матеріального світу; показати його значення для розвитку природничих дисциплін, у тому числі хімії; ознайомитися з життям і діяльністю російського вченого-хіміка Д. І. Менделєєва.
Тип уроку: узагальнення й систематизація знань.
Форма роботи: навчальний семінар.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, портрет Д. І. Менделєєва, ППЗ.
ХІД УРОКУ
I. Організація класу
ІІ.Семінар «Життя й діяльність Д. І. Менделєєва»
На дошці плакат:
Другого ничего в природе нет
Ни здесь, ни там, в космических глубинах:
Все — от созвездий малых до планет —
Из элементов состоит единых.
С. Щипачев. Читая Менделеева
1. Вступне слово вчителя
1 березня 2014 року виповниться 145 років від дня відкриття Д. І. Менделєєвим періодичного закону. Відкриттю закону передувала тривала й напружена наукова праця Менделєєва протягом 15 років (1854—1869), а подальшому його поглибленню було віддано ще 25 років (до початку 1907 p.).
Попередники Менделєєва (Деберейнер, Ньюлендс, Мейєр) зробили багато для підготовки відкриття періодичного закону. Але жоден із цих учених не наважився на підставі поміченої періодичності передбачати нові хімічні елементи. Жоден із них не зумів у повному обсязі охопити сукупність фізичних і хімічних властивостей елементів і утворюваних ними речовин, що розкривають усю глибину періодичного закону. Для них періодичність була лише способом класифікації, вони не побачили в ній фундаментального закону природи.
Мир сложен.
Он полон событий, сомнений,
И тайн бесконечных, и смелых догадок.
Как чудо Природы
Является гений
И в хаосе этом Находит порядок.
Весь мир большой:
Жара и стужа,
Планет круженье, свет зари —
Все то, что видим мы снаружи,
Законом связано внутри.
Найдется ль правило простое,
Что целый мир обьединит?
Таблицу Менделеев строит,
Природы пишет Алфавит.
А. Чивилихин. На изображение таблицы элементов на стене дома у памятника Д. И. Менделееву
2.Використання ППЗ. Урок «Життя і діяльність Д.І.Менделєєва»
3. Виступи учнів про життя й діяльність Д. І. Менделєєва
4. Заключне слово вчителя
Цей закон і сьогодні, через 140 років, залишається одним із найважливіших законів хімії. Він об'єднує всі явища, що відбуваються в природі, підтверджує загальні закони розвитку природи:
• закон переходу кількості в якість;
• закон єдності й боротьби протилежностей;
• закон заперечення заперечення.
III. Домашнє завдання
Творче завдання. Запропонуйте свої приклади дієвості періодичного закону в навколишньому світі.


про публікацію авторської розробки
Додати розробку
