Склад і номенклатура оксидів
Класс: 8
Тема: Склад і номенклатура оксидів
Мета: формувати знання про склад основних класів складних неорганічних сполук та їх номенклатуру на прикладі оксидів; формувати вміння складати формули оксидів та давати їм назви.
Тип уроку: вивчення нового матеріалу
Обладнення: підручник, презентація, зразки оксидів, періодична система хімічних елементів.
Хід уроку
1. Організаційний момент
Привітання з класом. Перевірка готовності до уроку
2. Актуалізація опорних знань.
На які два класи поділяються всі хімічні речовини? (Прості і складні)
Прості речовини, у свою чергу, поділяються ще на дві групи. Які саме? (Метали й неметали.)
Що таке складні речовини? А на які групи можна розподілити складні речовини?
Складних чи простих речовин більше в природі? (Складних, тому що вони складаються з атомів кількох хімічних елементів.)
А за якою ознакою можна класифікувати складні речовини? (За складом,будовою, застосуванням, властивостями)
3. Мотивація навчальної діяльності.
Сьогодні детально ми розглянемо оксиди.
Згадайте, де ми зустрічалися з оксидами в процесі вивчення хімії.
У 7 класі під час вивчення простої речовини кисню. Унаслідок згоряння різних речовин у кисні утворюється продукт їх взаємодії – оксид. Тому невід’ємна частина будь-якого оксиду – Оксиген.
4. Вивчення нового матеріалу
Під час вивчення курсу хімії ставиться завдання оволодіти основами самонавчання, що допоможе вам здійснювати самоосвіту впродовж життя. У цьому вам допоможуть уміння самостійно конструювати поняття, обирати в тексті головне, а також здатність оперувати цими вміннями. Такий підхід сприятиме концентрації вашої уваги й виокремленню суттєвих ознак у навчальному матеріалі. Отож спочатку зробимо спробу виконати це завдання за допомогою схем для конструювання назви поняття «оксиди».
Перед тим як розглянути схему конструювання назви, зазначимо, що кожне поняття складається з родового поняття й видових ознак.
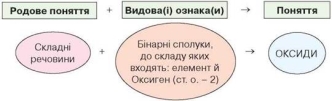
Користуючись схемою, поданою на рисунку сформулюйте самостійно визначення поняття «оксиди».
Знайдіть в підручнику термін оксиди і запишіть у зошити.
Оксиди – це складні речовини, що складаються з атомів двох хімічних елементів, один із яких – Оксиген.
Загальна формула оксидів – ExOy.
За сучасною науковою українською номенклатурою, назви оксидів походять від назви елемента з додаванням слова «оксид».
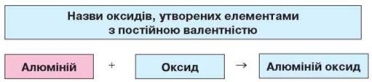
Наприклад: калій оксид К2О, барій оксид ВаО, алюміній оксид Аl2О3.
Якщо ж до складу оксиду входить елемент, що проявляє змінну валентність, то її вказують у назві римською цифрою, узятою в дужки.
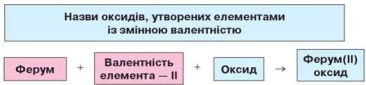
Наприклад: FeO — ферум(ІІ) оксид; Fe2O3 — ферум(III) оксид; MnО — манган(ІІ) оксид; Mn2О3 — манган(ІІІ) оксид; MnО2 — манган(ІV) оксид; Mn2О7 — манган(VІІ) оксид.
На які групи класифікують оксиди?
Щоб відповісти на це запитання, вам знову доведеться пригадати першу класифікацію хімічних елементів на металічні й неметалічні.
Пригадайте, як називають оксиди, утворені неметалічними й металічними елементами.
Металічні елементи з Оксигеном утворюють сполуки, які є оксидами (основними, кислотними, амфотерними), а неметалічні кислотні оксиди.
У періодах періодичної системи є елементи, розташовані на межі між металічними й неметалічними елементами. Для них властиво утворювати оксиди, що проявляють подвійну хімічну природу, тобто мають властивості основних і кислотних оксидів. їх називають амфотерними.
Класифікація оксидів
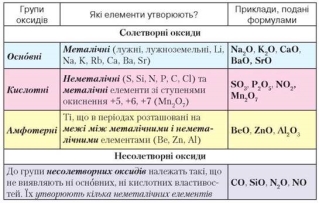
Солетворні оксиди – оксиди, яким відповідають основні або кислотні сполуки. Солетворні оксиди поділяють на такі групи:
кислотні оксиди – оксиди, гідрати яких є кислотами. До цієї групи належать більшість оксидів неметалічних елементів та оксиди металічних елементів зі ступенем окиснення, більшим ніж +3, наприклад: SO3, CO2, NO2, CrO3, Mn2O7. Кислотні оксиди називають ангідридами кислот, тобто «безводними кислотами»;
основні оксиди – оксиди, гідрати яких є основами. До цієї групи належать оксиди металічних елементів зі ступенем окиснення, не більшим ніж +3, наприклад: CaO, Na2O, MgO, BaO, FeO;
амфотерні оксиди – оксиди, що виявляють властивості як кислотних, так і основних оксидів. До них належать: BeO, ZnO, Al2O3, Fe2O3, Cr2O3.
Несолетворні оксиди – оксиди, яким не відповідає ані кислота, ані основа. До них належать: NO, N2O, CO, SiO.
Поширеність у природі оксидів
Оксиди — хімічні сполуки, які дуже часто трапляються в природі. В основному до них належать сполуки активних металічних і неметалічних елементів.
Вода — найпоширеніший оксид на Землі Вона заповнює всі западини земної поверхні, утворюючи ріки, озера, моря й океани. Просочуючись у ґрунт, вона утворює ґрунтові й підземні води. Ця дивовижна речовина входить до складу гірських порід і мінералів. Розчиняючи в собі деякі потрібні для здоров’я людини солі, утворює цілющі мінеральні джерела, біля яких розташовані курорти й лікувальні заклади. Без води не можуть існувати живі організми — людина, рослини, тварини. В організмі людини вода бере участь у всіх біохімічних процесах, підтримує об’єм і пружність клітин.
Для життя та підтримування здоров’я людині потрібна чиста вода, без домішок шкідливих речовин, що потрапляють у водойми внаслідок господарської діяльності. Тому всі люди, які живуть на нашій планеті, мають берегти воду — це справжнє чудо природи, чиї таємниці ще не до кінця розкриті.
Силіцій(IV) оксид теж належить до найбільш поширених природних оксидів. Насамперед це пісок. У природі він залягає окремими пластами, а також устилає дно водойм: річок, морів, океанів. Крім піску, природа подарувала людині й прозорий мінерал кварц. Деякі його кристали сягають гігантських розмірів. Кварц утворює багато кристалічних різновидів: гірський кришталь, димчастий кварц, аметист, котяче око та ін., які завдяки домішкам мають різноманітне забарвлення. Кварц використовують у різних приладах — оптичних, електронних, теле- й радіоапаратурі, для виготовлення кварцового скла, як дорогоцінні камені в ювелірній справі тощо.
Алюміній оксид є складовою природних мінералів алюмосилікатів. До них належать польовий шпат К2О · Аl2О3 · 6SiO2 і коалініт Аl2О3 · 2SiO2 · 2Н2О. Алюміній оксид входить до складу бокситу — мінералу, з якого видобувають алюміній. Мінерал корунд, що має високу твердість, використовують для виготовлення шліфувальних кругів. Він утворює два кольорові різновиди: рубін що має інтенсивне червоне забарвлення, і сапфір — синього кольору, які використовують для виготовлення дорогоцінних прикрас.
Ферум оксиди входять до складу відомих у металургії залізних руд, яких є досить багато. У металургійній промисловості найчастіше використовують червоний залізняк, до складу якого входить ферум(ІІІ) оксид Fe2O3 відомий як руда гематит. Ферум(ІІ, ІІІ) оксид Fe3О4 є основною складовою магнітного залізняка. Руда магнетит містить до 72,4 % Феруму. У природі трапляються й інші залізняки, зокрема бурі й шпатові, однак їхні руди мають інший хімічний склад. Усі мінерали, що містять елемент Ферум, є основною сировиною для виробництва заліза та його сплавів.
Магній оксид у природі — це мінерал периклаз. Магній оксид MgO ще називають паленою магнезією, що пов’язано зі способом її добування в промисловості. Магній оксид є у складі таких сполук, як тальк 3MgO · 4SiO2 · H2O й азбест CaO · MgO · 4SiO2. Вони мають високу вогнестійкість.
Карбон(IV) оксид поширений в атмосфері. Приблизно 0,03 % цього газу входить до складу повітря. Відіграє активну роль у процесі фотосинтезу. Накопичення вуглекислого газу в повітрі спричиняє парниковий ефект.
Використання оксидів. Частково про використання оксидів уже згадувалося. Широкий спектр використання цих сполук залежить насамперед від різноманітності їхніх фізичних і хімічних властивостей.
Розглянемо таблицю використання оксидів.
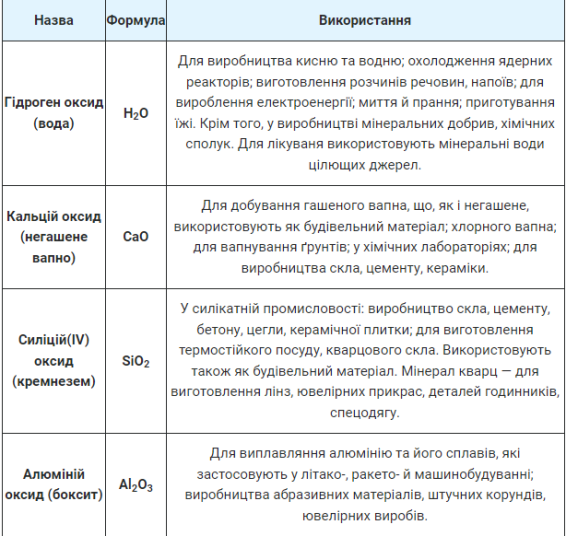

Вивчаючи хімічні властивості оксидів, ви ознайомилися з реакціями їхньої взаємодії з водою. На цих реакціях ґрунтується добування основ і кислот. Під час взаємодії основних і кислотних оксидів між собою утворюються солі. Солі ж добувають і шляхом реакцій основних оксидів з кислотами та кислотних оксидів — з основами.
5. Узагальнення та систематизація знань.
Картка завдань
1. Які речовини називають оксидами?
2. Наведіть приклади оксидів.
3. Встановіть відповідність між речовинами та класом неорганічних сполук: MnO2, CaSO4, P 2O5, HNO3, AlPO4 , Cu(OH)2 , CuNO3, H2SO4, Mg(NO3)2, SO3, Ca(OH)2, HCl, Al(OH)3, KOH , Al 2O3, H2SiO3.
|
Оксиди |
Кислоти |
Основи |
Солі |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
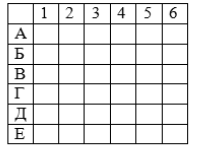 4. Установіть відповідність між назвою та формулою оксиду.
4. Установіть відповідність між назвою та формулою оксиду.
|
Назва оксиду |
Формула оксиду |
|
А) Калій оксид |
1) CO |
|
Б) Нітроген(І) оксид |
2) CaO |
|
В) Натрій оксид |
3) CO2 |
|
Г) Карбон(IV) оксид |
4) N2O |
|
Д) Карбон(ІІ) оксид |
5) Na2O |
|
Е) Кальцій оксид |
6) K2O |
5. Складіть формули оксидів елементів
Магнію
Калію
Алюмінію
Фосфору (V)
Хлору (VII )
Заліза (III)
Карбону (IV)
Сірки (VI)
6. Підбиття підсумків уроку.
Фронтальне опитування.
- Мені сподобалось сьогодні….
- Мені запамяталось…..
7. Повідомлення домашнього завдання.
Параграф 23, завдання після параграфу №171-175
Презентація до уроку: https://www.canva.com/design/DAE7mErhevM/kBX1GN_Kd52EfOR-xkL5mw/edit?utm_content=DAE7mErhevM&utm_campaign=designshare&utm_medium=link2&utm_source=sharebutton


про публікацію авторської розробки
Додати розробку
