Склад, властивості, застосування окремих представників вуглеводнів


















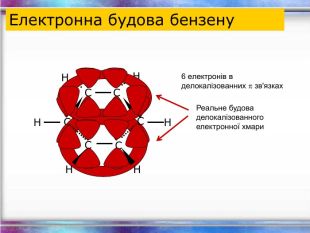
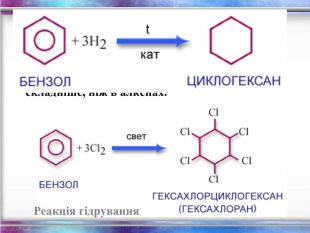
Види сполучень атомів Карбону між собою 1. Сполучення простими ковалентними зв’язками: – С – С – С – С – Такі сполучення реалізуються навіть у простих речовинах Карбону: алмазі, графіті, карбіні, фулеренах. 2. Сполучення кратними (подвійними і потрійними) ковалентними зв’язками: – С = С – С = С – – С ≡ С – 3. Циклічне сполучення атомів Карбону: Алмази: Фулерени:
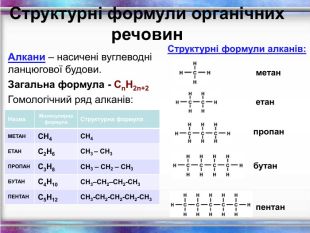
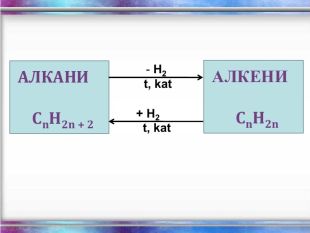
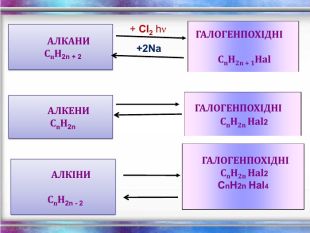
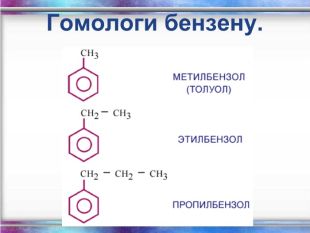
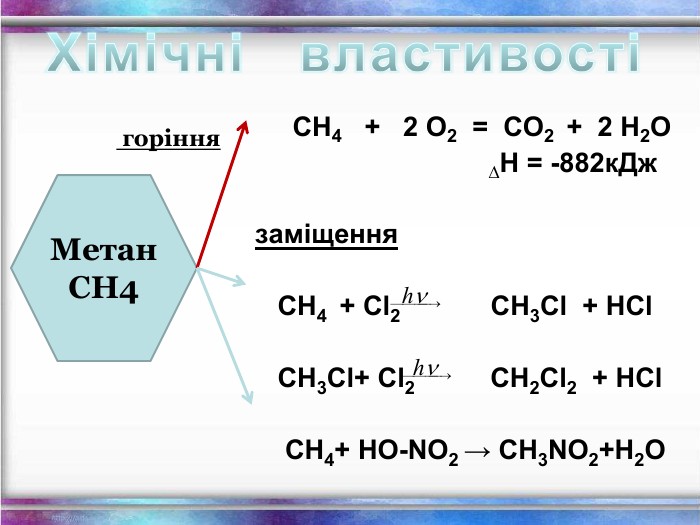
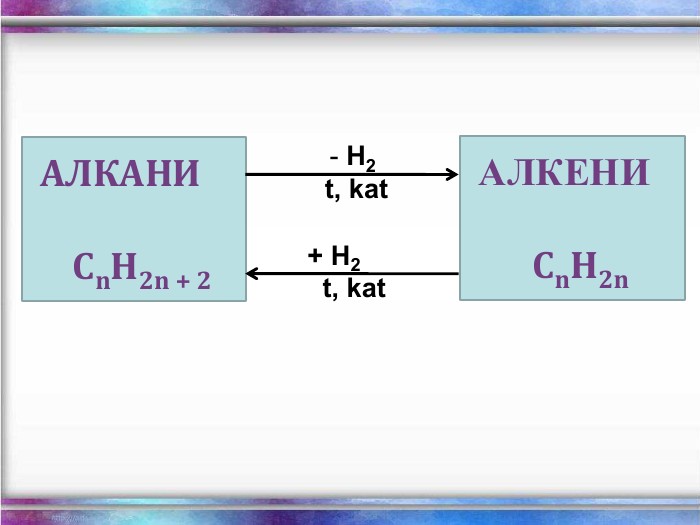
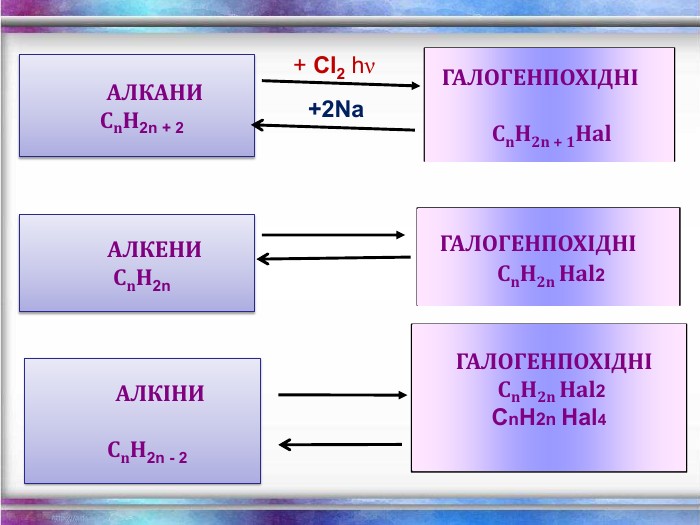
Структурні формули органічних речовин Алкани – насичені вуглеводні ланцюгової будови. Загальна формула - СnH2n+2 Гомологічний ряд алканів: Назва Молекулярна формула Структурна формула МЕТАН СН4 СН4 ЕТАН С2Н6 СН3 – СН3 ПРОПАН С3Н8 СН3 – СН2 – СН3 БУТАН С4Н10 СН3–СН2–СН2-СН3 ПЕНТАН С5Н12 СН3-СН2-СН2-СН2-СН3 метан етан пропан бутан пентан Структурні формули алканів:
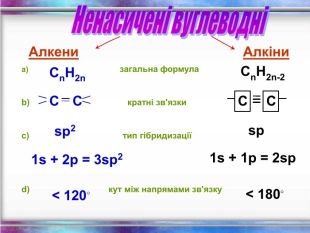
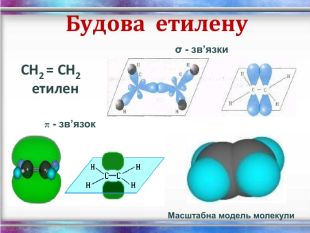
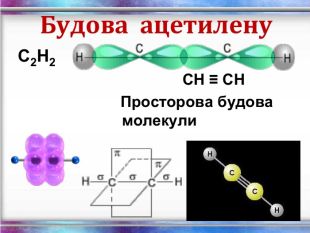
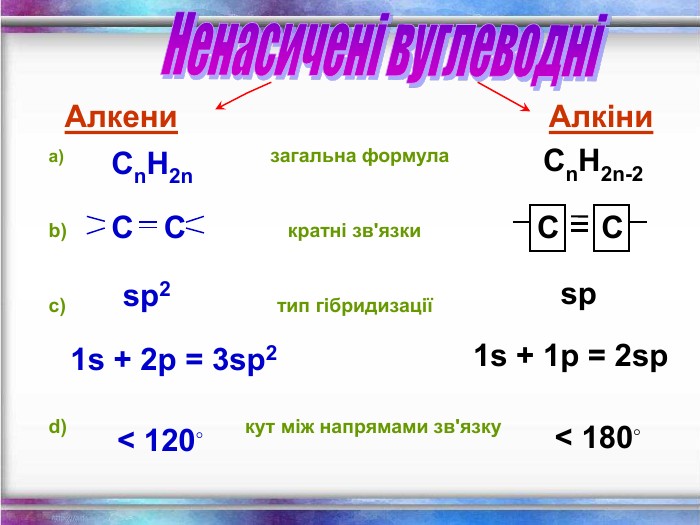
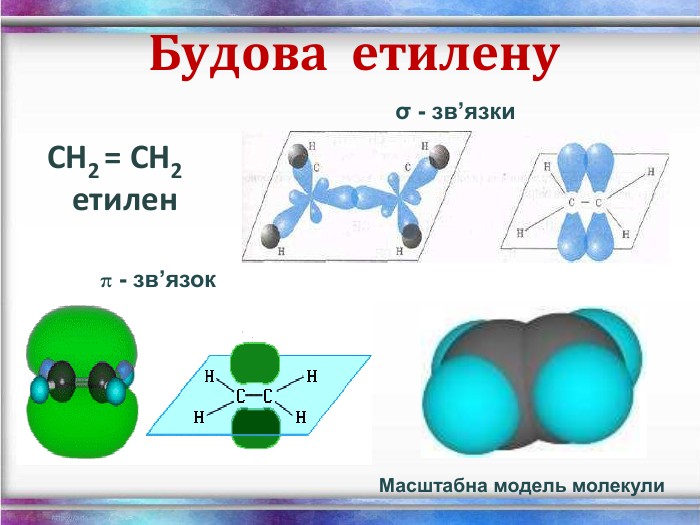
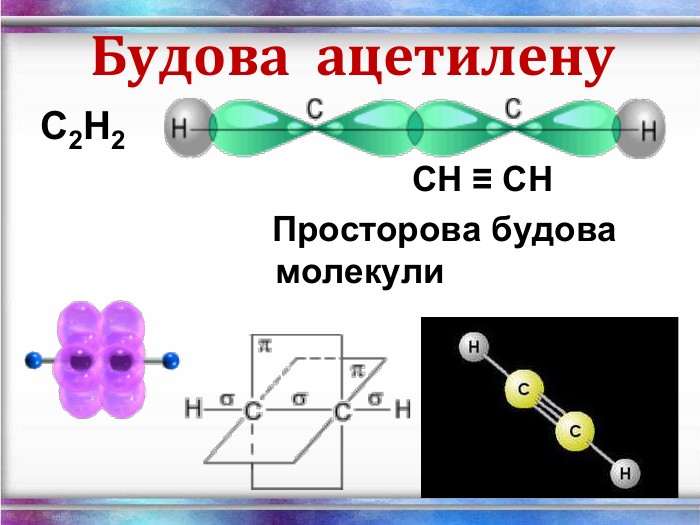
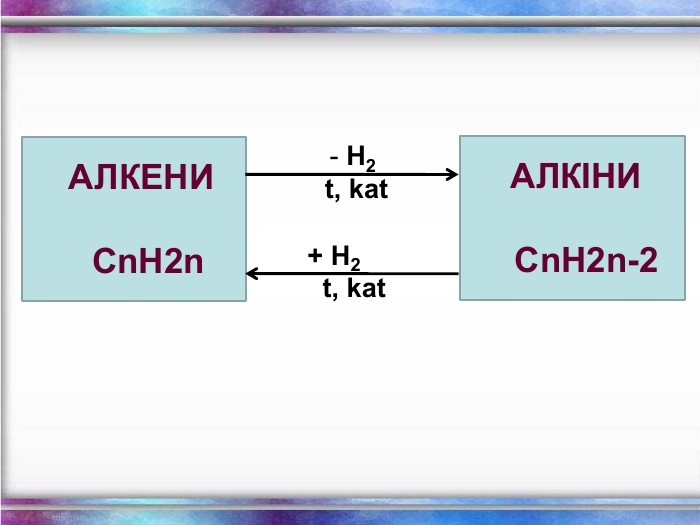
Ненасичені вуглеводні – органічні сполуки, що мають кратні зв’язки між атомами Карбону (подвійні – С = С – або потрійні – С Ξ С – ) Етиленові вуглеводні - органічні сполуки, що мають один подвійний зв’язок між атомами Карбону. Загальна формула СnH2n С2Н4 - етен (етилен) С3Н6 - пропен С4Н8 - бутен Ацетиленові вуглеводні - органічні сполуки, що мають один потрійний зв’язок між атомами Карбону. Загальна формула - СnH2n - 2 С2Н2 - етин (ацетилен) С3Н4 - пропін С4Н6 - бутин
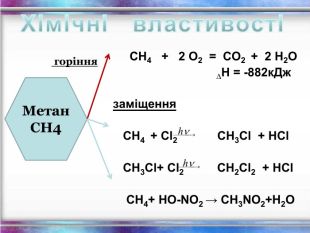
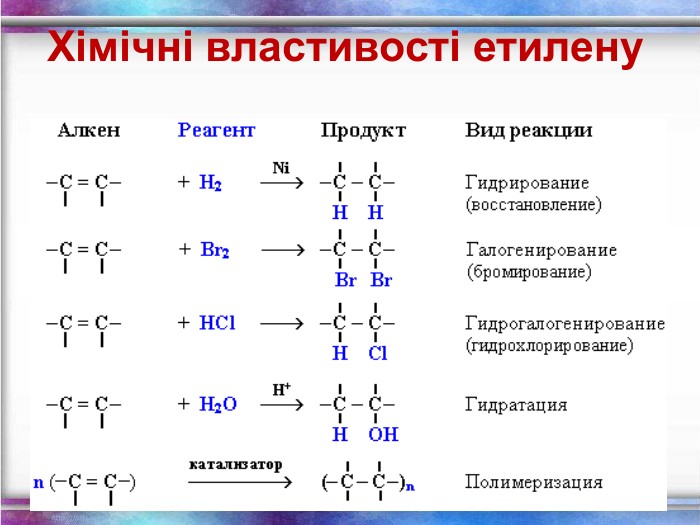
Хімічні властивості етилену Горіння (з виділенням великої кількості теплоти): С2Н4 + 3O2 → 2СО2 +2Н2О 2. Реакції приєднання по місцю розриву π - зв’язку: СН2 = СН2 а) гідрування - приєднання водню: С2Н4 + Н2→ С2Н6 б) галогенування - приєднання галогенів: С2Н4 + Br2 →С2Н4Br2 Якісне визначення ненасичених вуглеводнів - знебарвлення розчину калій перманганату і бромної води
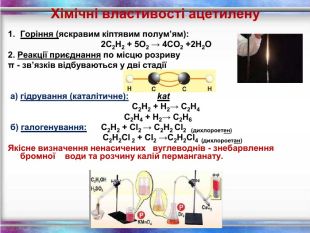
Хімічні властивості ацетилену Горіння (яскравим кіптявим полум’ям): 2С2Н2 + 5O2 → 4СО2 +2Н2О 2. Реакції приєднання по місцю розриву π - зв’язків відбуваються у дві стадії а) гідрування (каталітичне): kat С2Н2 + Н2→ С2Н4 С2Н4 + Н2→ С2Н6 б) галогенування: С2Н2 + Cl2 → С2Н2 Cl2 (дихлороетен) С2Н2Cl 2 + Cl2 →С2Н2Cl4 (дихлороетан) Якісне визначення ненасичених вуглеводнів - знебарвлення бромної води та розчину калій перманганату.
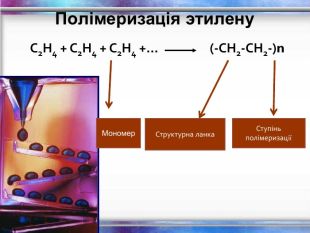
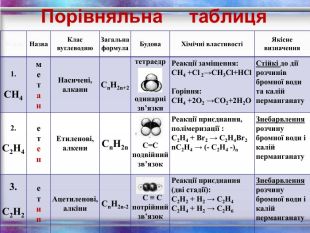
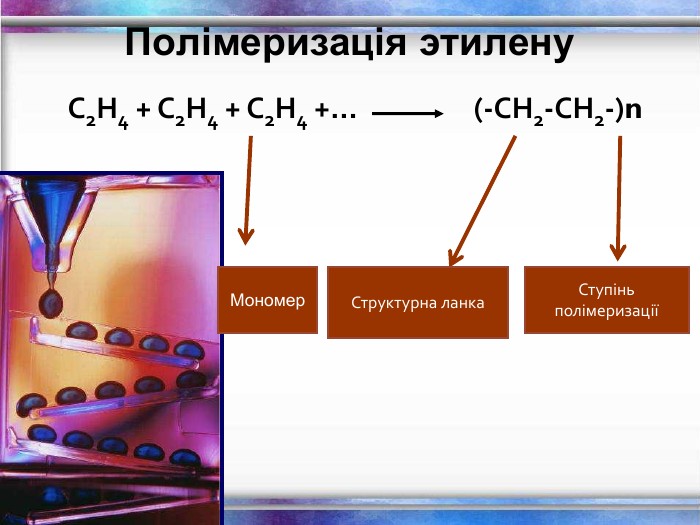
Порівняльна таблиця № п/п Назва Клас вуглеводню Загальна формула Будова Хімічні властивості Якісне визначення 1. СН4 м е т а н Насичені, алкани СnH2n+2 тетраедр одинарні зв’язки Реакції заміщення: СН4 +Cl 2→СН3Cl+НCl Горіння: СН4 +2O2 →СО2+2Н2О Стійкі до дії розчинів бромної води та калій перманганату 2. С2Н4 е т е н Етиленові, алкени СnH2n С=С подвійний зв’язок Реакції приєднання, полімеризації : С2Н4 + Br2 → С2Н4Br2 nС2Н4 → (- С2Н4 -)n Знебарвлення розчину бромної води і калій перманганату 3. С2Н2 е т и н Ацетиленові, алкіни СnH2n-2 С ≡ С потрійний зв’язок Реакції приєднання (дві стадії): С2Н2 + Н2 → С2Н4 С2Н4 + Н2 → С2Н6 Знебарвлення розчину бромної води і калій перманганату


про публікацію авторської розробки
Додати розробку