Складання рівнянь окисно-відновних реакцій
Тема: Складання рівнянь окисно - відновних реакцій
Мета уроку:
Освітня: поглибити знання учнів про окисно-відновні реакції, закріпити знання основних понять та вміння визначати й застосовувати такі поняття: «ступінь окиснення», «окисник», «відновник», «окиснення», «відновлення»; навчити учнів складати рівняння окисно-відновних реакцій методом електронного балансу.
Розвивальна: розвивати вміння і навички роботи в команді, вчити самостійно здобувати знання; розвивати вміння логічно мислити, аналізувати, робити висновки.
Виховна: пробуджувати пізнавальний інтерес, використовуючи новини науки і техніки, ігрові ситуації; виховувати пізнавальний інтерес учнів до вивчення хімії, товариськість і взаємодопомогу.
Програмне забезпечення: Microsoft PowerPoint, Internet, Learningapps.org.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, пам’ятки з алгоритмом складання рівнянь окисно-відновних реакцій методом електронного балансу, правила визначення ступенів окиснення елементів в речовинах, презентація, комп’ютер, проектор, картки-завдання.
Тип уроку: комбінований.
Форми роботи: пояснювально-ілюстративні, репродуктивні, частково-пошукові, практичні (виконання вправ), використання опорних конспектів, індивідуальна робота, фронтальне опитування, гра, демонстраційний експеримент, розповідь вчителя, робота біля дошки, самостійна робота в зошитах, бесіда.
Базові поняття та терміни: окисно-відновні реакції, окисники, відновники, окиснення, відновлення, метод електронного балансу.
Девіз уроку: «Навколишній світ – хімічна лабораторія, в якій щосекундно відбуваються окисно-відновні реакції».
ХІД УРОКУ
Привітання, перевірка готовності учнів до уроку, налаштування на робочий настрій та побажання успіху в роботі.
Психологічна розминка
Щоб найефективніше організувати нашу роботу на сьогоднішньому уроці, визначимо емоційний стан кожного з нас та цілого класу. Перед вами є картки різних смайликів. Якщо ви

підніміть картку з відповідним смайликом.
ІІ. Перевірка домашнього завдання. Актуалізація опорних знань
«СТВОРИМО ХІМІЧНУ ЯЛИНКУ». За виконання завдань дається картка хімічного елемента, який кріпиться на дошку у певному порядку, так щоб в результаті вийшла ялинка.
«Експрес – тест» (в парі) та одночасно «Робота біля дошки»
Визначити ступінь окиснення речовин:
HCl O2 Н2 CaCO3 Сl2 AgNO3 Са HNO3
- Позначте формули сполук, у яких ступені окиснення елементів дорівнюють нулю
- CO
- Cl2 +
- Zn +
- SO2
- H2SO4
- Позначте сполуки, в яких Сульфур виявляє ступінь окиснення +4
- SO3
- SO2 +
- H2S
- H2SO3 +
- H2SO4
- Позначте записи процесів окиснення
-
Fe+3 + 1e
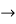 Fe+2
Fe+2
-
Fe0 - 2e
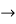 Fe+2 +
Fe+2 +
-
Fe+2 - 1e
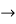 Fe+3 +
Fe+3 +
-
Fe+2 + 2e
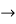 Fe0
Fe0
- Позначте записи процесів, в яких Манган є відновником
-
Mn0 - 2e
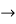 Mn+2 +
Mn+2 +
-
Mn+4 + 2e
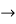 Mn+2
Mn+2
-
Mn+4 + 1e
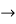 Mn+3
Mn+3
-
Mn+3 - 1e
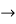 Mn+4 +
Mn+4 +
Кросворд https://learningapps.org/3952107
Або «Експрес – контроль»
Учні отримують картки із тестами. Тести учні виконують самостійно, а потім взаємоперевірка виконаної роботи.
- Метали мають такі ступені окиснення:
А. не мають; Б. позитивний; В. негативний.
2. Окисно – відновні реакції, це реакції, в яких:
А. не змінюється ступінь окиснення елементів;
Б. змінюється ступінь окиснення елементів;
В. визначення належності до окисно - відновних реакцій не пов’язано із ступенем окиснення елементів.
3. Відновники – це атоми, молекули або йони, що:
А. приєднують електрони;
Б. віддають електрони;
В. здатні і віддавати і приєднувати електрони.
4. Окисники - це атоми, молекули або йони, що:
А. приєднують електрони;
Б. віддають електрони;
В. здатні і віддавати і приєднувати електрони.
5. Відновлення – це процес :
А. приєднання електронів ;
Б. віддавання електронів;
В. не пов’язаний із переходом електронів.
6. Який процес відбувається в зазначеній схемі
2Н┼1 + 2е ¯→ Н˚2
А. відновлення;
Б. окиснення.
7. При відновленні ступінь окиснення елемента:
А. зменшується;
Б. збільшується ;
В. не змінюється.
8. Елемент з найнижчим ступенем окиснення може бути:
А. тільки відновником;
Б тільки окисником;
В. і відновником і окисником;
9. Елемент з найвищим ступенем окиснення може бути:
А. тільки відновником;
Б тільки окисником;
В. і відновником і окисником;
10. Елемент проміжним ступенем окиснення може бути:
А. тільки відновником;
Б тільки окисником;
В. і відновником і окисником;
11.Укажіть схему, що відповідає перетворенню N0 →N─3:
А.1S22S22P3 ─3e─ →1S22S2;
Б. 1S22S22P3 +3e─ →1S22S22Р6;
В.1S22S22P5 +1e─ →1S22S22Р6;
Г. 1S22S22P3 _3e─ →1S22S22Р6.
12. Вкажіть кількість електронів, відданих або приєднаних атомом в схемі S─2 → S┼6 :
А. 2е─;
Б. 6е─;
В. 8е─ .
Відповіді: 1. Б.
- Б
- Б
- А
- А
- А
- А
- А
- Б
- В
- Б
- В
ІІІ. Мотивація навчальної діяльності
Навколо нас в природі відбувається велика кількість хімічних реакції: виверження вулкану, фотосинтез, дихання, травлення… Ми, люди, також широко використовуємо хімічні процеси. Наприклад, горіння сірника, добування металів із руд, приготування їжі та інше. Серед цих хімічних процесів велика кількість належить до окисно-відновних реакцій.
Оголошення теми та мети уроку.
Навчимося писати окисно-відновні рівняння, урівнювати рівняння методом електронного балансу.
IV. Вивчення нового матеріалу
Розповідь учителя з елементами бесіди.
Можна використати графічний спосіб для пояснення зміни ступенів окиснення(за ним можна підрахувати кількість втрачених, чи приєднаних електронів), який ми будемо використовувати у ході уроку.
Окиснення, відновник (-е-)
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() -5 -4 -3 -2 -1 0 +1 +2 +3 +4 +5
-5 -4 -3 -2 -1 0 +1 +2 +3 +4 +5
Відновлення, окисник (+е-)
Отже, у окисно-відновних реакціях йде віддача та приєднання електронів. Для таких реакцій також виконуються фундаментальні закони: збереження маси і енергії й, окрім цього, зберігається електронна рівновага. А який ви знаєте до цього слова синонім? (баланс)
Дійсно для окисно-відновних реакцій: n (е-) відданих = n (е-) прийнятих.
На основі цього ґрунтується один з методів урівнювання ОВР метод електронного балансу. Для чого він потрібний? У багатьох випадках (наприклад, коли взаємодіють або утворюються три речовини) традиційний добір коефіцієнтів потребує чимало часу. Переконайтесь у цьому самі, спробувавши перетворити схему реакції
FeCl2 + O2 + HCl → FeCl3 + H2O на хімічне рівняння. (учні урівнюють)
Отже традиційно це зробити складно. Тому пропоную вам урівняти просте окисно - відновне рівняння за методом електронного балансу за алгоритмом:
Робота з алгоритмом «Складання окисно-відновних реакцій»:
|
Порядок виконання дій |
Приклад |
|
Скласти електронний баланс реакції взаємодії алюміній (ІІІ) оксиду з чадним газом |
|
2. Записуємо схему хімічної реакції |
Al2O3 + CO |
|
3.Визначаємо і записуємо ступені окислення атомів у лівій і правій частинах складеної схеми, підкреслюємо символи елементів, що змінюють ступені окислення під час реакції |
+3 -2 +2 -2 0 +4 -2
Al2 O3 + C O |
|
4.Складаємо схему електронного балансу з метою визначення коефіцієнтів |
Al+3+ 3e | | 6 |
C+2 - 2e Al+3 - окисник (процес відновлення) C+2 - відновник (процес окиснення) |
|
5.Розставляємо коефіцієнти |
Al2O3 + 3 CO |
|
6.Перевіряємо правильність розставлених коефіцієнтів за загальною сумою атомів Оксигену до і після реакції |
6 =6 |
Фізкультхвилинка «Хтось знаходить, а хтось втрачає»
Формули та схеми проектуються на дошку
H2SO4 – тільки окисник
K2SO3– як окисник, так і відновник
MnS – тільки відновник
S – як окисник, так і відновник
SO3 – тільки окисник
H2SO3 – як окисник, так і відновник
H2S – тільки відновник
CaSO4– тільки окисник
SO2 – як окисник, так і відновник
Які процеси відображають схеми?
![]() (окиснення)
(окиснення)
![]() (відновлення)
(відновлення)
![]() (окиснення)
(окиснення)
![]() (відновлення)
(відновлення)
![]() (окиснення)
(окиснення)
![]() (відновлення)
(відновлення)
V. Закріплення знань, умінь, навиків
Складання рівнянь окисно-відновних реакцій. Складання електронного балансу.
«СТВОРИМО ХІМІЧНУ ЯЛИНКУ». Учні по-черзі під керівництвом вчителя працюють біля дошки (учні високого рівня за бажанням можуть працювати самостійно, а потім дати зошит на перевірку вчителю)
Закріпити вивчений матеріал пропоную в ігровій формі. Незабаром Новорічні свята. Нашу ялинку необхідно. Тільки виконавши його, ви зможете створити ялинку:
Доберіть коефіцієнти у схемах окисно – відновних реакцій методом електронного балансу, вкажіть окисник і відновник, процеси окиснення та відновлення.
Складіть рівняння окисно-відновної реакції методом електронного балансу.
B – 1. Cu + H2SO4 -> CuSO4 + SO2 + H2O
B – 2. CuO + NH3 -> Cu + N2 + H2O
B – 3. H2S + HNO3 -> H2SO4 + NO2 + H2O
B – 4. KClO3 + S -> KCl + SO2
B – 5. P2O5 + C -> P + CO
B – 6. FeCl3 + H2S -> FeCl2 + S + HCl
B – 7. SO2 + HNO3 + H2O -> H2SO4 + NO
B – 8. CuO + NH3 -> Cu + N2 + H2O
B – 9. HJ + H2SO4 -> J2 + H2S + H2O
B – 10. P + HNO3 -> HPO3 + NO2 + H2O
Або Складіть рівняння окисно-відновних реакцій методом електронного балансу.
B – 1. H2S + KMnO4 + H2SO4 -> S + MnSO4 + K2SO4 + H2O
B – 2. FeSO4 + KMnO4 + H2SO4 -> Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
B – 3. H2S + K2Cr2O7 + H2SO4 -> S + Cr2(SO4)3 + K2SO4 + H2O
B – 4. Na2SO3 + KMnO4 + KOH -> Na2SO4 + K2MnO4 + H2O
B – 5. K2S + KMnO4 + H2SO4 -> S + MnSO4 + K2SO4 + H2O
B – 6. NaJ + KMnO4 + KOH -> J2 + K2MnO4 + NaOH
B – 7. S + KClO3 + H2O -> Cl2 + K2SO4 + H2SO4
B – 8. NH3 + KMnO4 + KOH -> KNO3 + K2MnO4 + H2O
B – 9. Al + HNO3 -> Al(NO3)3 + NH4NO3 + H2O
B – 10. Cl2 + Br2 + KOH -> KCl + KBrO3 + H2O
Або
- Al + HCl → AlCl3 + H2 ;
- Ca + O2 → CaO;
- N2 + O2 → NO;
- Na + H2SO4 →Na2SO4 + H2;
- P + HNO3 → HPO3 + NO2 +H2O
- Fe + Cl 2 → FeCl3;
- KMnO4 + SO2 + H2O → H2SO4 + MnO2 + KOH;
- H2S + HNO3 → S + NO + H2O;
- KI + FeCl3 → I2 + FeCl2 + KCl;
- CuCl2 + Al → AlCl3 + Cu.
VІ. Підбиття підсумків уроку. Рефлексія
Метод мікрофон
Сьогодні на уроці я:
- я дізнався...
• було цікаво....
• було важко...
• я виконував завдання...
• я зрозумів, що...
• тепер я можу...
• я відчув, що...
• я набув...
• я навчився...
• у мене вийшло...
• я зміг...
• я спробую...
• мені захотілося...
VІІ. Виставлення оцінок .Домашнє завдання


про публікацію авторської розробки
Додати розробку
