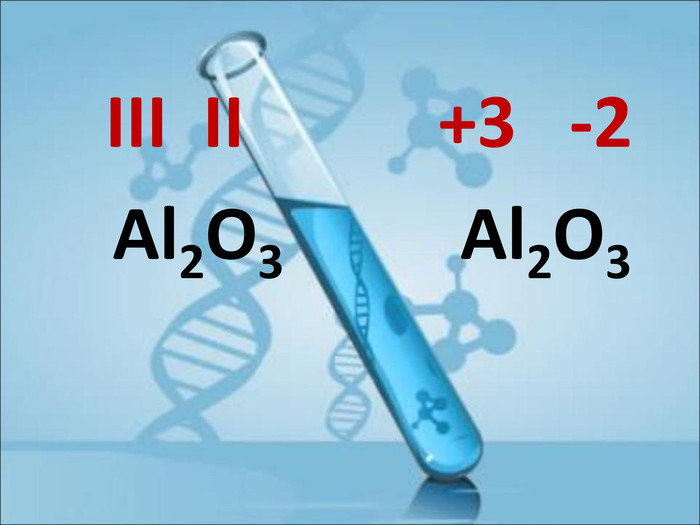
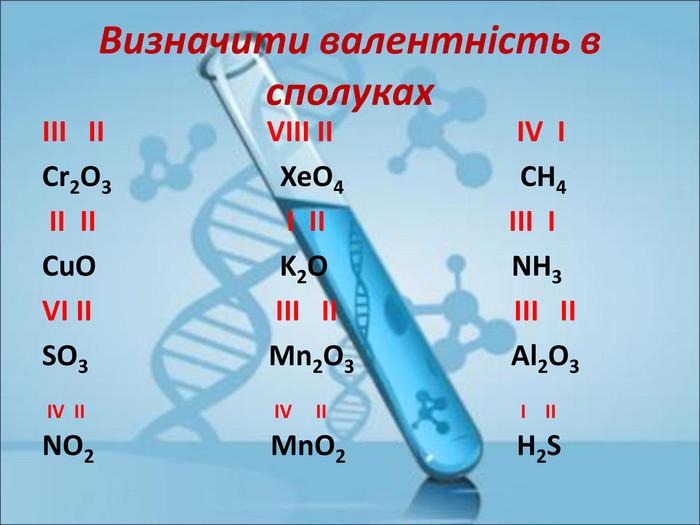
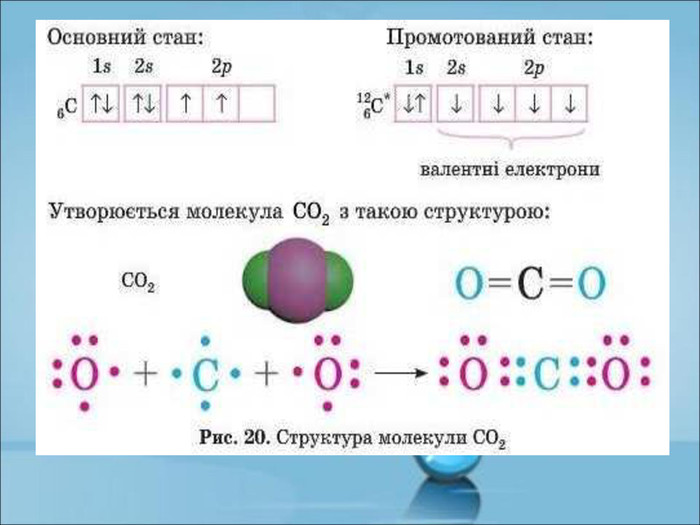
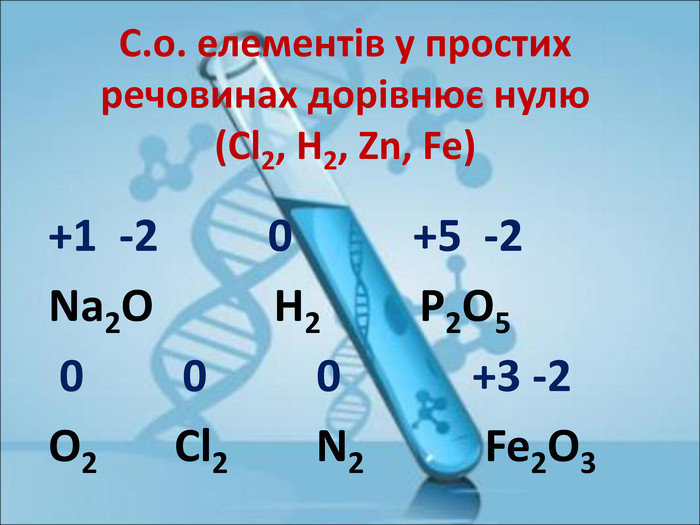
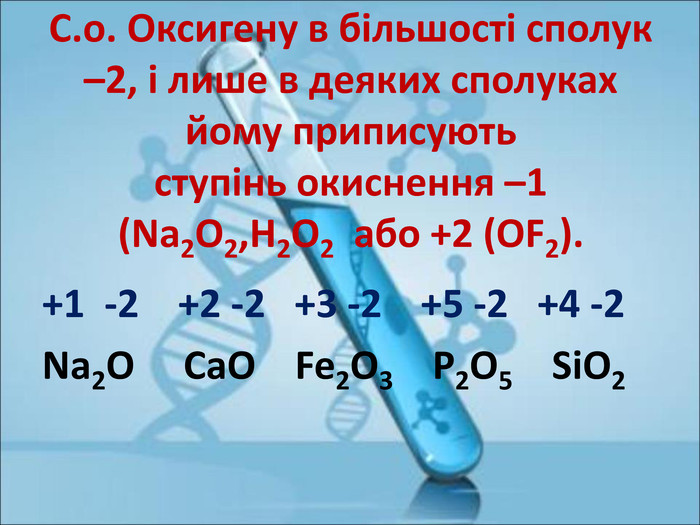
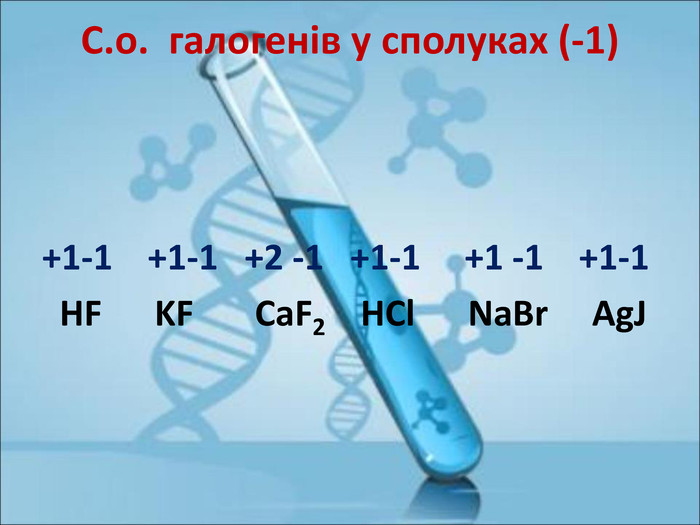
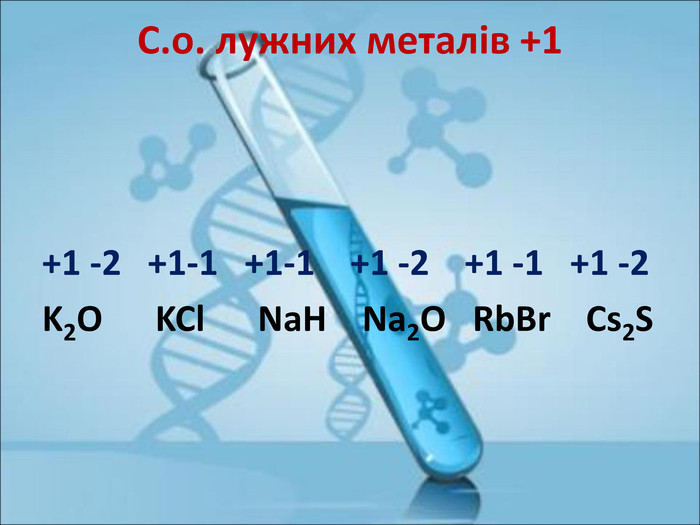
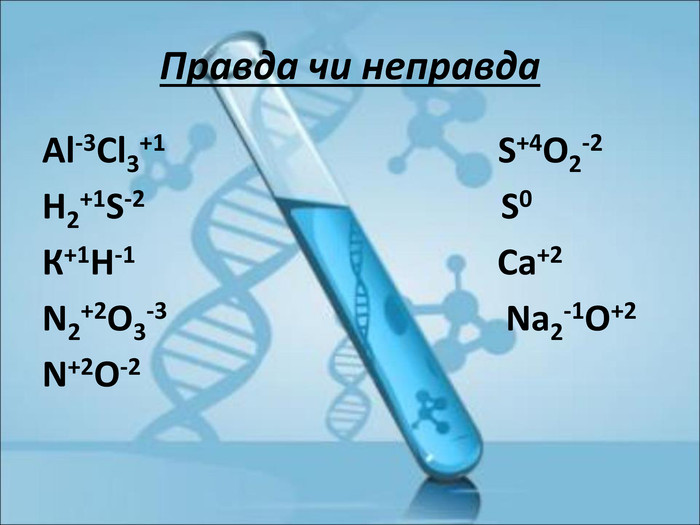
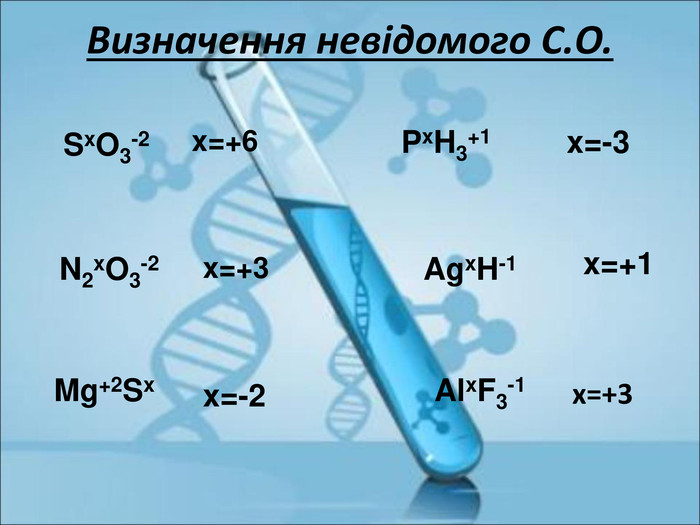
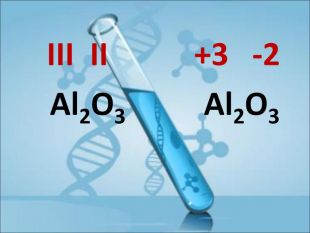
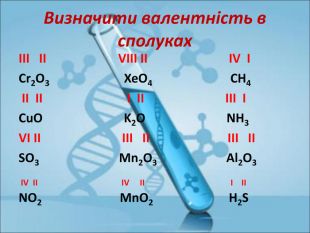
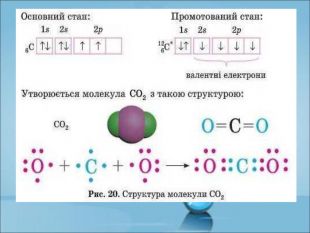
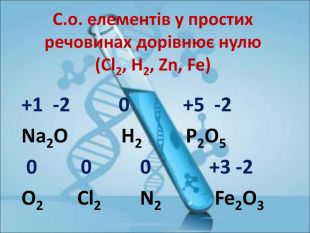
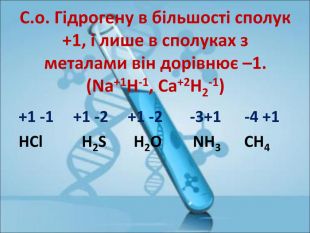
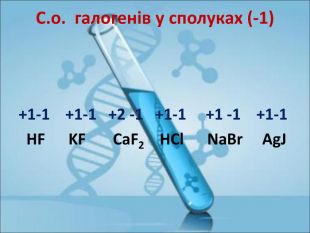
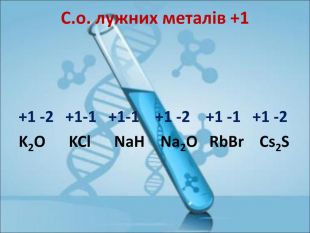
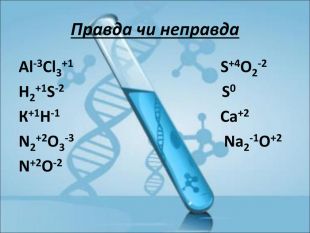
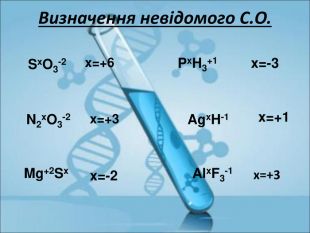
Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки. Складання формул сполуки за відомими степенями окиснення
Про матеріал
Презентація до уроку з теми " Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки. Складання формул сполуки за відомими степенями окиснення" Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку