Тема: Хімічні властивості оснόвних, та кислотних оксидів: взаємодія з водою, кислотами, лугами, іншими оксидами.
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ЦЕНТРАЛЬНОУКРАЇНСЬКИЙ ДЕРЖАВНИЙ ПЕДАГОГІЧНИЙ УНІВЕРСИТЕТ ІМЕНІ ВОЛОДИМИРА ВИННИЧЕНКА
“ЗАТВЕРДЖУЮ”
Груповий методист : Форостовська Т. О
Вчитель хімії: ________
«____»________________2022 р
КОНСПЕКТ УРОКУ
з хімії у 8 –Б класі
з теми : «Хімічні властивості оснόвних, та кислотних оксидів: взаємодія з водою, кислотами, лугами, іншими оксидами.»
студентки - практикантки IV курсу
факультету математики, природничих наук та технологій
спеціальність 014 Середня освіта (Біологія та здоров’я людини)
Осікової Марини Володимирівни
Дата проведення:
“______” _________________ 2022 року
Оцінка вчителя _______ ____________
(підпис вчителя)
Урок 2. Тема: Хімічні властивості оснόвних, та кислотних оксидів: взаємодія з водою, кислотами, лугами, іншими оксидами.
Мета:
- навчальна: повторити фізичними властивості оксидів і розширити знання про хімічні властивості оксидів, розглянути реакцію обміну;
- розвивальна: формувати навички складання хімічних рівнянь на прикладі хімічних властивостей оксидів; розширити поняття індикаторів, пояснити їх використання для визначення кислот та основ.
- виховна: виховувати пізнавальний інтерес до вивчення хімії, виховувати екологічне мислення, здоровий спосіб життя, розвивати самостійність на уроці, увагу, пам'ять.
Обладнання: періодична система хімічних елементів Д.І.Менделєєва; на демонстраційному столі: кальцій оксид, купрум (II) оксид, ферум (ІІІ) оксид, вода, хлоридна кислота, штатив, пробірки
Тип уроку: комбінований урок
Базові поняття та терміни: оксиди, хімічні властивості оксидів, реакція обміну.
Методи навчання:
а) словесний: розповідь-пояснення, опис, бесіда, повідомлення учнів, робота з підручником.
б) наочний: ілюстрація, демонстрація, м\медійна дошка.
в) практичний: виконання лабораторної роботи.
Прийоми навчання: виклад інформації, пояснення, активізація уваги та мислення, одержання з тексту та ілюстрацій нових знань, робота з роздатковим матеріалом.
Структура уроку:
1). Організаційна частина (1хв)
2). Актуалізація опорних знань та їх корекція (7хв)
3). Мотивація та стимуляція навчальної діяльності (2хв)
4). Пояснення нового матеріалу (20хв)
5). Діагностика рівня засвоєних учнями знань і навичок та їх кореляція . (5хв)
6). Закріплення нового навчального матеріалу (7 хв)
7) Підведення підсумків уроку ( 2 хв )
8) Пояснювальне ознайомлення з домашнім завданням. (1 хв)
Хід уроку
1). Організаційна частина
Привітання вчителя. Перевірка присутніх та готовності учнів до уроку.
2). Актуалізація опорних знань та їх корекція
Сьогодні ми продовжуємо вивчати хімічні властивості оксидів.
Але перед цим повторимо:
- Дайте визначення оксидам. Класифікація оксидів.
- Назвіть відомі вам несолетворні оксиди.
- Назвіть відомі вам амфотерні оксиди
- Назвати оксиди: CaO, CO2, N2O, CuO, Al2O3, SO3, Mn2O7, СO, SnO, Cl2O7, P2O5, K2O, BeO.
- Напишіть відповідні кислоти або основи, які відповідають таким оксидам:
Na2О - ?
СО2 - ?
N2O5 - ?
SO2 - ?
SO3 - ?
Al2O3 - ?
P2O5 - ?
CaO - ?
3). Мотивація та стимуляція навчальної діяльності
Сьогодні ми продовжуємо вивчати хімічні властивості для кислотних і основних оксидів. Зробимо висновки, чим їх властивості подібні, а чим вони відрізняються.
Записуємо тему уроку: Хімічні властивості оснόвних, та кислотних оксидів: взаємодія з водою, кислотами, лугами, іншими оксидами.
4). Пояснення нового матеріалу
Хімічні властивості основних оксидів певною мірою відомі вам з курсу хімії 7 класу. Пригадайте: ви вивчали хімічні властивості води, її взаємодію з оксидами металічних і неметалічних елементів.
![]() Основні оксиди, утворені лужними (ІА підгрупа) і лужноземельними (ІІА підгрупа, за винятком Берилію і Магнію) металічними елементами, взаємодіють з водою. Продуктом реакції є розчинна основа - луг:
Основні оксиди, утворені лужними (ІА підгрупа) і лужноземельними (ІІА підгрупа, за винятком Берилію і Магнію) металічними елементами, взаємодіють з водою. Продуктом реакції є розчинна основа - луг:
Наприклад, унаслідок взаємодії кальцій оксиду з водою утворюється кальцій гідроксид:
СаО + Н2О → Са(ОН)2.
На цій реакції ґрунтується процес гасіння вапна. Взаємодія кальцій оксиду з водою відбувається дуже бурхливо, супроводжується виділенням теплової енергії. Ось як описує цей процес Іван Франко у творі «Борислав сміється»: «В вапнярках шипіло та булькотіло вапно, немов лютилось, що його наперед спражено в огні, а тепер назад вкинено у воду».
Демонстрація: Взаємодія кальцій оксиду з водою, дослідження добутого розчину індикатором, пропускання вуглекислого газу в розчин, що утворився.
Перегляд відео:
- «Взаємодія кальцій оксиду з водою. Випробування водного розчину добутої речовини індикаторами»: https://www.youtube.com/watch?v=SfOG9vEt33c
- «Пропускання вуглекислого газу через воду і через розчин кальцій гідроксиду»: https://www.youtube.com/watch?v=ddd6JV_7B2E
![]() Основні оксиди взаємодіють з кислотами, утворюючи сіль і воду:
Основні оксиди взаємодіють з кислотами, утворюючи сіль і воду:
Чорний порошок купрум(ІІ) оксиду СuО помістимо в хімічний стакан. Доллємо трохи розведеної сульфатної кислоти. Для початку реакції одного контактування речовин недостатньо, потрібне нагрівання. Злегка нагріємо стакан з речовинами, не доводячи розчин до кипіння. У результаті реакції чорний порошок купрум(IІ) оксиду поступово зникає. Утворюється розчин блакитного кольору (рис. 23.3):
CuO + H2SO4 → CuSO4 + Н2О.
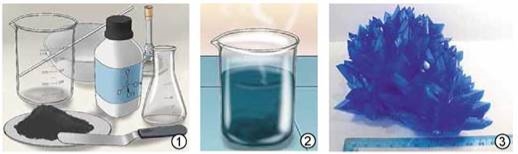
Рис. 23.3. Взаємодія купрум(ІІ) оксиду з розведеною сульфатною кислотою. 1. Реактиви й обладнання. 2. Водний розчин продукту реакції - купрум(ІІ) сульфату CuSO4. 3. Кристал мідного купоросу
Ця реакція належить до реакцій обміну.
Реакція обміну — це реакція між двома складними речовинами, у результаті якої вони обмінюються своїми складовими частинами. Продукти реакції — дві нові складні речовини.
![]() Основні оксиди можуть взаємодіяти з кислотними і амфотерними оксидами, утворюючи солі:
Основні оксиди можуть взаємодіяти з кислотними і амфотерними оксидами, утворюючи солі:
Наприклад, унаслідок взаємодії кальцій оксиду з карбон(ІV) оксидом утворюється кальцій карбонат:
СаО + СО2 → СаСО3.
 Кислотними оксидами є більшість оксидів неметалічних елементів (SO3, Р2О5 тощо). Вищі оксиди металічних елементів зі змінною валентністю також виявляють переважно кислотні властивості, наприклад: CrO3, Mn2O7, V2O5. Зв’язок між хімічними елементами, їхніми кислотними оксидами та гідратами оксидів зображено на рисунку 23.4.
Кислотними оксидами є більшість оксидів неметалічних елементів (SO3, Р2О5 тощо). Вищі оксиди металічних елементів зі змінною валентністю також виявляють переважно кислотні властивості, наприклад: CrO3, Mn2O7, V2O5. Зв’язок між хімічними елементами, їхніми кислотними оксидами та гідратами оксидів зображено на рисунку 23.4.
Рис. 23.4. Зв’язок між хімічними елементами, їхніми оксидами та гідратами оксидів
![]() Хімічні властивості кислотних оксидів. Вам уже відомо, що кислотні оксиди можуть взаємодіяти з водою, утворюючи кислоти:
Хімічні властивості кислотних оксидів. Вам уже відомо, що кислотні оксиди можуть взаємодіяти з водою, утворюючи кислоти:
Так, продуктом реакції сульфур(VІ) оксиду з водою є сульфатна кислота:
SO3 + Н2O → H2SO4.
Унаслідок взаємодії фосфор(V) оксиду з водою утворюється ортофосфатна кислота (рис. 23.5):
P2O5 + H2O → H3РО4.

Рис. 23.5. Фосфор(V) оксид бурхливо реагує з водою. Метиловий оранжевий набув у водному розчині продукту реакції рожевого кольору
Зверніть увагу: силіцій(ІV) оксид SiO2 з водою не реагує!
• Перетворіть схему реакції фосфор(V) оксиду з водою на хімічне рівняння. До якого типу належать реакції оксидів з водою?
![]() Кислотні оксиди взаємодіють з лугами. Продуктами реакції є сіль і вода:
Кислотні оксиди взаємодіють з лугами. Продуктами реакції є сіль і вода:
Наприклад, унаслідок взаємодії сульфур(ІV) оксиду з натрій гідроксидом утворюється натрій сульфіт і вода:
SO2 + 2NaOH → Na2SO3 + Н2О.
![]() 3. Кислотні оксиди можуть реагувати з основними оксидами, утворюючи солі:
3. Кислотні оксиди можуть реагувати з основними оксидами, утворюючи солі:
Приміром, продуктом взаємодії карбон(ІV) оксиду з барій оксидом є барій карбонат:
СО2 + ВаО → ВаСО3.
Щоб скласти рівняння цієї реакції, потрібно виконати такі дії:
1) визначити за формулою кислотного оксиду хімічну формулу відповідної йому кислоти, формулу кислотного залишку і його валентність;
2) визначити за формулою основного оксиду валентність металічного елемента;
3) скласти за валентністю формулу солі;
4) записати схему реакції і перетворити її на хімічне рівняння.
Демонстрація:
- «Взаємодія кислотних оксидів з водою»: https://www.youtube.com/watch?v=SCNpbR-vvF8&ab_channel=%D0%86%D1%80%D0%B8%D0%BD%D0%B0%D0%AF%D1%80%D0%BE%D1%88
- «Взаємодія основних оксидів з водою»: https://www.youtube.com/watch?v=D-xMtWWIh0w&ab_channel=Allhemi-
5). Діагностика рівня засвоєних учнями знань і навичок та їх кореляція
1. Класифікуйте оксиди FeO, SO3, Na2O, СО2, N2O5, BaO, P2O5, SO2, Na2O, K2O, MnO.
2. Наведіть по два приклади основних, кислотних і амфотерних оксидів.
3. Назвіть найважливіші індикатори.
4. Схарактеризуйте хімічні властивості основних оксидів на прикладі літій оксиду.
5. Схарактеризуйте хімічні властивості кислотних оксидів на прикладі сульфур(VІ) оксиду.
6). Закріплення нового навчального матеріалу
1. Оксид одного з хімічних елементів реагує з водою. У водному розчині продукту реакції фенолфталеїн набуває малинового забарвлення. Класифікуйте оксид. Поясніть, до якого класу неорганічних сполук належить продукт його гідратації.
2. Оксид одного з хімічних елементів реагує з водою. У водному розчині продукту реакції метиловий оранжевий набуває рожевого забарвлення. Класифікуйте оксид. Поясніть, до якого класу неорганічних сполук належить продукт його гідратації.
3. Відтворіть хімічні рівняння за наведеними фрагментами, визначте, які з них відповідають реакціям обміну:
a) SO3 + ... = Na2SO4 + Н2О;
б)... + Н2О = Ва(ОН)2;
в) SiO2 + ... = CaSiO3;
г) СrО3 + ... = Н2СrО4;
д)... + FeO = FeSO4 + Н2О;
е) НВr + ... = СаВr2 + Н2О.
7) Підведення підсумків уроку
Гра «Смайлики»
(Перевірити настрій учнів, але для цього повинні бути наперед приготовлені вчителем смайлики різного настрою ) Виставлення оцінок.
8) Пояснювальне ознайомлення з домашнім завданням
Опрацювати §26.
Виконати завдання №192 (ст. 149), № 193, 194 (ст. 150)


про публікацію авторської розробки
Додати розробку
