Тема: Розв’язання задач на виведення формули органічної сполуки за даними про масу та об’єм реагентів або продуктів реакції.
Урок № 8
Тема: Розв’язання задач на виведення формули органічної сполуки за даними про масу та об’єм реагентів або продуктів реакції.
Мета: вдосконалювати вміння розв’язувати задачі на встановлення формули речовини за даними про реагенти та продукти реакції, розвивати аналітичне та логічне мислення, використання математичного апарату для розв’язання хімічних задач, виховувати навички самостійності в роботі, уважність та толерантність.
Тип уроку: урок удосконалення знань.
Обладнання: презентація до уроку.
Очікувані результати: учень розвязує задачі на виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною, масою, об’ємом або кількістю речовини реагентів або продуктів реакції, обгрунтовуючи обраний спосіб розв’язання.
Хід уроку
І. ОРГАНІЗАЦІЙНИЙ ЕТАП
ІІ. ПОСТАНОВКА МЕТИ УРОКУ, ОГОЛОШЕННЯ ЗАВДАНЬ УРОКУ, МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ
ІІІ. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Перевірка домашнього завдання
Розв’язання задач
IV. ОСНОВНА ЧАСТИНА УРОКУ
Задача
На згоряння 0,5 моль алкену витратили 33,6 л кисню (н.у.). Встановити формулу алкену.
У таких задачах використовуємо знання про загальну формулу ряду речовин та співвідношення молей у рівнянні реакції.
Дано: Розв’язання
n(CnH2n) = 0,5 моль CnH2n + О2 → nСО2 + nН2О
V(O2) = 33,6 л
CnH2 n -? n(О2) = 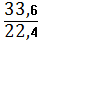 = 1,5 моль.
= 1,5 моль.
1 моль алкену реагує з моль кисню.
0,5 моль алкену реагує з 1,5 моль кисню.
Рівняння: ![]() = 0,5;
= 0,5;
n = 2.
Отже речовина C2H4
Задача
Алкан масою 2,2 г за н.у. займає об’єм 1,12 л. Обчисліть його молекулярну масу та встановіть формулу.
![]() Дано: Розв’язання:
Дано: Розв’язання:
m(CnH2n+2) = 2,2 г 1) Обчислюємо відносну молекулярну масу алкану
![]() V(CnH2n+2) = 1,12 л за формулою
V(CnH2n+2) = 1,12 л за формулою ![]() =
= ![]() Vm = 22,4 л/моль.
Vm = 22,4 л/моль.
CnH2n+2 - ? M = ![]() .
.
M(CnH2n+2) = 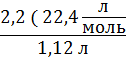 = 44 г/моль.
= 44 г/моль.
2) Обчислюємо кількість атомів карбону
СnH2n+2 = 12n + 2n + 2 = 44 г/моль
14n +2 = 44
14n = 42
n = 42 : 14
n = 3
С3
M(C3) = 12 3 = 36 г/моль
M(Н)= 44 – 36 = 8 г/моль
n(Н) = 8 : 1 = 8
С3Н8 – пропан
Задача
Етиленовий вуглеводень масою 16,8 г приєднує 4,48 л бромоводню. Знайдіть формулу сполуки.
![]() Дано: Розв’язання:
Дано: Розв’язання:
m(CnH2n) = 16,8 г 1) Записуємо рівняння.
![]() V(НBr) = 4.48 л 2) Урівнюємо рівняння.
V(НBr) = 4.48 л 2) Урівнюємо рівняння.
Формула - ?
3) Підписуємо у рівнянні речовини
16,8 г 4,48 л
CnH2n + НBr = CnH2n+1Br
V = 1 моль V = 1 моль
M = x г/моль V = 22,4 л/моль
m = х г V = 22,4 л
4) Складаємо пропорцію
![]() =
= ![]()
х = ![]() = 84 г
= 84 г
5) Знаходимо формулу та як алкен має загальну формулу CnH2n, а
M(C) = 12 г/моль
M(Н)= 1 г/моль
Підставляємо у формулу
m = n(C)M(C) + 2n(H) M(H)
84 = n 12 + 2n 1
84 = 14n
n = 84 : 14
n = 6
Формула - С6Н12.
Задача
Визначте формулу вуглеводню, якщо 4,2 г алкену приєднують 2,24 л хлороводню (н.у.). Дайте назву реагентам і продуктам реакції.
![]() Дано: Розв’язання:
Дано: Розв’язання:
m(CnH2n) = 4,2 г 1) Y(НСl) = = 0,1 (моль)
= 0,1 (моль)
V(НСl) = 2,24 л
![]()
Формула - ?
Отже, і вуглеводню буде 0,1 моль, а молекулярна маса речовини дорівнює:
M=m:n
M = ![]() = 42 г/моль.
= 42 г/моль.
CnH2n = 42;
12n + 2n = 42;
n = 3.
С3Н6 + НСl = С3Н7Сl
пропен хлорпропіл
Задача
1 л газоподібного насиченого вуглеводню має масу 1,339 г (н.у.). назвіть цей вуглеводень.
Розвязання:
М(реч)=pVm
М(реч.) = 1,339 22,4 = 30 г/моль;
CnH2n+2 = 12n + 2n + 2 = 30;
14n = 28;
n = 2.
Це етан. С2Н6.
М (С2Н6) = 30 г/моль.
Задача
Знайдіть формулу насиченого вуглеводню, якщо масова частка Карбону становить 83,33%, Гідрогену – 16,67%. Густина за воднем дорівнює 29.
Дано: Розв’язання:
![]() ώ(C) = 83,33% 1) Обчислюємо молекулярну масу речовини:
ώ(C) = 83,33% 1) Обчислюємо молекулярну масу речовини:
ώ(Н) = 16,67% М(CxHy) = 29 2 = 58 (г/моль).
![]() DН2 = 29
DН2 = 29
n(C) - ?
n(H) - ?
2) Обчислюємо кількість атомів Карбону й Гідрогену:
n(C) = ![]() = 7;
= 7;
n(H) = ![]() = 16,67.
= 16,67.
С : Н = : ![]() = 1 : 2,5 = 4 : 10.
= 1 : 2,5 = 4 : 10.
М(С4Н10) = 58 г/моль.
Задача
У результаті спалювання 1,4 г вуглеводню одержали 4,4 г вуглекислого газу й 1,8 г води. Визначте формулу вуглеводню, якщо 16 мл (н.у.) його мають масу 0,05 г. Дайте назву можливим двом його ізомерам.
Дано: Розв’язання:
![]() m(реч.) = 14 г 1) Обчислюємо відносну молекулярну масу речовини
m(реч.) = 14 г 1) Обчислюємо відносну молекулярну масу речовини
М(CO2) = 4,4 г 1 моль речовни за н.у. дорівнює 22,4 л, тоді
m(H2O) = 1,8 г 0,016 л – 0,05 г 22,4 л – х г
V(реч.) = 0,016 л ![]() =
= ![]()
m(реч.) = 0,05 х = 70 (г).
![]()
Формула - ?
2) Обчислюємо кількість речовини вуглекислого газу.
М(CO2) = 12 + 32 = 44 (г/моль).
Y(CO2) = ![]() = 0,1 (моль).
= 0,1 (моль).
3) Скільки грамів вуглецю міститься в 0,1 моль СО2?
х = 12 0,1 = 1,2 (г).
4) Обчислюємо кількість речовини води в речовині.
M(H2O) = 2 + 16 = 18 (г/моль).
Y(H2O) = ![]() = 0,1 (моль).
= 0,1 (моль).
5) Кількість грамів Гідрогену у воді:
х = 2 0,1 = 0,2 (г)
6) Скільки атомів Карбону й Гідрогену в молекул?
С : Н = ![]() :
: ![]() = 0,1 : 1,2 = 1 : 2.
= 0,1 : 1,2 = 1 : 2.
7) Найпростіша формула речовини СН2.
M(СH2) = 14 г/моль, тоді істинна формула:
![]() = 5.
= 5.
С5Н10 пентен.
Ізомери:
- СН2 = СН СН СН3
|
СН3
3-метил-1-бутен
- СН3
|
СН3 С = СН СН3
3-метил-2-бутен
IV. ПІДБИТТЯ ПІДСУМКІВ УРОКУ. ОЦІНЮВАННЯ ЗНАНЬ
V. ДОМАШНЄ ЗАВДАННЯ
1. Опрацюйте параграф.
2. Розв’яжіть задачу.
Ацетиленовий вуглеводень, маса якого становить 10,8 г, повністю прореагував з 14,6 г хлороводню. Визначте формулу сполуки.


про публікацію авторської розробки
Додати розробку
