Тема уроку "Кислоти та їх назви"
Тема. Кислоти: номенклатура, класифікація. Фізичні властивості кислот.
Мета: розширити знання про класифікацію неорганічних кислот;
ознайомити учнів із класифікацією кислот за складом, номенклатурою кислот;розглянути фізичні влативості; ознайомити з поширеністю кислот у природі та їх використанням., розвивати вміння логічно та критично мислити, творчо використовувати отриману інформацію, порівнювати та систематизувати.
Тип уроку: засвоєння нових знань
Обладнання: періодична система хімічних елементів Д.І.Менделєєва, таблиця розчинності.
Хід уроку
І. Організаційний етап
Привітання, перевірка готовності учнів до уроку.
ІІ.Перевірка домашнього завдання. Перевірка виконання письмових завдань.
Самостійна робота
Напишіть назви оксидів:
СО ----
К2О ----
АІ2О3 -----
СиО ------
Допишіть хімічні рівняння:
К2О + Н2О =
СО2 + Н2О =
СиО + Н2О =
ІІ. Актуалізація опорних знань
-
„Мозковий штурм”.
- Що спільного між лимоном, томатом, квашеною капустою, щавлем і кефіром? (кислий смак)
- Чому чай після додавання лимону світлішає? (кислота змінює забарвлення)
- Чому кефір, ряжанка, сметана, відноситься до молочно – кислих продуктів? ( до їх складу входить молочна кислота)
„Дешифрувальник”. За першими літерами назв хімічних елементів, вказаних порядкових номерів (ПСХЕ) назвати слово.
Мотивація


Саме так, сьогодні мова піде саме про кислоти. Запитання до учнів – Які асоціації викликає у вас слово „кислота”? (лимон, кислий)
Розповідь вчителя.
У лимонах міститься лимонна кислота, у щавлі – щавлева, у яблуках – яблучна, а в оцті, що утворюється при бродінні виноградного або яблучного соку - оцтова. Все це приклади органічних кислот.
Ми сьогодні на уроці дізнаємося , які є ще кислоти.
Учні формулюють питання, які слід розглянути на уроці:
-Що таке кислоти, який склад вони мають?
-Які назви мають кислоти?
-За якими ознаками класифікують кислоти?
- Фізичні властивості кислот?
-Де використовуються кислоти?
VІ. Вивчення нового матеріалу.
- Склад та назви кислот.
Завдання:
Порівняйте склад кислот, визначте спільне. HCІ, H2SO4, HNO3.( на дошці)
У всіх кислот є атом гідрогену, символ Гідрогену стоїть на першому місці у формулах кислот.
Учитель зауважує, що у формулах кислот можна виділити кислотний залишок. До складу кислотного залишку може входити атом або група атомів.
Учні за допомогою вчителя дають визначення кислот:
Кислоти – це складні речовини, до складу яких входять атоми Гідрогену й кислотний залишок.

Дивитя таблицю розчинності на кислотні залишки або
- Класифікація кислот.
Валентність кислотного залишку дорівнює числу атомів Гідрогену в молекулі кислоти.
Запитання учням: чому? (тому що валентність Гідрогену завжди дорівнює І).
Познайомимося з назвами кислот за сучасною українською номенклатурою.
Таблиця
|
Формула кислоти |
Назва кислоти |
Кислотний залишок |
Валент- ність кислот-ного залиш-ку |
Назва солі |
|
HCl |
Хлоридна (соляна) |
Cl- |
І |
Хлорид |
|
HBr |
Бромідна |
Br- |
І |
Бромід |
|
HI |
Йодидна |
I- |
І |
Йодид |
|
HF |
Фторидна |
F- |
І |
Фторид |
|
H2S |
Сульфідна |
S2- |
ІІ |
Сульфід |
|
HNO3 |
Нітратна (V) (азотна) |
NO3- |
І |
Нітрат |
|
H2CO3 |
Карбонатна (вугільна) |
CO32- |
ІІ |
Карбонат |
|
H2SiO3 |
Силікатна (кремнієва) |
SiO32- |
ІІ |
Силікат |
|
H2SO3 |
Сульфітна (ІV) (сірчиста) |
SO32- |
ІІ |
Сульфіт |
|
H2SO4 |
Сульфатна (VI) (сірчана) |
SO42- |
ІІ |
Сульфат |
|
H3PO4 |
Ортофосфат-на (фосфорна) |
PO43- |
ІІІ |
Ортофос-фат (фосфат) |
Дивитися табл. Підручник
Бесіда:
- Зверніть увагу на дані формули кислот. (Таблиця)
- Що спільного? (кожна має атоми Гідрогену)
- Чим відрізняються? (кількістю атомів Гідрогену та наявністю атомів Оксигену)
Кислоти можна класифікувати за цілим рядом ознак:
-за кількістю атомів Гідрогену;
-за наявністю атомів Оксигену
1) Класифікація за кількістю атомів Гідрогену
![]()
![]()
![]() к и с л о т и
к и с л о т и
одноосновні двоосновні трьохосновні
HBr, HCl H2S, H2CО3 H3РО4
2) Класифікація за наявністю атомів Оксигену
к и с л о т и
![]()
![]()
оксигеновмісні безоксигенові
H2CО3, HNО3 HBr, HCl, H2S
- Фізичні властивості кислот.( робота з підручником)ст. 55
За стандартних умов багато кислот – рідини (H2SO4,)або тверді(H3РO4, H2SiO3).
Деякі кислоти леткі (НСІ, НNO3) вони мають задушливий запах. Майже всі кислоти безбарвні. Кислоти це їдкі речовини ,особливо сульфатна, нітратна, хлоридна. Вони розїдають папір, деревину, тканини, спричиняють хімічний опік
1. Обчисліть масову частку Гідрогену в сульфатній кислоті
ω (H/H2SO4) = 2/98 = 2,0%
Використання кислот.
(випереджальне завдання, виступ учня)
. Кислоти є дуже поширеними речовинами. У своєму житті ви дуже часто з ними стикаєтесь. В багатьох овочах, фруктах і ягодах містяться органічні кислоти – лимонна, яблучна, щавлева, виноградна, винна, янтарна. При скисанні продуктів також утворюються кислоти. Навколо нас зустрічаються також неорганічні кислоти. Навіть прісна вода містить невеликі домішки карбонатної кислоти завдяки розчиненню в ній вуглекислого газу. Дощова вода часто містить домішки сульфітної або сульфідної кислот, які потрапляють у повітря під час виверження вулканів. У шлунку завжди міститься розчин хлоридної кислоти.
Кислоти є одними з найважливіших речовин у промисловості, і не тільки в хімічній. Найбільша увага приділяється сульфатній, нітратній, хлоридній та фосфатній кислотам. Їх добувають на хімічних заводах у величезних кількостях, особливо сульфатну. Без цих кислот неможливо виготовляти метали, тканини, папір, мінеральні добрива тощо. Величезні об`єми сульфатної кислоти витрачаються у виробництві кольорових металів, мийних засобів, ліків і барвників, вибухових матеріалів, акумуляторів і сірників.
У великих кількостях кислоти використовує і харчова промисловість, і не тільки як смакові приправи для надання кислого смаку. В більшості випадків кислоти (оцтова, лимонна, бензойна, винна, щавлева) використовуються як консерванти – речовини, які уповільнюють псування харчових продуктів.
V. Узагальнення та систематизація знань
Завдання.
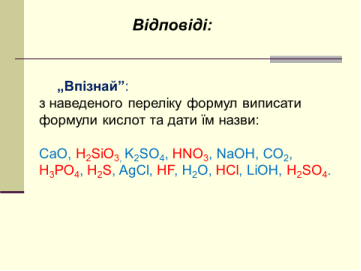
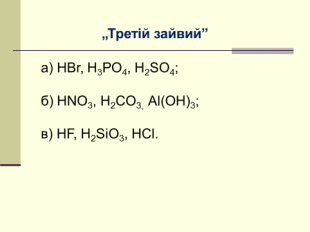

VІ. Домашнє завдання
Опрацювати параграф 8, вивчити на пам'ять кислоти.
VІІ. Підсумки уроку
Складання сенкану
Кислоти
Кислі, їдкі
Розчиняються, подразнюють, знешкоджують
Кислоти необхідні для життя
Речовини
Додаток
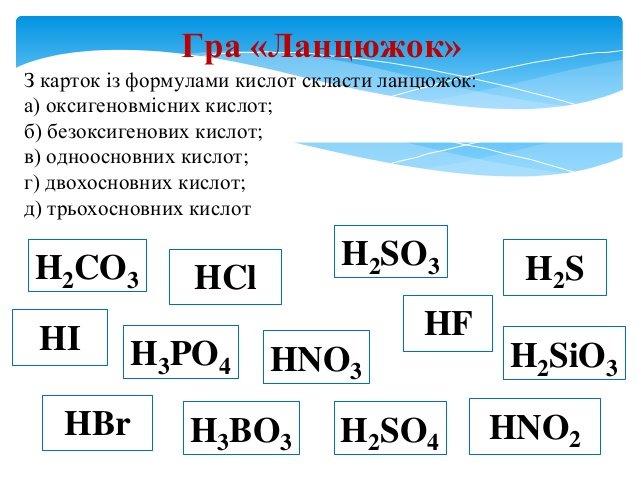
|
Формула кислоти |
Назва кислоти |
Кислотний залишок |
Назва солі |
|
HCl |
Хлоридна (соляна) |
Cl- |
Хлорид |
|
HBr |
Бромідна |
Br- |
Бромід |
|
HI |
Йодидна |
I- |
Йодид |
|
HF |
Фторидна |
F- |
Фторид |
|
H2S |
Сульфідна |
S2- |
Сульфід |
|
HNO3 |
Нітратна (азотна) |
NO3- |
Нітрат |
|
H2CO3 |
Карбонатна (вугільна) |
CO32- |
Карбонат |
|
H2SiO3 |
Силікатна (кремнієва) |
SiO32- |
Силікат |
|
H2SO3 |
Сульфітна (сірчиста) |
SO32- |
Сульфіт |
|
H2SO4 |
Сульфатна (сірчана) |
SO42- |
Сульфат |
|
H3PO4 |
Ортофосфат-на (фосфорна) |
PO43- |
Ортофос-фат (фосфат) |
Використання кислот.
виступ учня)
. Кислоти є дуже поширеними речовинами. У своєму житті ми дуже часто з ними стикаємося. В багатьох овочах, фруктах і ягодах містяться органічні кислоти – лимонна, яблучна, щавлева, виноградна. При скисанні продуктів також утворюються кислоти. Навколо нас зустрічаються також неорганічні кислоти. Навіть прісна вода містить невеликі домішки карбонатної кислоти завдяки розчиненню в ній вуглекислого газу. Дощова вода часто містить домішки сульфітної або сульфідної кислот, які потрапляють у повітря під час виверження вулканів. У шлунку завжди міститься розчин хлоридної кислоти.
Кислоти є одними з найважливіших речовин у промисловості, наприклад у хімічній. Найбільша увага приділяється сульфатній, нітратній, хлоридній та фосфатній кислотам. Їх добувають на хімічних заводах у величезних кількостях, особливо сульфатну. Без цих кислот неможливо виготовляти метали, тканини, папір, мінеральні добрива тощо. Величезні об`єми сульфатної кислоти витрачаються у виробництві кольорових металів, мийних засобів, ліків і барвників, вибухових матеріалів, акумуляторів і сірників.
У великих кількостях кислоти використовує і харчова промисловість, і не тільки як смакові приправи для надання кислого смаку. В більшості випадків кислоти (оцтова, лимонна, бензойна, винна, щавлева) використовуються як консерванти – речовини, які уповільнюють псування харчових продуктів.
Самостійна робота
Напишіть назви оксидів:
СО ----
К2О ----
АІ2О3 -----
СиО ------
Допишіть хімічні рівняння:
К2О + Н2О =
СО2 + Н2О =
СиО + Н2О =
Самостійна робота
Напишіть назви оксидів:
СО ----
К2О ----
АІ2О3 -----
СиО ------
Допишіть хімічні рівняння:
К2О + Н2О =
СО2 + Н2О =
СиО + Н2О =
Самостійна робота
Напишіть назви оксидів:
СО ----
К2О ----
АІ2О3 -----
СиО ------
Допишіть хімічні рівняння:
К2О + Н2О =
СО2 + Н2О =
СиО + Н2О =
Самостійна робота
Напишіть назви оксидів:
СО ----
К2О ----
АІ2О3 -----
СиО ------
Допишіть хімічні рівняння:
К2О + Н2О =
СО2 + Н2О =
СиО + Н2О =
Самостійна робота
Напишіть назви оксидів:
СО ----
К2О ----
АІ2О3 -----
СиО ------
Допишіть хімічні рівняння:
К2О + Н2О =
СО2 + Н2О =
СиО + Н2О =


про публікацію авторської розробки
Додати розробку
