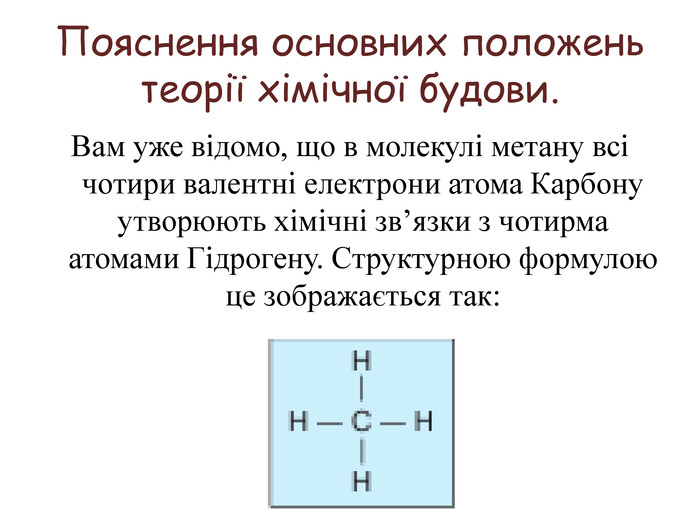
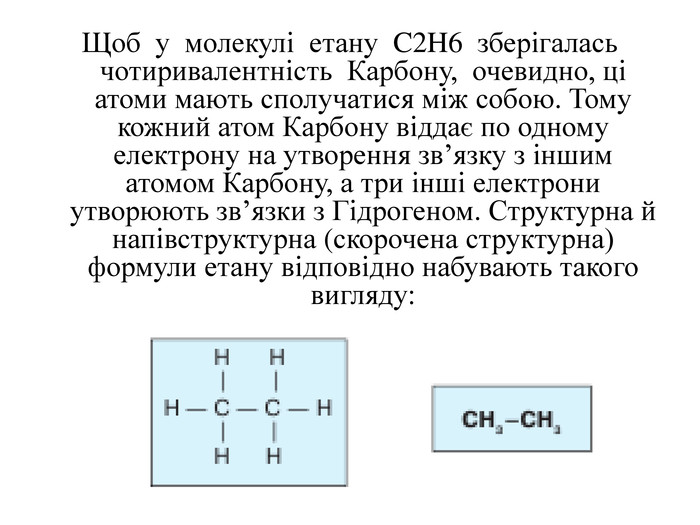
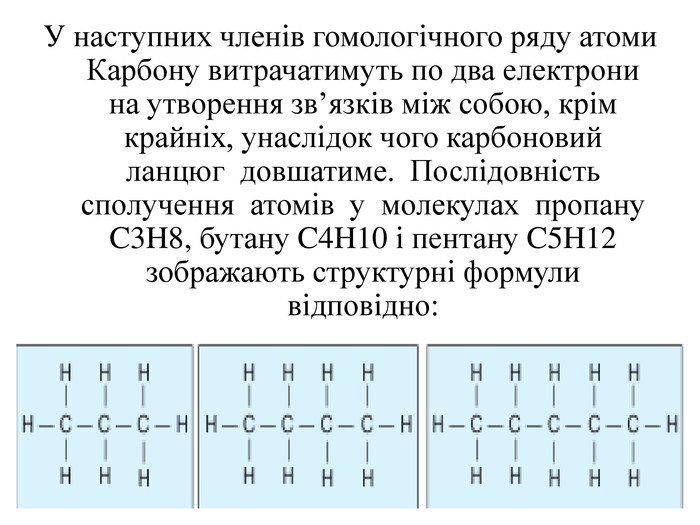
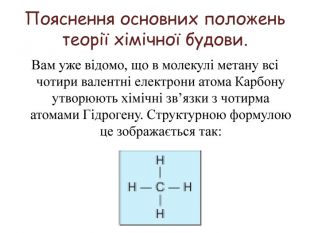
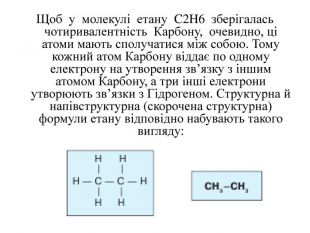
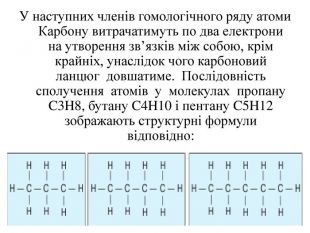
Теорія будови органічних сполук. Залежність властивостей речовин від складу і хімічної будови молекул.
Про матеріал
Презентація до уроку на тему: "Теорія будови органічних сполук. Залежність властивостей речовин від складу і хімічної будови молекул." Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку