Творча робота: "Створення оптимальних психологодидактичних умов навчання на уроках хімії"
Департамент освіти і науки Миколаївської обласної державної адміністрації
Кривоозерський професійний аграрний ліцей
Творча робота з теми: «Створення оптимальних психолого - дидактичних умов навчання на уроках хімії».
З досвіду роботи вчителя хімії, біології
Штим Світлани Михайлівни
З М І С Т
І. Є одне благо — знання і одне тільки зло — неуцтво Сократ.
II. Створення психологодидактичних умов на уроках хімії — важливий засіб формування цілісної системи особистісних знань.
1. Вплив психологічного стану учнів на продуктивність їх роботи в умовах кабінетної системи.
2. Диференціація ї індивідуалізація як основа творчого здобуття хімічних знань
3. Формування цілісного поняття про світ шляхом інтегративного підходу до викладання предмета.
4. Творче застосування учнями добутих знань у позакласній роботі.
III шлях до пізнання нескінчений...
«Радість бачити і розуміти — є найцінніший дар природи». А.
ЕЙНШТЕЙН.
Робота Вчителя багатогранна. Він відчуває себе ключиком від царства Добра і Справедливості, Розуміння, дитячих мрій і дорослих сподівань нашого майбутнього. Тому покликання Вчителя — виховати учнів, здатних завтра генерувати новітні науково-технічні ідеї в поєднанні з високою енергетикою Добра Духовності. Ми повинні виховувати в них силу духу, стійку волю та високу духовність, допомогти доторкнутись до процесу пізнання, знайти своє покликання, навчити любити, бачити. Навчити гідності.
Цей процес творчості безперервний, в ньому сенс життя вчительської родини. І, в найбільшій мірі цей а процес відбувається на уроках. В учителя кожний урок — прем'єра. Він повинен мобілізувати себе, привести в «бойову» готовність весь свій педагогічний і психологічний арсенал, щоб легко і не вимушено ввести дітей у світ наукових відкриттів.
А уроки хімії особливі. На цих уроках учні повинні навчитись спостерігати навколишній світ, задумуватись над його внутрішньою суттю, причинами, що викликають зміни в ньому, аналізувати умови, що визначають різні тенденції його розвитку.
Ось чому якість уроку — одне з головних завдань учителя. Мета уроку — не механічне формування знань, умінь, навичок учнів, а розвиток глибокого інтересу до хімії як науки. Від того, як побудований урок, чим насичений, на скільки цікавий, динамічний, залежить коефіцієнт корисної дії нашої праці.
Методи викладання вчителя — інформаційні та проблемні, методи навчання школярів — репродуктивні та пошукові. Розробка системи мотивації навчання, науковість, доступність, логічність викладання матеріалу, застосування випереджуючого навчання надають уроку розвиваючого і творчого характеру, реалізують наукові і виховні можливості уроку забезпечують безперервний зворотний зв’язок.
Лекції, семінари, бесіди, експерименти, заліки, тести активізують пізнавальну діяльність учнів. Для роботи використовується додаткова література, що підвищує інформативність, розробляються проблемні ситуації, вирішуються творчі завдання.
На уроках учні можуть дискутувати, що дає можливість обмінюватися враженнями. активізувати розумову діяльність, формувати вміння учнів висловлювати власні ідеї і думки, а також вміння вислухати, врахувати, критично оцінити думки товаришів.
Навчання повинне йти від здивування, здивування породжує інтерес, від інтересу —- до постановки питань, від них — до роздумів, які приведуть до висновків. І завдання вчителя — відтворити, змоделювати таку ситуацію.
Заходячи в клас, учитель повинен принести з собою посмішку, лагідність, біополе радості спілкування. Ви стоїте перед дверима класу, в який входите вперше як учитель хімії. Ви внутрішньо зібрані, підтягнуті, спокійні, бо до цієї зустрічі ви познайомились з «візитною» карткою класу і вже приблизно орієнтуєтесь, який інтелектуальний рівень учнівського колективу, які підводні рифи можуть вас чекати у цьому вирі шкільного життя. Тому ви розмістите учнів так, щоб у кабінеті хімії їм було комфортно: щоб сильний міг проявити своє лицарство по відношенню до слабшого, щоб слабший не боявся чи соромився допомоги сильнішого, щоб діти із ослабленим зором чи слухом не відчували цієї вади, а потенційні підбурювачі безладу були у вас під рукою.
Якщо це ви зробили самі, чи за допомогою класного керівника — ви уникнули багатьох проблем дисципліни в класі.
— Ви сіли всі? Вам зручно? Ви гарно бачите дошку, демонстраційний стіл, учителя?
Все гаразд. Ми підходимо до одного із найважливіших моментів: ми вводимо дітей у світ однієї із найчудесніших наук — світ хімії. Світ неповторний, як наше життя. 1 вам потрібно запалити вогник любові до цієї науки не на чотири роки, а на все життя. Тому ви повинні добиватись виконання основної мети: зробити процес навчання спокійним, радісним, захоплюючим і завершеним.
Ви починаєте не із «чистого листа». До вас «граніт науки» шліфувало багато вчителів. Ви зобов’язані використати ті знання, що закладені у свідомості учнів. Тому ви із перших кроків починаєте привчати учнів до того, що вони творять науку хімію разом з вами, творять на кожному уроці.
Так, це природнича наука. Але ж стільки ж наук про природу! Які це науки? Це ми знаємо. А тепер беремо в руки шматок вугілля. Що про нього знає наука?
Фізика — що воно чорне, тверде, крихке. Біологія — як воно утворилося, а географія — де його поклади.
Що ж залишається хімії? Давайте розкриємо колекцію «Вугілля і продукти його переробки». Ми тільки заглянули у шпаринку до царства цієї науки. Але панорама нас заворожує, захоплює у полон не на один день — 200 речовин добуває хімія із вугілля: від коксу до вибухових речовин, барвників, ліків... І на такому ж емоційному підйомі ми закінчуємо курс вивчення хімії на останніх уроках в 11-му класі. Це - урок-конференція «Світ хімії».
Кабінет хімії перетворюється у редакцію журналу «Світ хімії з її відділами», «Хімія у будівництві», «Хімія у косметиці», «Хімія у медицині», «Хімія металів», «Хімія у побуті»...
Заклад державний, коштів обмаль — наша типова ситуація відділи необхідно скоротити. З цієЇ причини приїжджає інспектор. Завдання кожного відділу: не тільки відстояти право на своє існування, але й довести неможливість його скорочення. Тому групою учнів готується не тільки науковий матеріал, але й виставка виробів цієї галузі промисловості. Працює весь клас. Учні підбирають матеріали, дискутують. Вони доводять на основі фактів, що жоден із відділів скорочувати не можна, а, навпаки, виноситься вердикт «Журнал життєво необхідний, його потрібно не тільки зберегти, але й розширити, створивши нові розділи».
Ось як приклад підбірка матеріалу відділу «Хімія полімерів».
Зовнішній вигляд живих істот — німий виклик, що кидає Природа хімії. Скільки розуму, таланту, винахідливості повинні мати вчені, щоб створити еластичну шкіру, пухнасте хутро, барвники найрізноманітніших відтінків, щоб наближено були подібні до тих, що ми бачимо на цих фотографіях.
Органічна хімія — це хімія сполук карбоном. Якщо при створенні невеликих молекул карбон нічим не відрізняється від інших елементів періодичної системи, то три утворенні молекул-гігантів рівних йому немає. Тільки силіцій може складати йому конкуренцію в цій області. Серед високомолекулярних сполук найбільш відомі полімери. Серед добутих хіміками синтетичних полімерів — пластмаси, гума, лаки, фарби, штучні волокна. Що не крок, то зустріч з полімерами. Вибігли в магазин по хліб — в руках поліетиленовий пакет, дали соску малій дитині — гума і пластмаса. А чим записати урок, зробити домашнє завдання? Звичайно, пластмасовою шариковою ручкою. А подивись на свою шкільну — та й не тільки шкільну сумку... Без полімерів сьогодні наше життя просто неможливе. Більшість людей хочуть схуднути. Але ця проблема стосується і автомобілів станків, приладів, радіо- і телеприймачів, літаків... А тут в основному допомагають полімери. Подивіться в автомобіль: обшивка салону — поліуретани, штурвал — етроли на основі ацетобутирату целюлози, лобове скло — без осколочний триплекс (багатошарове силікатне скло з проміжним шаром із полівінілбутералі). Не за горами і повністю полімерний автомобіль з керамічним двигуном, одним із створювачів якого може бути хто несуть із нинішніх хіміків.
З літаками складніше — до полімерних матеріалів вимоги суворіші через великий перепад температур, солідні механічні навантаження. Але й для них знайшли полімери, наприклад, поліаміди, які зберігають свої фізико-хімічні властивості в інтервалі від 270 до 300 °С. Поліамідні пінопласти — відмінна високотемпературна звукоізоляція в реактивних двигунах. Створена і електропровідна пластмаса на основі поліацетилену і поліаміду. У найближчий час ми познайомимося з нею докладніше» коли на зміну батареям опалення прийдуть тонкі ворсисті паласи — пластики, які можна буде покласти на підлогу або повісити на стіну.
А як ви подивитесь на яблуко, розміром з людську голову, на виноград розміром із сливу. Треба подивуватись мистецтву вчених та інженерів - полімерників, що створили біологічно активні полімери — стимулятори росту.
Про все не розповісти, хоч цікавого дуже багато: штучне серце і штучні нирки, кровозамінники, контактні лінзи, упаковки що можна з’їсти, полімерні мембрани.
Але головне завдання хіміків замінити дефіцитну природну сировину полімерними матеріалами. Вже зараз створені матеріали, що замінюють і навіть випереджають їх. А синтетичні тканини, що за своїми властивостями близькі до натуральних? Тому наступна сторінка присвячена «Хімії і новим матеріалам».
Хімії під силу перетворення які здатні перекроїти на свій лад матеріал так, що він набуває властивостей, котрі для нього не характерні. Тому у двері хімічних лабораторій стукають енергетики, машинобудівники, медики, харчовики, мікробіологи, фармацевти, будівельники і аграрії.
Між цими уроками напружене шкільне життя впродовж чотирьох років.
1 майже кожен урок — урок вивчення нового матеріалу. Це важко і для учителя, і для учня. Як зекономити час? Як включити в роботу всі види пам’яті учнів? Є багато можливостей. Але, насамперед, це ваш запис на дошці. Він-охайний і повністю відтворює хід уроку: від вашого першого слова і до останнього. Це потрібно для того, щоб одним поглядом учень міг охопити всю панораму уроку. Щоб використовуючи записи на дошці, він знайшов відповіді на ваші запитання при закріпленні матеріалу. Щоб на основі алгоритму записів були розв’язані вправа або задача. Основні поняття повинні бути чітко виділені. Тому дошка, як і конспект уроку у зошиті, розліновані вертикальною лінією, яка відділяє 1/3 листа паперу чи дошки. Ліва частина це план уроку, а права — його розшифрування. Наприклад, запис такої теми уроку, як «Явища фізичні та хімічні. Хімічна реакція. Ознаки хімічних реакцій та умови їх перебігу» має такий вигляд:
Явище
Фізичне
Хімічне
Хімічна реакція Схема
Ознаки
Умови виникнення і проходження реакції
Зміна у природі,
одна речовина не перетворюється в іншу Ак
— Ар Ар — Аг, ' одна речовина перетворюється в іншу А — В.
Хімічне явище.
Реагенти (вихідні речовини) — продути реакції:
1. Виділення тепла і світла;
2. Випадання 1 або розчинення І осаду;
3. Виділення газуватої речовини
4. Поява запаху
5. Зміна кольору
1) Стикання
2) Подрібнення
3) Нагрівання (при потребі) речовин
За таким записом дуже легко провести хімічний диктант. Діти записують лише цифру хімічного явища:
1. Горіння свічки;
2. Утворення туману:
3. Світіння нитки електричної лампочки;
4. Іржавіння заліза;
5. Перегонка води (дистиляція);
6. Плавлення свинцю;
7. Гниття деревини;
8. Протухання яєць;
9. Кування металу;
10. Бродіння виноградного соку.
Діти користуючись записом конспекту, співставляючи два поняття:
1) що таке хімічне явище;
2) ознака хімічної реакції, ставлять тільки цифри явищ: 1, 4, 7, 8, 10 можуть пояснити, а вірніше, повторити майже весь теоретичний матеріал уроку. Таке закріплення матеріалу дає можливість зекономити час на уроці і, практично вивчити теоретичний матеріал.
У записах з’являються перші скорочення — сигнали, якими часто користуються на уроках при записах теоретичного матеріалу але виключаються із записів при оформленні практичних, контрольних робіт.
Наприклад, при записі будови речовин використовуються такі сигнали:
Речовина має: ПКЗ, не ПКЗ, ІЗ (полярний, неполярний, йонний зв’язок), кристалізується у АКГ, МКГ, ІКГ (атомний, молекулярний, йонний) кристалічній гратці.
Фізичні властивості: Г (газувата), Р (рідина), К (кристалічна) речовина, Рно, Рно — розчинна чи нерозчинна У воді, t кип І І, t пл І І — температури кипіння, плавлення високі. І, низькі г, К — колір, 3 — запах, С — смаки їх відсутність;
,
Наприклад скорочений запис фізичних властивостей хлороводню такий: НС1 фізичні властивості: ПКЗ, МКГ, Г, К, 3 Рно (1:500) t кип.t і пл. І
Речовина має полярний ковалентний зв’язок, кристалізується у молекулярній кристалічній гратці, має низькі температури кипіння, плавлення, при звичайних умовах газувата, безбарвна, з різким запахом, добре розчинна у воді — в одному об’ємі води розчиняється 500 об’ємів хлороводню.
Коли вивчаємо зміну властивостей елементів у періодах, то скорочений запис такий: у періодах Z І, r атому І, п (е) І, Ме І, неМе І, Е І, В(0)І, ВнеМе (Н)І.
Це означає, що у періодах з ростом порядкових номерів радіус атомів збільшується, металічні властивості послаблюються, неметалічна посилюються, електронегативність збільшується, валентність за оксигеном зростає, валентність за гідрогеном для неметалів зменшується. Скорочений запис за допомогою символів допомагає учням зрозуміти в практичному використанні принцип Ле Шательє. Його зміст полягає в тому, що зовнішній вплив на систему, що перебуває в стані хімічної рівноваги, сприяє перебігу тієї реакції, яка послаблює цей вплив.
Вплив таких чинників, як температура, концентрація, а для газоподібних речовин— тиск, умовними сигналами позначається так:
+ Q(- н) - І t °С І - Q (+ Н)
екзотермічний процес ендотермічний процес
З підвищенням температури реагуючої суміші рівновага реакції зміщується в бік ендотермічного процесу, а з пониженням температури — в бік екзотермічного процесу.
Вплив тиску на зміщення рівноваги після визначення кількості газоподібних речовин в лівій і правій частині рівняння позначається так: mах ----I Р І -----mіn Пониження тиску зміщує рівновагу Підвищення тиску зміщує рівновагу хімічного процесу в бік більшої кілько- хімічного процесу в бік меншої кількоссті газоподібних речовин. ті газоподібних речовин.
Система сама підвищує тиск в проти- Система понижує тиск, протидіючи вагу нашій дії. нашому втручанню.
Сам процес створення таких конспектів з використанням сигналів не потребує значних зусиль, але економить час і приносить задоволення від чіткості форм та лаконічності матеріалу.
Як правило, учням подобається робота з такими конспектами. Такі конспекти дозволяють:
• Сконцентрувати значний об’єм теоретичного матеріалу в короткий запис;
• Систематизувати теоретичний матеріал у невеликі блоки;
• Активізувати слухову та зорову пам'ять учня;
• При малих затратах часу використовувати багаторазове повторення матеріалу;
• Створити систему перспективних цілей, що формують «комфортні» умови роботи та спілкування, бо учень не тільки здатний виконувати вказівки вчителя, відтворювати його діяльність а й самоорієнтуватись у завданнях.
Такий підхід розвиває дедуктивне мислення, активне читання, використання схем, самостійну постановку питань, висунення і розв’язання нових ідей.
«Комфортні» умови створює і приміщення, в якому працюють учитель і учні — кабінет хімії.
«
Для чіткої організації праці учнів та учителя на уроці кабінет хімії умебльований спеціальними одномісними столами. Основний довідковий матеріал знаходиться на планшетах. Це: розчинність основ, кислот, солей у воді, періодична система хімічних елементів Д. І. Менделєєва, ряд електронегативності хімічних елементів за Полінгом, відносні молекулярні маси органічних і неорганічних речовин, електрохімічний ряд напруг металів, номенклатура органічних і неорганічних речовин, формули розрахунків, схеми взаємозв’язку неорганічних речовин, інструкція з правил техніки безпеки.
Хімія — наука експериментальна. Хімічний експеримент — джерело знань про речовину і хімічні реакції — важлива умова активізації пізнавальної діяльності учнів, виховання стійкого інтересу до предмету, формування наукового світогляду, а також уяви про практичне застосування хімічних знань. Реалізація експериментальної частини програми вимагає не тільки високої і різнобічної професійної підготовки, але й доброї матеріальної бази кабінету. На даний момент кабінет хімії забезпечений всіма необхідними реактивами і приладами. Для забезпечення посудом і деякими реактивами задіяні учні і батьки.
Для економії реактивів і часу експеримент проводиться з малими кількостями речовин і на планшетках. Набори розчинів, реактивів приготовлені на кожен стіл, тому труднощів при проведенні лабораторних та практичних робіт фактично немає.
Кожен учень забезпечений такою літературою:
Завдання тестової перевірки знань
О. Г. Ярошенко, В. І. Новіцька, «Збірник задач і вправ з хімії».
Н. М. Буринська, «Практичні роботи з хімії».
Створена картотека контрольних, практичних, самостійних робіт з усіх тем курсу хімії з диференційованими текстами. Також створена картотека завдань для фронтального опитування, експериментальних та розрахункових задач, тексти для проведення заліків з тем: «Знаки хімічних елементів», «Валентність», «Розрахунки за хімічними формулами», «Розрахунки за хімічними формулами та рівняннями», «Кислоти. Солі».
Підібрані матеріали для проведення семінарських занять. Тексти контрольних та самостійних робіт індивідуальні для кожного учня з даної теми.
Це забезпечує мобільність вашого уроку. Ви не скуті рамками вашого плану.
При різних ускладненнях, несподіванках, користуючись таким набором роздаткового матеріалу, ви можете легко уникнути непорозумінь, конфліктів, забезпечити відповідний методичний рівень викладання. І учитель, і урок захищені від різних несподіванок, бо готові до плавної перебудови своєї роботи при зміні ситуації. Учень перестає любити предмет тоді, коли перестає його розуміти. Тому кожен урок починається з питання: Які ускладнення виникли? Що незрозумілого було у домашньому завданні? і тільки після з'ясування всіх проблем учитель має право перейти до опитування або до вивчення нового матеріалу.
На уроках учень виступає співучасником творчої роботи учителі. Тому основне завдання — захопити активною пошуковою діяльністю всіх учнів. При цьому важливим принципом є «процес оволодіння знаннями на уроці».
А це неможливо без:
1.Диференціації об'єму, степеня складності навчального матеріалу;
2. Диференціації характеру, об’єму і складності домашнього завдання;
3. Диференціація допомоги, що надається дітям. Тобто, іде мова про диференціацію навчання.
Для проведення диференціації навчання плануються і приводяться у певну систему уроки кожної теми. В систему входять:
1.Облік реальних можливостей учнів різного віку, класів, рівня їх вихованості і розвитку, рівня сформованості класного колективу (анкетування, спостереження).
2.Врахування інтересів, нахилів, потреб і запитів учнів (анкетування, бесіди, спостереження);
3.Цілеспрямована ліквідація прогалин у знаннях (консультації, групова робота, індивідуальні завдання);
4.Вибір раціональної структури і темпу проведення уроку (актуалізація знань, ліквідація прогалин у знаннях);
5.Виправдана комбінація загально класних форм роботи уроді з груповими та індивідуальними, організація праці як колективної діяльності (різноманітність способів роботи на уроці (не менше трьох видів робіт).
6.Удосконалення умов для лабораторних дослідів та практичних робіт (робота з малими кількостями реактивів, чітка індивідуалізація експерименту);
7.Чітка відповідність структури уроку і теоретичного матеріалу, готовність до необхідності перебудови уроку;
8.Облік результатів самоаналізу при плануванні наступних уроків (принцип наступності у викладанні, всі хімічні процеси, теорії, вчення вивчаються у взаємозв’язку не тільки хімічної науки, а й з іншими шкільними дисциплінами).
Для того, щоб зуміти диференційовано допомогти учням, потрібно досконало знати можливості кожного учня, тобто вивчити учнівський колектив.
Після бесіди з класним керівником ведеться спостереження за діяльністю учнів на уроках протягом всього навчання хімії. Постійне спілкування з учнями та анкетування наприкінці кожного навчального року дають той матеріал, який так необхідний для розуміння і вивчення як окремих учнів, так і учнівського колективу.
Перше анкетування проводиться в кінці ІІ семестру.
Анкета включає такі питання:
1. Твоє ставлення до хімії як навчального предмету?
2. Як ти сприймаєш матеріал?
3. Чи завжди розумієш навчальний матеріал на уроці?
4. Чи завжди зрозуміле домашнє завдання?
5. Скільки часу витрачається на виконання домашнього завдання?
6. Яка частина завдання найскладніша?
7. Чи є прогалини в знаннях, з якої теми?
8. Що не задовольняє тебе у викладанні хімії?
Особливо важливі думки учнів випускних класів. Після такої анкети у восьмих класах іде визначення мобільних груп за сприйняттям матеріалу.
I група — най здібніші (майбутні консультанти);
II група — старанні учні, які добре засвоюють матеріал тільки за рахунок своєї високої працездатності.
III група — чуні яким важко дається вивчення такої науки як хімія.
Результати, здобуті в ході аналіз анкет, на основі спостережень за учнями дають об’єктивну картину індивідуальних здібностей учнів яка навіть у паралельних класах може бути різною. Так після з’ясування того, що таке хімічна
(Г
реакція, ознаки хімічних реакцій можуть вивчатися по-різному. У класі, що характеризується високим інтелектом, частину дослідів пропонується виконати самостійно, зробивши записи:
1 ) Назва досліду;
2)Умови проведення; 3) Зовнішні зміни; 4) Висновок.
У класі з нижчим потенціальним рівнем учні ці ж висновки роблять за допомогою дослідів, що проводить учитель: нагрівання скляної трубки, горіння стрічки магнію, дія фенолфталеїну на луг... Але після теоретичних висновків, деякі досліди учні виконують самостійно.
Наприклад, взаємодія соди із кислотою, нагрівання води у пробірці і роблять висновки.
Диференційований підхід може бути застосований на якомусь етапі уроку. При вивчені небого матеріалу він дещо обмежується і включає: складання короткого конспекту-схеми в кінці кожного уроку, що дає можливість кожному учневі ще раз заглибитися у зміст вивченого матеріалу, охопити основні поняття у цілому, а потім деталізувати і конкретизувати їх. Так, наприклад, при вивчені теми «Насичені одно основні карбонові кислоти» в 10 класі, після вияснення їх електронної будови учням дається завдання.
1. (Сильній групі) Запропонувати набір реактивів для доведення того факту, що перші представники карбонових кислот — електроліти и при дисоціації відщеплюють катіони гідрогену Н—. Довести свої висновки експериментально.
2. (Основна група) Користуючись реактивами, що є на столі, довести експериментально, що карбонові кислоти виявляють типові властивості кислот. Установити причину подібності властивостей карбонових кислот, неорганічних кислот.
3. (Слабка група) Учитель, підкресливши, що оцтова кислота, як і неорганічні кислоти при дисоціації відщеплює іон Н+ має властивості, подібні до неорганічних кислот.
Разом з учнями виконуються досліди, записуються рівняння реакції, робляться висновки.
Дуже часто при закріпленні окремих питань пропонуються індивідуальні диференційовані завдання. Наприклад, при вивчені теми «Водень, фізичні та хімічні властивості. Добування водню».
Завдання 1. (для сильних учнів).
1. Складіть не менше двох рівнянь хімічних реакцій, внаслідок проходження яких виділяється водень. Вкажіть тип кожної хімічної реакції, назвіть вихідні речовини.
2. Намалюйте приклад, користуючись яким можна довести, що водень — відновник. Вкажіть речовини, якими ви користувались і які утворились внаслідок реакції.
Завдання 2. (основна група).
1. Якими методами ви будете добувати водень, маючи у своєму розпорядженні обладнання і реактиви, дані на малюнку.
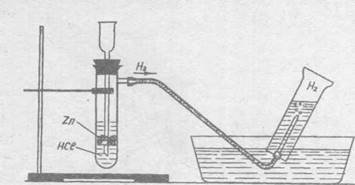
2. Як ви знайдете водень серед інших газів?
Завдання 3. (полегшене).
1. Закінчити рівняння хімічних реакцій, вказати тип реакцій в кожному окремому випадку
Zn + 2НСI ---- > ZnСІ + ?;
? + СІ ------ > 2НСI; Н + ? = Си + НО;
2. Як довести, що водень легший за повітря.
Додому, в більшості своїй, задаються три завдання: легке, середньої складності, і складне. Обов’язковим для виконання є перше і друге завдання, а за бажанням, складне, яке оцінюється вищим балом. Наприклад, при вивчені теми «Альдегіди» в курсі органічної хімії пропонувались наступні розрахункові задачі.
1. (легка) чому дорівнює маса а) 2 моль формальдегіду, б) 2 л. безводного масляного альдегіду, густина якого 0,8?
2.(середньої складності) який об’єм ацетилену (н.у.) необхідно використати для добування 45 т 98 %-ного ацетальдегіду за реакцією Кучерова?
3.(складне) який об’єм формальдегіду (н.у.) необхідно розчинити у воді, щоб добути 2 л 36 %-ного розчину формаліну, густина якого 1,11?
Додому завдаються завдання частково пошукового і творчого характеру.
Наприклад, після вивчення складу повітря учням було запропоновано на- малювати прилад, за допомогою якого можна довести, що кисень важчий за повітря.
Після вивчення теми «Поняття про розчин і розчинність» завдання такого напряму формуються так:
1.Як поставити дослід, щоб порівняти розчинність цукру і солі при даній температурі? Попробуйте розрахувати розчинність цих речовин у воді. 2.Намалюйте прилад для добування дистильованої води у домашніх умовах.
При вивчені теми «Масова частка розчиненої речовини», пропонуються такі завдання:
1.Розв’яжіть дану задачу і сформулюйте умову нової задачі, яка: а) аналогічна даній;
б) протилежна даній.
2.Складіть умову трьох задач із застосуванням поняття «Масова частка розчиненої речовини», використовуючи дані:
а) оцтом називають 9%-ний розчин оцтової кислоти;
б) в медицині використовують 5 %-ний розчин йоду у спирті;
в) в лимонному соці міститься 6,5 %-а лимонна кислота.
Можна навести приклад диференційованого теоретичного завдання, яке можна використати при фронтальній перевірці знань.
Тема: Альдегіди.
Теоретичне завдання
І (сильна група) із бутану добути масляний альдегід. Написати рівняння реакцій, використовуючи структурні формули. Вказати умови їх проходження і назвати добуті речовини.
ІІ (середня група) записати рівняння реакції слідуючих перетворень Метан – хлорметан – метанол - формальдегід.
Вказати умови проходження реакції.
III (слабша група) використовуючи структурні формули речовин, напишіть рівняння реакції СН – СНСІ – СНОН - СН-С Вказати назви речовин.
Правильне виконання будь-якого із завдання оцінюється вищим балом, хоч учні, які відповідали, відрізнялись рівнем своїх знань. Такий підхід до перевірки знань дає можливість змінювати завдання для кожного учня, дають йому шанс перейти в грубу більш сильних учнів, або, інколи, і навпаки.
Якщо учень виконував весь об’єм робіт по даній темі і при цьому ще й розв’язував ряд задач олімпіадного, типу то йому автоматично зараховувався залік з теми. Він може звільнятись від виконання контрольних завдань. У цей час за інструкцією він міг проводити лабораторні досліди, поступово ускладнюючи їх. Експериментальні завдання.
Варіант І. В пробірку налийте 0,5 мл етанолу. В полум’ї пальника розжарте мідну спіраль, до утворення чорного нальоту оксиду міді. Швидко опустіть розжарену спіраль у спирт: За допомогою хімічної реакції поясніть появу запаху альдегіду. Напишіть рівняння реакції.
Варіант II. В пробірку налийте 0,5 мл дуже розведеного розчину мідного купоросу і добавте 2 —3 розчину їдкого натру. До осаду, що утворився при цьому, долийте 2 — 3 мл формаліну і суміш нагрійте. Спостерігайте зміну кольору осаду.
Напишіть рівняння хімічних реакцій.
Варіант III. В колбу, або пробірку налийте 0,5 мл 2 % розчину нітрату аргенту му. Потім поступово добавляйте розчин аміаку до тих пір, поки не розчиниться осад. До розчину, що утворився, додайте по краплинах 0,5 мл формаліну і опустіть пробірку в склянку з гарячою водою. Спостерігайте утворення «срібного дзеркала». Напишіть рівняння хімічних реакцій.
Учні завжди захоплюються експериментальною частиною уроку. Демонстрації або лабораторні роботи можна проводити по-різному. Тут існують різні прийоми. Цікавий прийом прогнозування на уроках хімії. Прогнозування ходу подій і на основі цього регулювання розумової діяльності є однією із функцій психіки. Людині легше пояснити подію, ніж передбачити. Очевидно, тренуючи учнів у застосуванні прийому прогнозування, ми не тільки розвиваємо інтерес до вивчення хімії, але й здібності прогнозувати. Перед початком дослідів на уроках хімії ставляться такі запитання: Як ви думаєте, що будемо спостерігати, якщо:
а)злити розчини цих речовин;
б) підігріти реагенти;
в) добавити каталізатор?
За якими ознаками можна прослідкувати за перебігом реакції? Як можна перевірити ваші передбачення?
І хай учні «пофантазують» 1 — 1,5 хвилини. Ці хвилини оправдовуються їх особливою увагою до досліду і його результату, гострим інтересом, якщо результати досліду співпадають з прогнозом учнів.
Діти ведуть себе по-різному на уроках, коли:
• Учитель сам пояснює хід реакції, уточнюючи, за якими особливостями потрібно спостерігати;
• Учням пропонується провести «уявний» експеримент, спрогнозувати результати досліду, висловити свої передбачення, а потім, спостерігаючи дослід, перевірити їх.
Перевага другого методу ведення експерименту:
1.Має місце активна розумова діяльність;
2.Поглиблюється розуміння нового матеріалу; 3.Зростає впевненість у своїх силах і знаннях;
4.Виникають нові ідеї і відкриття.
Прикладом розкриття цієї психолого-дидактичної закономірності може бути вивчення теми «Реакції іонного обміну».
Що ви можете спостерігати у випадках зливання розчинів:
а) Сульфатної кислоти і хлориду калію;
б) Сульфатної кислоти і хлориду барію?
Учні установлюють, що обидві реакції є реакціями обміну, пропонують запис рівнянь реакції, характеризують розчинність речовин — продуктів можливої реакції.
Установлюють факти:
1. Розчинність двох речовин, утворених у результаті першої реакції; 2. Нерозчинність сульфату барію другої реакції.
Учні експериментально перевіряють свої припущення. Зразу ж дається завдання: як зміниться інтенсивність світіння електричної лампочки, коли електроди упущені у розчин гідроксиду барію, коли у банку з цим розчином добавляти по краплині розчину сульфатної кислоти.
Після процесу прогнозування робиться висновок про зв’язування іонів у дві малодисоціюючі речовини: нерозчинну сульфат барію, малодисоціюючі воду.
Робиться два перших висновки щодо проходження реакцій обміну до кінця. Записуються приклади рівнянь хімічних реакцій, прогноз ознак хімічних реакцій.
На оцінку «12» даються завдання: як зміниться колір лакмусу, якщо до кислоти приливати луг. або навпаки, до лугу приливати кислоту?
Чи зміниться інтенсивність світіння електричної лампочки, якщо до розчину хлориду калію доливати по краплинах розчин нітрату аргентуму?
У всіх випадках ставиться запитання: а що змінюватиметься у процесі доливання надлишків реактивів?
Усі варіанти відповідей розглядають, вибирається логічно вірний і перевіряється експериментально. При вивченні теми «Глюкоза» в 10-му класу ставиться одне із перших завдань — вияснити будову молекули глюкози, експериментально довівши наявність у ній відповідних функціональних груп.
У процесі бесіди з’ясовуються можливі функціональні групи глюкози: карбоксильна, гідроксогрупа, карбонільна. І всі ці припущення перевіряються дослідним шляхом. Відсутність карбоксильної групи доводиться дією на розчин глюкози лакмусу чи магнію. Поява яскраво-синього забарвлення при дії гідроксиду купруму підтверджує наявність декількох гідроксогруп. Присутність альдегідної групи доводиться появою червоного осаду при нагріванні останнього розчину. Таким чином, учні ж доводять, що глюкоза — альдегідоспирт. Всі останні уточнення будови глюкози дає учитель. Навчання учнів прийомам прогнозування дає можливість формувати в ній інтерес до предмета, розвитку інтелектуальних можливостей і пізнавальної активності.
Ефективність диференційованого підходу підтверджується результатами контрольних зрізів, при чому потрібно враховувати, що моментально результату одержати не можна. Моментальне покращення або одинокий результат може бути випадковим або незалежним від учителя і методу.
Але при співставленні результатів навчання експериментальних і контрольних класів спостерігається тенденція безперервного покращення знань. Цей процес спостерігається і при аналізі успішності учнів у семестрах.
Диференційований підхід відповідає реальним можливостям основної частини вчителів, матеріальної бази школи, кабінету.
Досвід роботи показує, що слабо встигаючих учнів потрібно опитувати частіше, ніж інших. Завжди перевіряти виконання домашніх завдань. При вивченні нового матеріалу залучати до різних видів посильної навчальної діяльності і цим підтримувати їх увагу, активно заохочувати перші успіхи. Під час самостійного засвоєння навчального матеріалу виробляти в них навчальні вміння та навички. Для цього потрібно проводити докладний інструктаж перед роботою, яку передбачається виконати (алгоритм виконання, попередити про ймовірні помилки, неправильні підходи тощо). Таким учням пропонуються підготовчі вправи з поступовим ускладненням. Більш складні вправи діляться на кілька елементарних. При їх усній відповіді вимагається пояснення, коментування ходу виконання завдання. Але особливу увагу слід звернути на своєчасну допомогу.
Найкраще підготовлені учні також вимагають посиленої уваги. Для таких школярів добираються завдання підвищеної складності, пропонується розв'язання задач кількома способами з вибором найраціональнішого. Для них пропонуються спеціальні творчі завдання, їх залучаюсь до проведення консультацій, до участі в конкурсах. олімпіадах. Але при цьому необхідно уникати перевантаження, тобто учитель повинен контролювати оптимальність домашнього навального навантаження, попереджуючи можливу перевтому. Тому основне в диференціації навчання — це диференціація міри вчительської допомоги учневі без суттєвого зниження складності завдань. Ця робота підлягає виконання головної вимоги сучасної методики. Учень навчається — вчитель допомагає йому у цьому.
Диференційований підхід у навчальному процесі:
1. Означає діючу увагу до кожного учня, його творчої індивідуальності в умовах класно-поурочної системи навчання за загальнообов’язковими навчальними програмами;
2. Пропонує розумне співіснування фронтальних, групових та індивідуальних занять для підвищення якості навчання і розвитку кожного школяра;
3. Дає можливість вибирати і застосовувати найбільш ефективні засоби індивідуального підходу;
4. Фіксувати і аналізувати результати;
5. Відіграє значну роль в індивідуальному впливі на учня через представників
учнівського колективу шляхом не тільки взаємодії, але й взаємоконтролю.
Взаємоконтроль — це особливо складна грань відношень у трикутнику
учитель клас
учень
Найчастіша причина конфлікту — завищення результатів своєї праці і нехтування рівнем складності відповіді товариша. Тут мова іде про те, що відповідь учня полинна бути обов’язково прокоментована в першу чергу учителем і, по можливості учнями. Тому що учень повинен завжди бути зорієнтованим в тому, які знання, якої складності і об’єму повинні бути придбанні. У вирішенні цієї проблеми велику допомогу надає організація групової роботи класів.
Перший етап організації групової роботи в класі починається з першого заліку в курсі хімії — знаки хімічних елементів — основи хімічної мови.
Для учні готуються індивідуальні картки заліку
|
Назва елементу |
Хімічний знак |
Вимова |
|
Хлор |
— |
— |
|
— |
Mg |
—— |
|
— Натрій |
—— |
Купрум— |
|
— |
Zn |
— |
|
— |
— |
Алюміній |
Така картка включає 23 елементи, які найбільш часто використовують у шкільному курсі хімії. З учнів, які першими здали залік, формують групу консультантів. Вони відповідають за здачу заліку іншими учнями. Клас розділяється на групи. До складу групи входять від трьох до п'яти учнів. Консультанти ведуть перевірку знань учнів. Під їх контролем учні знаходяться доти, поки не здадуть залік.
Такі групи залишаються при здачі заліків: «Розрахунки за хімічними формулами», «Валентність», «Складання рівнянь хімічних реакцій», «Розрахунки за хімічними рівняннями».
Така групова робота дає можливість контролювати знання кожного учня, ліквідувати прогалини в знаннях.
Окремим видом заліку, який служить передумовою уроків-семінарів у старших класах, є проведення «Ланцюжка».
«Ланцюжок» проводиться в кінці теми, яка пересичена новими термінами і поняттями.
Тема «Початкові хімічні поняття». Тема «Хімічні реакції».
Тема «Періодичний закон, періодична система хімічних елементів Д. І. Менделєєва. Будова атома».
Тема «Розчини».
У десятому класі — це тема «Органічні сполуки». Двом учням класу дається завдання: виписати всі наукові поняття і терміни даної теми. Завдання перевіряється, уточнюється і доповнюється учителем. Перелік питань доводиться до відома учнів. Підготовка до такого заліку триває не менше тижня. Залік починає учитель з будь-якого учня класу і ланцюжком проходить через весь клас: питання учителя —
— відповідь учня 1, питання учня1 ------ відповідь учня 2, питання учня 2 -------- і т. д.
Питання не повторюються, відповіді можуть уточнюватися іншими учнями. Не знання відповіді на запитання, або невміння сформувати запитання приводить до виключення учня з ланцюжка. Але учень має шанс поправити своє становище, коли йде менший ланцюг по колу тих учнів, які вийшли з нього на першому етапі. І ще раз виправити становище можна при безпосередній бесіді учителя і учня. Облік ведеться так:
Прізвище учня Запитання Відповідь Уточнення Додаткове запитання
1 бал 2 бали 1 — 2 бали 1 бал
![]()
Ланцюжок шанс
Бали « 10-12» 6 балів
Бали «7-9» 4 бали
Бали «4-6» 2,5 бали
За невміння формувати запитання, незнання відповіді на запитання вводять штрафні санкції — знімаються від 0,5 до 2 б а л і в з а кількістю балів виставляється оцінка. Поряд може виставлятись коригуюча оцінка, але після персональної бесіди з учителем по даній темі.
Перелік запитань такого заліку з теми «Періодичний закон, періодична система хімічних елементів Д. І. Менделєєва. Будова атома» приблизно такий:
1.Відкриття періодичного закону.
2.Яку властивість хімічного елемента і чому покладено в основу класифікації Д. І. Менделєєвим і на сучасному рівні.
3.Сучасне формулювання періодичного закону.
4.Періодична система — це...
5.Період (малий, великий, фізична суть, зміна властивостей).
6.Група, підгрупа, фізична суть, зміна властивостей.
7.Порядковий номер (фізична суть).
8.Електрони, протони, нейтрони.
9.Хімічний елемент.
10.Нуклід, нуклони, ізотопи, масове число, нейтронне число, ядро, склад ядра.
11.Радіоактивність, період напіврозпаду, ядерні реакції, сили.
12.Орбіталь, електронна хмара, енергетичний рівень, підрівень, спін, види орбіталей.
13.Металічність, неметалічність.
14.Електронегативність (залежність від радіуса атома, кількості електронів зовнішнього рівня в періоді, групі).
15.Природні групи хімічних елементів (причина подібності хімічних властивостей).
16.Суть періодичності.
17.Значення періодичного закону.
При проведенні такої перевірки якості знань складаються умови не тільки для застосування набутих знань у нестандартних умовах, а й для виявлення їх повноти, глибини, систематичності й системності, гнучкості, міцності, свідомості, дієздатності.
Залік з хімії, особливо у старших класах має велике значення для розвитку виховних і розвиваючих завдань навчання. Наступний етап — це семінар-залік який проводять у кінці вивчення значного розділу навчального курсу, або навіть цілого курсу. На семінарі-заліку перевірка глибини, міцності і дієвості знань учнів переплітається з індивідуальним підходом до них з метою вияснення підготовленості кожного з них до випускних екзаменів. Перевіряється не тільки повнота і систематичність знань, але й уміння застосовувати теоретичні знання для аналізу явищ і хімічних процесів, порівнювати властивості речовин на основі їх хімічної будови, виконувати хімічний експеримент, розв'язувати розрахункові та якісні задачі. Різноманітність запропонованих завдань повинна забезпечити перевірку гнучкості знань учнів. В той же час мета учителя на такому уроці — оцінити роботу кожного учня за допомогою усного, письмового, практичного контролю. Підготовка до семінару- заліку орієнтує учнів на екзаменаційні умови. Учитель сам формулює питання з теми, добирає задачі, завдання для практичного виконання, літературу для учнів. Вибираються питання, що важко засвоюються учнями. Ось приклади двох семінарських занять: «Неметали» та
«Високомолекулярні сполуки» з курсу хімії.
УЗАГАЛЬНЕНЕ СЕМІНАРСЬКЕ ЗАНЯТТЯ З ТЕМИ:
«НЕМЕТАЛИ»
При підготовці до семінарського заняття учням даються такі запитання:
1.Які характерні ознаки неметалів?
2.Що характерного в будові атомів неметалів?
3.Положення неметалів у періодичній системі.
4.Характеристика фізичних властивостей неметалів.
5.Хімічні властивості неметалів.
6.Фізичний стан водневих сполук неметалів.
7.Від чого залежить характер розчину водневої сполуки неметалу?
8.Оксиди неметалів, їх класифікація.
9.Характеристика спільних властивостей кислот.
10.Чому кислоти мають відмінні властивості?
П Л А Н
П Р О В Е Д Е Н Н Я С Е М І Н А Р У
В с т у п н е с л о в о в ч и т е л я .
Ми з вами закінчили вивчення групи елементів, яка має надзвичайно важливе значення житті рослинного і тваринного світу — групи неметалів, (діаграма поширеності хімічних елементів у природі). Ми дихаємо оксигеном, обов'язковою складовою частиною органічних речовин є карбон, гідроген, до складу білків входить нітроген. Тому до вас перше запитання:
|
Запитання |
Відповіді |
|
Які характерні ознаки не металів? |
1. Всі неметали крім гідрогену і гелію Р — елементи; 2. Мають високе значення електронегативності (2-4); 3. Їх вищі оксиди — кислотні; 4. Водневі сполуки легкі; 5. Між собою утворюють ковалентні зв'язки. |
|
|
Що характерного в будові атомів неметалів? |
Крім гідрогену і гелію атоми мають три і більше електронів на зовнішньому рівні при незначному радіусі атома. |
|
|
Положення неметалів у періодичній системі елементів |
|
1 період і елементи головних підгруп вище діагоналі Бор-астат |
|
Письмове завдання: |
|
Будова атомів неметалів з порядковими номерами. |
|
Характеристика фізичних властивостей |
|
Бор, карбон, силіцій, германій, арсен мають атомну кристалічну гратку — тверді речовини із значними температурами плавлення, всі інші неметали мають молекулярну гратку, тому характеризуються низькою температурою плавлення, фізичний стан: рідкий, твердий і газоподібний. |
|
Хімічні властивості неметалів. Які протилежні властивості об’єднанні неметалі? |
у |
Окисник, відновник. |
|
Від чого залежні ці властивості?
|
|
Від електронегативності елементів (радіус атома, кількість електронів зовнішнього рівня) |
|
Письмове завдання |
Закінчити подані схеми реакцій, вказати: окисником чи відновником служить в хімічній |
|
|
|
реакції підкреслений елемент. Наприклад: N + О —> 2NO |
|
|
Як і чому змінюється електронегатизність елементів: 1.В. періодах.
2.В групах?
|
|
1. В періодах з ростом порядкових номерів радіус атома зменшується, кількість електронів зовнішнього рівня збільшується, електронегативність посилюється. Z І r атому І п (е) І неМе І 2.З ростом порядкових номерів радіус атома збільшується, кількість електронів зовнішнього рівня стала — електронегативність послаблюється: Z І r атому І п (е) — const неМе І
|
|
Письмове завдання: |
|
Розташувати елементи в порядку зростання електронегативності 1. Флуор, 2. Сульфур, 3. Нітроген, 4. Оксиген.
|
|
Які важливі групи сполук неметалів вивчаємо? |
ми |
Водневі і кисневі сполуки. |
|
Який фізичний стан водневих сполук не металів? Чому? |
Водневі сполуки неметалів утворені за допомогою ковалентного зв'язку, кристалізується в молекулярні кристалічні гратки, тому мають низькі температури кипіння і плавлення. За винятком води, всі водневі сполуки неметалів - гази.
|
|
|
Чому температура кипіння води більша за |
Наявність в молекулах води і аміаку водневого |
|
|
температуру кипіння сірководню? |
зв’язку. |
|
Чому розчинність у воді аміаку вища ніж в фосфіку.
|
Наявність в молекулах води і аміаку водневого зв’язку.
|
|
Хімічні властивості водневих сполук неметалів |
1. Відновники. Чому? 2. Розчиняючись у воді, проявляють основно-кислотні властивості крім сполук елементів IV групи
|
|
Від чого залежить характер розчину водневої сполуки неметалу?
|
Від радіусу атома і його ступеня окиснення. |
|
Письмове завдання: |
Пояснити зміну кислотно-основних властивостей водневих сполук неметалів в ряду. Наприклад: СН; NН; НО; НF Метан, аміак, вода, фтороводень.
|
|
Які речовини ми називаємо оксидами? Дати класифікацію оксидам неметалів. |
Солетвірні і несолетвірні. |
|
Письмове завдання. |
Дано кислотні оксиди. Розмістити їх у порядку зростання кислотних властивостей, записати відповідні формули кислот. Наприклад: SО; СIO; РО Оксиди сульфуру (VI), оксид хлору (VII), оксид фосфору (V). |
|
Дати характеристику спільним властивостям кислот. Чому кислоти мають спільну властивість? |
Наявність катіонів в гідрогену Н+
|
|
Чому кислоти мають відмінну властивість? |
Тому, що відрізняються своїми кислотними залишками. |
|
Експериментальне завдання. |
|
|
|
|
|
Наприклад: визначити, в якій з виданих вам пробірок знаходиться сульфатна нітратна, хлоридна кислоти? |
|
ВаСІ2 |
AgNO3 |
Висновок |
|
H2SO4 |
І |
|
NX |
|
|
HNO3 |
— |
— |
NY |
|
|
HCI |
— |
I |
NZ |
|
|
|
|
|
|
Для кожного учня готується картка з переліком його письмових завдань. Оцінки виставляються за письмові і усні відповіді, ставиться підсумкова оцінка.
До проведення заліків учні готуються уже із перших уроків вивчення даної теми, коли вчитель повідомляє їм перелік теоретичних питань і дає зразки практичних завдань, які будуть пропонуватися на заліку.
Після кожного уроку з даної теми учитель звертає увагу учнів на те, які теоретичні питання вже вивчені, і зазначає, новачками розв'язання яких вправ учні вже повинні володіти.
Як відбувається цей процес, можна переконатися проводячи підготовці самостійні роботи. Оцінки за ці роботи записуються до класного журналу лише за згодою учнів. Незадовільні оцінки є лише сигналом про недостатнє засвоєння теоретичного матеріалу і відсутність практичних умінь і навичок.
Готуючись до заліку учитель проводить велику попередню роботу: добирає задачі, вправи, пише картки.
Найчастіше проводяться заліки, на яких ґрунтовно перевіряється і теоретичні знання і практичні вміння учнів.
Семінар. “ВИСОКОМОЛЕКУЛЯРНІ СПОЛУКИ”
МЕТА: узагальнити матеріал з теми про ВМС, показати успіх науки і техніки в цій галузі і розкрити зв’язок теорії і практики, вказати шляхи створення матеріалів з раніш заданими властивостями.
Тому, ню відрізняються своїми кислотними залишками.
ПИТАННЯ СЕМІНАРУ
1. Що таке ВМС, як вони поділяються за своїм походження: (природні і синтетичні) і своїм складом (карбо- і гетероланцюгові)?
2. Вказати, за допомогою яких хімічних реакцій добувають ВМС?
3. Як потрібно розуміти словосполучення, реакції полімеризації (ускладнення будови речовин, перехід кількісних змін у якісні)?
4) Складіть схему полімеризації і пропілену, стиролу вінілхлориду (учні працюють по варіантах).
5) Що означає п в правій частині схеми? Які характеристики ВМС можна вияснити можна пояснити? (М, п, число структурних ланок).
6) Що таке мономер? Які до нього вимоги як до хімічної речовини і з економічної точки зору? (хімактивність, доступність, економічна вигода).
7) Що таке реакція поліконденсації? Покажіть це на прикладі реакції поліконденсації. — амінокапронової — аміновалеріанової, — — аміномас- ляної кислот? (учні працюють по варіантах).
8) Які вимоги до речовин, що вступають в реакцію поліконденсації? (вихідні речовини мають не менше двох функціональних груп, що можуть взаємодіяти між собою).
9) Яку групу ВМС добувають реакції поліконденсації? Як можна класифікувати?
(поліамідні, поліефірні волокна).
10) Яку геометричну структуру можуть мати макромолекули? (лінійну, розгалужену, просторову).
11) Класифікуйте відомі вам природні і синтетичні полімери по їх геометричній структурі. Крохмаль, целюлоза поліетилен (високого і низького тиску), поліпропілен, ацетатне волокно, нк, гума, фенолформальдегідні смоли ф-ф пластмаси, полістирол (письмове завдання у вигляді диктанту)
12.Що таке пластмаси? На які групи вони поділяються (термореактивні, термопластичні).
13.Які основні властивості полімерів? (склад, Мг, геометрична структура, ступінь кристалічності).
14.Які основні властивості пластмаси?
15.Як повинні відрізнятись за хімічними властивостями полімери: (-СF -СF) н; (СН—СН—СН); (-СН -СН = СН -СН-)
16.Як можна забезпечити більшу міцність синтетичного волокна?
1 7. Чому міцність волокна капрон вища міцності волокна лавсан?
18. Якими властивостями і чому СК поступається НК?
*
19. Що таке гуттаперча?
20. Чому в промисловості та в н/г використовують так багато марок СК?
21. Які основні шляхи покращення фізико-механічних властивостей полімерів?
22. Що таке композити? їх властивості і застосування.
По закінченню семінару учні перевіряють свої виконані завдання під кодоскоп
(виконують завдання під копіювальний папір — 1 зразок у вчителя, а другий — в учня.
Якщо семінар-залік обов’язковий для всіх учнів, то від участі у ланцюжку учні можуть бути звільненими. Учні звільняються у тому випадку, коли у них високий рівень теоретичних знань, виконані додаткові завдання. Наприклад, ланцюжку з теми «Періодичний закон, періодична система хімічних елементів Д. І. Менделєєва. Будова атома» передують такі завдання:
1. Знайти в кожному ряду один хімічний елемент, який відрізняється від інших положенням в періодичній системі (це завдання вносить назву “четвертий зайвий”, або “біла ворона”).
а) Н, Не, Nе, Аг;
б) Fе,Со, Ni, Аг;
в) Н, Lі, Ве, Ві;
г) F, СІ, Мn, Вг.
2. Гра в “хрестики і нулики” виграшний шлях складає:
а) елементи одно періоду або однієї підгрупи
|
Be |
N |
Si |
|
Al |
Na |
C |
|
CI |
Mg |
Ge |
б) елементи однієї головної підгрупи або одного періоду
|
Zn |
Cl |
A1 |
|
Be |
Mg |
Ca |
|
Si |
s |
Na |
в) елементи, що розташовані поряд або одного періоду
|
Mg |
Ar |
Fe |
|
Na |
К |
N |
|
Cl |
Ca |
O |
*
НА «10-12» балів
3. Порядкові номери хімічних елементів А, В, С відповідно п, п + 2, п + 4 або Z, Z +
2. Z + 4.
1. Якщо хімічний елемент А — найлегший галоген, то яким елементом буде В?
2. Якщо С — благородний газ, В — неметал, то А— ?
3. Чи можуть А, В, С, бути у вигляді простих речовин газами?
4. Якщо хімічні елементи А, В входять в одну і ту ж групу, то яким хімічним елементом є С?
5. А, В, С, — прості речовини, гази. Сполуки, що утворюють А та В, або А та С, три кімнатній температурі є рідини і мають формули АВ та АС. Які прості речовини позначені буквами А, В, С? Напишіть рівняння відповідних реакцій.
6. При взаємодії 19,5 г двовалентного металу з азотом утворилось 22,3 г нітриду. _Назвіть метал. .в
7. При згорянні 6,4 г елемента утворилось 12,8 г оксиду складу RО. Визначте елемент.
8. Скласти кросворд, використовуючи знання теми. Ось один із кросвордів складених учнями.
Кросворд “Періодична система. Будова атома”.
Ключове слово — властивість атому хімічного елементу, що має найбільше значення у фтора.

1. Процес приєднання електронів.
2. Номер групи вказує на кількість електронів.
3. Процес втрати електронів.
4. Елемент, що приєднує електрони.
5. Хімічно неподільна частинка.
6. Тип кристалічної гратки.
7. Заряджена частинка.
8. Елемент, що віддає електрони.
9. Негативно заряджена елементарна частинка.
10.Фізичний стан речовини.
11.Зв’язок, утворений атомами неметалів.
12.Заряджена елементарна частинка.
13.Фізичний стан речовини.
14.Найбільш поширена речовина на землі.
15.Вид хімічного зв’язку.
16.Кристалічна гратка кухонної солі.
17.Радіоактивний елемент.
18.Кристалічна гратка піску..
19.Тугоплавкий метал.
Урок повинен виховувати пізнавальний інтерес школярів. Інтерес штовхає до пізнання істини. Знання, здобуті з інтересом, стануть у майбутньому не мертвим вантажем, а активним надбанням дорослої людини.
Сучасна педагогічна наука вважає, що інтерес характеризується складним поєднанням інтелектуальних, емоційних і вольових процесів, їх взаємопроникненням і взаємовпливом.
Інтерес позитивно впливає на всі психічні процеси і функції. Тісний його зв’язок з увагою, пам’яттю, працездатністю учня.
«Вимучене», з почуттям обов’язку, навчання не наповнене інтересом, перешкоджає становленню особистості людини, утруднює її вихід у самостійне життя. Таким чином, питання про розвиток пізнавального інтересу — це одночасно питання про виховання особистості людини, її духовного світу. Один з найсильніших і вірних шляхів збудження інтересу —- емоційний вплив на свідомість учнів при викладанні хімії. Звичайно, найбільші можливості у художньої літератури.
Направо о вещах те думают, Шувалов,
Которые стекло чтут ниже минералов,Приманчивым лучом, блистающим в глаза:
Не меньше пользы в нем, не меньше в нем краса.*
... Пою перед тобой в восторге похвалу
Не камням дорогим, не злату, но стеклу.
М. Ломоносов.
А якщо до цього ви розкажете легенду про історію виникнення скла, розкриєте колекцію його видів, доповните фотографіями художніх виробів із цієї речовини, то на цьому фоні формула скла запам’ятається. Тому що такий контраст між прозаїчністю сировини: пісок, сода, вапняк і творчим польотом людського таланту.
А якщо на цьому ж уроці ви розповісте про історію створення фарфору в Китаї, Німеччині, Росії з усіма парадоксами, трагедіями наукових відкриттів і людського життя, то цей урок залишитеся в пам’яті учнів.
А на винаході, що зробив у будівельній справі всієї планети — винаході залізобетону простим паризьким квітникарем — ви ще раз підкреслите, що кожен із нас творець, що в кожній людині закладений потяг до творчості, але основні чинники цього — наш інтелект і важка праця — залежать тільки від нас.
Цю тему ви продовжите при вивченні біографії Д. І. Менделєєва, М. М. Зініна,
А. Нобеля, Шухова, О. М. Бутлерова. Тоді урок залишиться не одиноким емоційним спалахом, а тихим, стабільним полум’ям, що зігріє розуміння необхідності, доцільності навчальної діяльності.
А при вивченні такої прозаїчної і знайомої теми «Повітря та його склад. Охорона атмосферного повітря від забруднень», ми можемо використати як стартовий майданчик вислів Гальрозе: «Шар речовини, що створює тиск всього в 1 кг/см кв. — ось те середовище, в якому ми живемо і працюємо, яке проводить звуки до нашого вуха, пропускає світло Сонця. Десять міліграмів вуглекислого газу із кожного кілограма цієї речовини, взаємодіючи із сонячним світлом, безперервно підтримує життя на землі, 300 мікрограмів озону захищають це життя від згубної дії ультрафіолету, мільйонна частка мікрограму електронів надає можливості звертатись по радіо Це середовище, яке дає можливість літати одне до одного, яким ми дихаємо, нарешті, воно також живе, живе фізично. Це не тільки бурхливий повітряний океан, але й газовий хімічний реактор».
V цьому вислові не тільки вся хімічна і фізична суть нашої теми уроку. Виходячи :'з нього, ми маємо можливість відійти від монотонної діяльності на уроці, тобто від шаблонних форм і методів навчання.
Цьому допомагає і поезія. Ми не можемо не використати на уроці вірш С. Шчи- пачова «Читая Менделеева», або О. Глазкова:
«Пусть зимний день с метелями
Не навивает грустъ —
Таблицу Менделеева Я знаю наизусть...»
А вивчаючи тему «Коксохімічне виробництво», ми обов'язково використаємо «Монолог вугілля» Л. Шелудько:*
«Наверх! И в самой высшей точке,
Волнуясь, радуясь, спеша,
Из чёрной выйдет оболочки Моя горячая душа.
В котлах, кострах электростанций Себя я людям подарю.
Я Солнце пил. Я Солнцем стану.
На миг — но Солнце!
И сгорю.
Так лучшие из вас кончают,
Победой свой последний бой,
И даже смертью отвергают Всесилье смерти над собой...»
Скільки виховних, наукових моментів можна взяти із цих слів. Як можна відшліфувати найнеочікуванішими поворотами свій урок? Це все серйозно, але можна і жартома.
Наприклад, про відкриття кисню:
«То история простая...
Джозеф Пристіли как-то раз
Оксид ртути нагревая, Обнаружил странный газ Газ без цвета, без названья, Ярче в нем горит свеча. А не вреден для дыханья И для мыши, и для нас?... ... Кошка греется на крыше, Солнца луч окошко бет.
Джозеф Пристли с ним две мыши
Открывают кислород»
Як можна, вивчаючи воду, не використати вірші про могутність і зачаровуючу красу води?
«Туман лежит на кручах
Недвижен и глубок,
Где оседает туча,
Рождается поток"
Ц. ДАМДИСУРЕН.
Діти полюбляють детективи, страшні історії, якими багата тема «Фосфор і його сполуки».
Хімія — наука, яка має гли* бокий історичний корінь. А «ІСТОРІЯ — учитель життя» — цей древній латинський вислів допомагає нам глибше оцінити розвиток хімічної науки як важливого елемента сучасної культури. Історія може іронізувати. Ось, наприклад. Трохи більше віку тому відвідувачі всесвітньої виставки в Парижі серед коштовностей із зацікавленням розглядали «срібло із глини» — так називали тоді алюміній. Кілограм цього металу коштував 1200 карбованців золотом. Модниці вилого світу шикували в прикрасах з алюмінію. «Немає нічого важчого — зітхав перший алюмінієвий промисловець Анрі Девіль, — як примусити людей застосовувати новий метал».
Звичайно, ці перші кроки алюмінію не можуть не викликати посмішку. А тут ще й можна додати, що за видатні успіхи у розвитку хімічної науки Д.І. Менделєєва нагороджено статуеткою із алюмінію. Ґудзики мундира Його Величності були алюмінієвими і, як ознака вишуканості, вся його сім'я їла з алюмінієвого посуду та ще й алюмінієвими ложками.
Історія нам допомагає такий строго дозований матеріал як «Значення періодичного закону» подати натхненно і цікаво. Ми починаємо урок із слів
О. М. Писаржевського: «Он (Менделеев) страстно не хотел чувствовать себя недолгим гостем на прекрасной земле, лишь по недоразумению нищий, по недоразумению несчастный. Он готов был вмешиваться во все ее беды». А людині, яка служить народу, яка йде попереду, доводиться долати безліч перешкод. Після цього демонструється важкий шлях становлення періодичного закону.
Швецький хімік Нільсон — головний противник періодичного закону — висловлював свою думку так: «Наша думка заперечує так званий періодичний закон, який пан Менделєєв накреслив для всіх елементів».
Через 6 років по тому: «Ми повинні відмовитися від раніше висловленої нами думки... Ми визнаємо вірність періодичного закону і в цьому важливому випадку».
Чому так відбулося? Адже людині дуже важко привселюдно визнати свою помилку? А людині — вченому із світовим ім’ям? А історія з відкриттям галію Леноком де Буабораном? Це не може не хвилювати. Це не може не цікавити. Очі дітей світяться вогником зацікавленості, навіть азарту. Та вже в десятому класі при вивчені теорії хімічної будови О.М. Бутлерова до всіх історичних фактів ви додаєте одне читання: «Чому відкриття цих двох великих теорій, законів відбулося саме у 70-х роках XIX століття? Чому в Росії».
Висновок: вплив революційного руху не тільки на розвиток суспільних відносин, але й на розвиток науки, літератури, мистецтва...
А тепер це все пов’яжемо із сьогоденням. Скільки виховних моментів при такій начебто неблагодатній темі «Значення теорії чи закону»!
Хімія — наука, яка має практичне спрямування. Теорія — це щось недосяжне для учнів. Але коли показуємо, що ці фізичні, хімічні властивості речовин, що вивчаються нами, використовуються, то ми не тільки наближаємо хімію, як науку, до дитини, але й показуємо необхідність її вивчення. І тоді не прозвучить на уроках фраза «А навіщо це потрібно?». Розуміння необхідності, доцільності навчальної діяль* ності робить науку в очах дитини важливою і захоплюючою. В кабінеті хімії підібрані матеріали по практичному застосуванні багатьох речовин на основі їх властивостей. Це кислоти, нашатирний спирт, гліцерин, цукор, перманганат калію, питна сода, діетиловий етер...
Ось приклади застосування трьох речовин: питної соди, кухонної солі, медичного ефіру.
ПИТНА СОДА NaНСО3
Зовнішній вигляд — біла дрібнокристалічна речовина.
Розчинність у воді — при звичайній температурі погана, при нагріванні — добра.
Має лужне середовище. Використовується для погашення кислотності (нейтралізація. Чистки, миття посуду, пом’якшення води, полоскання горла. Стару замшу чистять молоком з питною содою (1 чайна ложка на одну склянку молока).
КУХОННА СІЛЬ NaСІ
Біла кристалічна речовина. С різні види: йодована, “Екстра”, кам’яна. Розчинність при нагріванні майже не змінюється. Використовується для приготування їжі, консервування
Поради при застосування кухонної солі.
Перед пранням кольорові прості панчохи і шкарпетки кладуть на 10 — 20 хвилин у холодну солону воду, після чого їх полощуть і тоді вже перуть.
Носовички перед пранням потрібно замочити в солоній воді, щоб шовкові або бавовняні тканини, на яких будуть вишивати, при пранні не втрачали свого первісного вигляду, потрібно до вишивання замочити їх у гарячій солоній воді.
Прозорий посуд краще всього відмивається, якщо на 1 літр води додати 1-2 столові ложки оцту і столову ложку солі.
Солоною водою чудово миються дзеркала, віконні шийки. Це їх оберігає від замерзання.
Якщо каструля сильно підгоріла, то посипте її товстим шаром солі і залиште на декілька годин. Застарілу іржу і чорнильні плями на білизні можна вивести сіллю, розчиненою в лимонному соці.
Щіпка солі, розведена в нашатирному спирті, виводить жирні плями на шовкових тканинах.
Сіль, змішана з оцтом, служить чудовим засобом для очищення червоної і жовтої
міді, графинів, пляшок, знімає жирні плями з матового скла.
Якщо сажа попала на килим, посипте пляму сіллю і через годину сажу легко буде відчистити щіткою.
Якщо чорнило пролилося на килим, потрібно негайно кинути на пляму жменю * солі, яка вбере у себе чорнило.
Перед тим, як гострити ніж або ножиці, опустіть їх на 20 — ЗО хвилин у розчин кухонної солі (1 чайна ложка на склянку води), потім, не витираючи гостріть
Кухонна сіль вибілює обличчя і руки. Корисно робити гарячі соляні ванни для рук і компреси з солоної води для обличчя (чайна ложка на склянку води).
Щоб сирі дрова добре розгорілися не потрібно поливати їх гасом, достатньо посипати сіллю. Віники робляться міцними і не ламаються, якщо її попередньо замочити на 2 — 3 години в гарячій солоній воді.
Масло в жарку погоду не буде топитися, якщо маслянку звернути серветкою змоченою у солоній воді.
Якщо ви варите компот із дуже кислих фруктів, перед тим, як положити цукор, всипте в компот трохи солі і дайте покипіти.
Вода у грілці довше не вихолоне, якщо додати туди трохи солі.
Перед тим, як різати цибулю, натріть ніж сіллю, тоді він не матиме неприємного запаху.
Для збереження часнику, в банку кладуть шар часнику, шар солі, банку закривають кришкою і ставлять в прохолодне місце.
МЕДИЧНИЙ ЕФІР
Простий ефір, діетиловий етер СН—О—СН.
Легка безбарвна рідина із своєрідним запахом. Суміш з водою розшаровується. Отже, у воді не розчинний. Добре розчиняє олію. Розчинник має анестезуючі властивості, чистить забруднений одяг.
Для збереження сипучих продуктів від шкідників, ставлять в них ватку, змочену в ефірі, герметично закривають банку кришкою і залишають на 10 діб.
Квіти на два тижня ставлять в розчин 1/3 ефіру і 2/3 води. При цьому зберігається колір, листя стає еластичним. Букет зберігається кілька років.
ГЛІЦЕРИН
CH-OH
CH-OH
CHOH
В’язка, безбарвна речовина. Добре розчиняється у воді.
Поради при застосуванні медичного ефіру
Віконне скло не так швидко брудниться, якщо після миття протерти його сумішшю 30 г води, 70 г гліцерину і декількох крапель нашатирного спирту.
Щоб лінзи не запотівали потрібно змастити їх сумішшю рівних частин гліцерину і спирту, потім протерти частиною фланелевою або замшевою тканиною. Цю саму суміш можна використати і для віконного скла.*
Шкіряні пальта та куртки час від часу протирайте тканиною, змоченою гліцерином.
Загальновідомо, що проведення останнього уроку на достатньо високому рівні , з повним навантаженням учнів — справа дуже важка. Тут впливає і втома дітей після напруженого семестру і свідомість того. Що підсумкові оцінки уже виставлені, а завтра вже канікули і т.п.
Тому організація навчальної діяльності учнів на останньому уроці особлива. Діти готуються до нього, тому що чекають особливих повідомлень, цікавих дослідів і питань. Ці уроки носять назву «Уроки цікавої хімії». їх проведення можливе лише тоді, коли учитель встигає весь матеріал з програми і останній урок може використати на свій розсуд. Ці уроки відрізняються від інших тим, що не несуть що урочної мети: з'ясування уваги, рівня знань, формування нових і закріплення раніше здобутих знань, і умінь і навичок. Мета їх розширити світогляд учнів, виявити зв'язок вивчених теоретичних основ з близькими, «домашніми» проблемами.
Про те, що відбудеться такий урок, повідомляється в класі завчасно (за 3+4 тижні до його проведення). Учням оголошується тематика, яка може бути найрізноманітніша, наприклад:
1. Хімія посміхається.
2. Хімія вдома: на кухні і в ванній.
3. Хто ці алхіміки?
4. Великі хіміки всіх часів і народів.
5. Знайома і незнайома таблиця Д.І. Менделєєва.
6. У світі хімії (вікторини, кросворди).
За підготовку таких уроків відповідають учні одного ряду в класі. Таким чином, майже всі учні протягом року проводять один урок цікавої хімії.
Кожен день, відповідальний за проведення уроку сам або разом з товаришами творчо готує ту чи іншу частину даного уроку. При цьому необхідно виявити самостійність, ініціативу, винахідливість. Інші учні класу, знаючи тему уроку, готуються до нього. За цікаву інформація чи правильну відповідь вони одержують приз (навіть можна надувні кульки).
Такі уроки відбуваються весело, захоплююче, при високій активності учнів.
Функція вчителя на уроці зводиться до його організації на початку і при підведені підсумків в кінці уроку.
Досвід показує, що готуються до таких уроків із задоволенням, чекають їх з нетерпінням і довго згадують та обговорюють цікаві моменти.
Це уроки цікавих дослідів, хімічних вікторин, метаграм (Фосфор-Босфор, золото- болото), анаграм (бром-ромб, фтор-торф), парад кросвордів, цікавих історій, повідомлень за сторінками газет та журналів. Це уроки вивчення біографії учених, історії відкриття і ставлення до хімічних елементів
*
“Є люди, які не шукають золота, але немає людини, яка б не потребувала б солі ”.
Із давньоримських рукописів.
ВСТУП
Дві речовини вкрай важливі для існування всього живого на землі — вода і сіль. З культом води ми зустрічаємося в міфах, вірування багатьох народів. Не поступається цьому і пошанування солі, в якій неспроста бачили дар богів. Там, де не було її родовищ, сіль цінувалась дуже високо.
ІСТОРИК
За свідченням Марка поло, в кінці XIII ст. В Китаї навіть були входу соляні монети.
АРХЕОЛОГ
В засушливій Сахарі археологи розкопали давнє поселення, яке майже цілком побудоване із глиб кам’яної солі.
А ось в и. Величке, що під Краковим, в товщі солі висічене ціле місто з вулицями, площами, соборами, часовнями і скульптурами. Це місто релігійного паломництва.
ІСТОРИК
![]() Пробачте, колего, але я не закінчив. Ось в Центральній Африці ще пам'ятають, як декілька соляних брусків прирівнювались до собівартості раба або викупу за наречену.
Пробачте, колего, але я не закінчив. Ось в Центральній Африці ще пам'ятають, як декілька соляних брусків прирівнювались до собівартості раба або викупу за наречену.
Але ще цікавіший факт відкрили Ізраїльці в 1936 р. Під час окупації Абіссінії вони знайшли в сейфах столичного банку соляні брикети, що лежали разом з золотом.
АРХЕОЛОГ
А я хотів сказати наступне. В деяких давніх племенах Месопотамії до солі зверталися для того, щоб звільнитись від чар чаклунства. О, Соль, что создана в месте священном...
Без тебя не бывает и пира в Элуре,
Боги, цари и князья воскурения не вздыхают...
Соль, наваждение с меня сними, развяжи мои чары!
Разрушь колдовство, и как бога-создателя тебя да восславлю.
А аборигени тихоокеанських островів, відганяючи злих духів, говорили: «Я їм сіль».
ЕТНОГРАФ *
Для більшості народів все-таки сіль — це символ благополуччя, сталості і миру.
Так, у слов’янських народів прийнято зустрічати гостей хлібом і сіллю Так величали молоде подружжя: хліб — на здоров’я, сіль — до багатства.
А за звичаєм арабів, людина, з кою коли небуть приходилось їсти сіль, стала родичем, і сваритися з нею заборонялося.
ІСТОРИК
Християнство особливо ставиться до солі. Своїх учнів Ісус наставляв словами: “Ви — сіль землі”. Тобто кращі із кращих.
ЛІТЕРАТОР
А ось як цікаво висловився Піліній старший: «Это вещество так необходимо человеческому роду, что даже духовные удовольствия не могут быть лучше выражены, как словом «соль» — таково имя, данное всем проявлениям острого ума».
ІСТОРИК
Треба відмітити, що в Вірменії при хрещенні дитини воду в купелі підсолюють.
МЕДИК
До речі, як тонізуючий засіб, і зараз рекомендовано, час від часу, підсипати дрібок солі в купіль дитини.
Я повинна відзначити, що в організмі людини середніх розмірів міститься трохи більше 400 г кухонної солі, яка входить в склад крові і служить для травлення їжі. За один рік доросла людина вживає приблизно 7 кг солі. А все людство — 3 млн. т.
ЛІТЕРАТОР
Прислів'я про те, щоб пізнати людину потрібно з’їсти не один пуд солі, розраховане на досить довге знайомство.
ЕКОНОМІСТ
А ще більше необхідно затримати залізничних ешелонів. Для того, щоб перевести річну норму солі, яку використовують люди на Україні потрібно затримати 5 тис. Залізних ешелонів.
МЕДИК *
Цікаво а де взяти стільки солі?
А вона дуже необхідна, тому що її відсутність в харчових продуктах велике захворювання і переноситься важче, ніж відсутність хліба, чи повне голодування. Сіль міститься у крові людини, сльозах, поті, тобто в рідинах організму.
ГЕОЛОГ
Кухонна сіль знаходиться в готовому вигляді в природі, причому у невеликих кількостях вона дуже поширена, але особливо багато її міститься в морській воді, в так званих соляних озерах та соляних джерелах, а в великих масах вона зустрічається у вигляді покладів твердої — кам’яної солі.
ЛІТЕРАТОР
Озер багато, а які саме багаті сіллю?
ГЕОЛОГ
Одне з найбагатших сіллю озер це — озеро Ельтон. Його дно покрите сіллю висотою 5 см. Але перлиною серед соляних озер є озеро Баскнчак одне з найбільших у світі. Має на дні три пласти солі. Верхній 6,5 — 9 м; середні 2 м; а нижній 13 м. Може забезпечити Росію сіллю протягом 40 років. До речі, кухонною сіллю, яка є тільки в морській воді, можна покрити Європу шаром, товщиною 5 км.
ЛІТЕРАТОР
А де знаходяться поклади солі?
ГЕОЛОГ
Є соляні гори — це південний Таджикистан — гора Ходжа Мумин (900 м над рівнем моря).
Є соляні пласти висотою 50 м біля міста Солотвино в Закарпатті.
Поволжя, Закавказзя, Сибір — багаті сіллю.
Оренбург — під хлібними полями розходяться соляні пласти товщиною більше 2,5 км.
ІСТОРИК
А я хотів би зупинитися на ще одному прислів’ї: «В Крим по сіль».
ТУТ необхідно згадати про чумацькі шляхи за сіллю. Це — Прикарпаття, Донбас, Крим. Кожна місцевість має свою історію.
Одну із найживучиших прикмет відновив Леонардо да Вінчі. В картині «Тайна вечеря», після того, як Ісус говорить, що один із присутніх продасть його, то Іуда перекидає солонку. *
А все ж таки, що являє собою кухонна сіль?
Х І М І К
Кухонна сіль — це мінеральний галіт. Як і всякий природний матеріал, він містить до 8 % домішок, склад і кількість яких залежить від місцезнаходження і методу добування солі. Найчастіше в ній присутні хлорид, сульфат, бромід магнію, сульфат калію, карбонат кальцію. В кухонній солі може міститись манган, ферум, нікель, купрум, флор, рубідій, стронцій, барій, аргентум, аурум, кобальт, хром, цинк, уран, плюмбум та інші елементи.
ТЕХНОЛОГ
Сіль добувають по-різному, підземним способом — кам’яну, відкритим — озерну, випарюванням на сонці морської води (басейновим), виварюючи штучні чи природні розсоли — учено-виварочно і вакум-виварочно. У всіх випадках сіль містить домішки.
Найменше домішок, які для людського організму не зайві, у солі “Екстра”.
Яка ж сіль найбільш цінна?
Відповідь однозначна — із морської води.
Одеські вчені довели, що концентрат морської води має високу біологічну активність, антитоксичні властивості, підвищує стійкість організму до захворювань. Дорогостійка очистка солі призводить до підвищення собівартості продукції і до пониження фізіологічної цінності солі.
МЕДИК
З давніх часів було відомо, що кухонна сіль різних місцевостей має різні в тому числі і біологічні властивості. Пліній Старший в своїй «Природній історії» повідомляє, що найвище в його часи ставилась сіль, що добувається із морської води, на острові Кіпр — тарентська і фригійська, яка добувалась із соляних озер; Останні два види були особливо корисними від хвороб очей.
Для лікування очних захворювань тварин використовували сіль, яку доставляли із Траюси і Беотії.
Сіль, яка привозилась із Каппадокїї, надавала шкірі блиск, сіль із Цитиума розгладжувала зморшки.
В Індії поварена сіль, збагачена фосфатом феруму і гідросульфатом натрію, використовується при лікуванні анемії.
ТЕХНОЛОГ
В США сіль збагачена сполуками заліза і комплексів вітамінів групи “В” застосовують в хлібовипіканні.*
Ще в 20-ті роки нашого століття в Англії із США в продажі нараховувалось до
двох десятків сортів солі: для засолу масла; для пекарів сироваріння ;спеціальна столова сіль з домішкою магнезії, крохмалю.
ХІМІК
Де можна використати чистий NaСI? В основному ним задоволені технологи нехарчових виробництв. При обробці шкіри і хутра наявність домішок Са і Mg знижує якість товару, викликаючи утворення «соляних» плям. Так що потрібна «Екстра». В харчовій промисловості хіба тільки при посолі масла і маргарину потрібно користуватися сіллю «Екстра» (майже чистим NaСІ), тому що надлишок хлорокислих сполук в інших сортах солі веде до знебарвлення масла.
Присутність Fе дає гіркий металічний смак, Mg і Са дають гіркоту.
Вміст заліза призводить до утворення сульфітів заліза, що значно погіршує смакові якості і зовнішній вигляд консервованих продуктів, руйнує вітамін “С”.
Вміст йоду викликає зміну смаку, запаху консервів, а також потемніння продуктів.
ТЕХНОЛОГ
За кордоном для різних видів риби використовують різні види кухонної солі. Для оселедців завжди використовується іспанська сіль.
Так досвід засолювання астраханської риби (бешенки) ладикською сіллю (Іспанія) показав, що навіть такий грубий сорт риби набуває смаку і ніжності справжнього оселедця.
Цей урок можна віднести до уроків інтегрального характеру.
Мета цього уроку — об’єднати знання, здобуті на уроках хімії, біології, фізики, географії, історії навколо основних понять цих наук, що входить до знань природничонаукової освіти, до розуміння основних законів природи.
Особливість цих уроків в тому, що їх зміст і методика повинні бути направленими до удосконалення знань і навиків учнів, актуальних для майбутньої діяльності, розширення наукового і політичного кругозору, на обґрунтування своїх поглядів на природу, її закони розвитку як єдине ціле.
Форми організації можуть бути різними і включати, наприклад:
1. Розгорнуте обговорення поставлених питань;
2. Заслуховування та обговорення підготовлених повідомлень, доповідей та співдоповідей;
3. Обговорення підготовлених рефератів;
4. Бесіда, що базується на попередньому прослуховуванні установчої лекції; 5. Дискусія за актуальними проблемами розвитку * науки на її стиках: хімія і біологія, хімія і географія;
6. Практикум по навчанню школярів експериментальним вмінням, навикам роботи з текстом підручника чи довідника, логічно-пошукових операцій.
Підготовка такого уроку складна і відповідальна справа, ніж до звичайного уроку. Відомо, що такий урок — це дискусія, обговорення питань, поставлених учителем і питань, які виникають в учнів. Природно, що учні можуть виступити іноді з помилковими думками, неточними чи неправильно сформульованими.
Тому головною умовою є те, що вчитель повинен вільно володіти матеріалом, вміло керувати ходом дискусії, коментувати виступ учня, чітко робити узагальнення по всьому матеріалу. Для цього йому необхідно самому розібратися в тому, як дана проблема, закон вивчається на уроках інших предметів, провести консультацію з вчителями, що викладають даний предмет, по можливості такі уроки провести разом з цими вчителями, якщо необхідно, то і з спеціалістами. Перед інтегральним уроком необхідно провести консультацію, розповісти учням про мету і завдання цього семінару чи конференції, про порядок його проведення, вимоги до підготовки, до кого з вчителів вони можуть звернутися, з якими спеціалістами можуть порадитись.
Підготовка повинна розпочатися за 2 — 3 тижні до проведення такого уроку. Учитель повинен напередодні визначити тему, вивішати на дошці складений план і програму проведення, пропонує список необхідної літератури.
Ось приклад ІНТЕГРОВАНОГО УРОКУ З ТЕМИ:
«Закон збереження маси речовини»
МЕТА УРОКУ, допомогти учням при їх роботі над узагальненням знань, добутих на уроках фізики, хімії, біології, географії, понять що складають основу природних наук, входять до «золотого фонду» природознавства, формують ті знання, що допоможуть молодій людині створити свій єдиний погляд на навколишній світ.
ВСТУПНЕ СЛОВО ВЧИТЕЛЯ
Одна із найважливіших наукових ідей — це ідея збереження. Збереження сім’ї, нації, країни, енергії. Ми сьогодні знайомимось із законом, який і зараз називають основним законом хімії, закон, який з самого початку свого відкриття служив основою всього природознавства — закон збереження маси речовини. Адже закон збереження енергії був відкритий лише через 150 років після відкриття закону збереження маси речовини.
Становлення закону має свою історію, з якою познайомить вас група Дослідників.
*
СЛОВО НАДАЄТЬСЯ ІСТОРИКАМ ПЕРШИЙ УЧЕНЬ.
До закону збереження матерії і руху Ломоносов прийшов на основі загально теоретико-філософських роздумів, розвиваючи і конкретизуючи ідеї античних атоністів. Вперше ми зустрічаємо формування цього закону в його листі до
Л. Ейлера від 5 липня 1748 року. «Усі зміни, що трапляються в натурі є такого стану, що скільки одного тіла відніметься, стільки ж додасться до другого, так якщо де убуде трохи матерії, то умножиться в іншому місці...» і далі «Так, як це загальний закон природи, то він поширюється і на правила руху: тіло, яке своїм поштовхом змушує друге тіло до руху, скільки ж втрачає свого руху, скільки передає другому ним зрушеному».
Пізніше, у 1756 році, він експериментально обґрунтував цей закон, повторюючи посліди Р. Бойля з прожарюванням металів свинцю олова у запаяних скляних поступах (риторах).
(Демонстрація досліду)
А тепер в мене такі запитання до класу:
1. В чому суть хімічної реакції?
Відповідь: суть хімічної реакції полягає у перегрупуванні атомів реагуючих речовин.
2. І друге запитання: як формується закон збереження маси речовин?
Відповідь: загальна маса речовин, що вступила в хімічну реакцію, дорівнює загальній масі продуктів реакції.
ДРУГИЙ УЧЕНЬ
Сьогодні цей закон носить ім’я двох вчених Михайла Васильовича Ломоносова і Антуан-Лорана Лавуазье, Закон Ломоносова-Лавуазье.
Антуан-Лоран Лавуазье син паризького адвоката, дав всебічне обґрунтування цьому закону. В 1772 році Лавуазье, виконавши серію дослідів, прийшов до правильного висновку про процеси горіння, до відкриття складного повітря, закону збереження маси речовини. В своїх дослідженнях Лавуазье опиравсь на експериментальні дані добуті Блеком, Прістлі, Шееле і іншими вченими.
ТРЕТІЙ УЧЕНЬ
Лікар Джозеф Блек у своїй докторській дисертації вирішив опротестувати думку щодо чудодійні сили ліків для виведення камінців із сечового міхура. Однією складовою частиною ліків була шкаралупа курячого яйця.
Демонстрація досліду. *
Блек виявив. Що прожарювання шкаралупи, або дії на неї кислоти супроводиться виділенням такого самого газу. Пропустивши цей газ через вапняну воду він «зв’язав» його. Так, в хімії з’явилася нова речовина — зв’язане повітря». ЗАПИТАННЯ ДО КЛАСУ: «Що це за речовина?».
Відповідь: оксид карбону (IV), якісним реактивом на який є вапняна вода. При дії його на вапняну воду відбувається помутніння.
ЧЕТВЕРТИЙ УЧЕНЬ
Через п’ятнадцять років після відкриття Блека, «зв’язаним повітрям» зацікавився Прістлі. Пастор звернув увагу на газ, що виділяється в надлишку із величезних чанів, в яких бродило сусло, і зайнявся його дослідженням. Але склад «зв’язаного повітря» він дослідити не зміг.
ДРУГИЙ УЧЕНЬ
Його склад дослідив Лавуалье. В ізольовану посудину він поклав алмаз і за допомогою лінзів сонячних променів спалив його.
Після дослідження газу він прийшов до висновку, що газ складається на 23,5 — 28,9 частин карбону і 71,1 — 76,5 частин оксигену. Із цих цифр і виведена формула.
Завдання для учнів.
ведіть формулу сполуки на основі цих даних.
Таким чином доведено формулу вуглекислого газу. Але Лавуалье довів, що маса окисних речовин збільшується за рахунок кисню на стільки, на скільки зменшується маса останнього, а маса реагуючих речовин залишається сталою. Ці досліди Лавуалье є експериментальним підтвердженням принципу збереження матері, який ним же був сформований так:
“Ніщо не створюється ні при штучних, ні при природних операціях і можна мати за правило принцип, що в кожному процесі в початковий і кінцевий момент часу знаходиться незмінна кількість матерії. БІОЛОГ 1.
Цей закон допоміг спростувати думку котра домінувала протягом багатьох віків, що земля — єдина їжа для рослин. І зробив це голландський природодослідник Гельмонт. Його відомий дослід тривав п’ять років.
(демонстрація малюнка).
В горщик насипали і старанно зважили просушену землю. В неї посадили старанно зважену гілку верби. Горщик був закритий кришкою, щоб у нього не попали сторонні тверді домішки. Вербу полили лише дощовою водою. Через п’ять років рослина збільшила свою масу. На 65,675 кг, а маса землі зменшилася у горщику лише на 60 грам.
*
Запитання до учнів
1. Які висновки ми могли б зробити на основі цього досліду?
Відповідь. Перший: земля не єдина пожива для рослин.
Другий: маса рослин збільшується і за рахунок процесу фотосинтезу.
2. Яке значення процесу фотосинтезу у природі?
БІОЛОГ 2.
Дерева, квіти, трави, птахи, комахи, звірі і ми з вами — все не існує завдяки фотосинтезу. Завдяки цьому процесу проходить нагромадження живої речовини в біосфері. Зараз її біомаса складає близько 1013 тонн. Порівнюючи цю масу з масою Землі (біля в 1021 т.) ми бачимо, що вона набагато менша маси Землі. Але, за словами В. І. Вернадського, «На земній поверхні немає хімічної сили більш постійно діючої, а тому більш могутньої за своїми наслідками як живі організми. Взяті в цілому». Розрахунки показують, що приблизно через мільярд років внаслідок життєдіяльності живих організмів біомаса повинна була б перевищувати масу Землі. Життя існує на Землі приблизно 3 млрд. Років.
Запитання до вас? Чому цього не відбувається?
ХІМІК
(Таблиці кругообігу вулицю, фосфору, кисню, азоту, е природі).
В біосфері відбувається кругообіг речовин: атоми кожного із елементів, із яких побудовані організми сприймаються із речовин, які утворилися а результаті розкладу тіл організмів, в яких скінчилося життя.
І все-таки не можна сказати, що маса всіх речовин, що беруть участь в життєдіяльності організмів залишається постійною. Це що — біологічних не діє закон збереження маси речовини?
ГЕОГРАФ.
(Діаграма, таблиці «Кругообіг карбону в природі»).
Ступінь відновлення циклів у біогенному кругообігу речовин у біосфері досягає 90 — 98 %. Частина атомів відходить в космічний простір, частина накопичується в земній корі. Те, що ми відносимо до біогенних корисних копалин (поклади заліза, крейди вугілля, нафти і т.п.) не що інше, як безкорисні з точки зору життєдіяльності продукти, які пройшли цикл підземних перетворень. Відкритість біологічного кругообігу обумовлена також тим, що в нього поступає вуглекислий газ з надр Землі.
ФІЗИК
Цей кругообіг відкритий ще й тому, що він здійснюється з використанням сонячної енергії. Кожен рік в процесі фот* осинтезу рослини поглинають біля 1,6 Т х 10 ДЖ енергії. Але ж енергія приходить не сама по собі, її приносять фотони, які мають масу.
По формулі Е = mс можна вирахувати, на скільки збільшиться маса біосфери за рахунок поглибленої енергії.
ГЕОГРАФ
(Діаграма, таблиці «Кругообіг води в природі»).
Кругообіг речовин в біосфері проходить не лише в наслідок життєдіяльності організмів. Наприклад, вода за своїм вмістом в тіло живого організму займає перше місце. Її молекули служать джерелом кисню, що виділяє рослина в процесі фотосинтезу. При дихання проходить утворення нових молекул води в географічній оболонці пройшла декілька циклів розкладу рослинами організмами і регенерації в дихальних системах всіх живих організмів біосфери. Звичайно, ці процеси проходили відповідно до закону збереження маси речовини. Проте в кругообігу води в біосфері основну роль грає не жива речовина, сонячне випромінювання. Завдяки цьому вода випаровується з поверхні, атмосферна волога конденсується, утворюються хмари, які переміщуються в атмосфері. При охолодженні хмар випадають осади, при чому над сушею в більшій мірі, ніж над світовим океаном. Баланс вологи між сушею і водними басейнами підтримується річками. Таким чином, маса води в географічній оболонці, незважаючи на агрегатні переходи залишається постійною.
БІОЛОГ 3.
Розглянемо процес, який відбувається в кожному живому організмі, в тому числі і нашому — обмін речовин. Він об’єднує два процеси: асиміляцію і дисиміляцію зміни, яким піддаються речовини від моменту їх поступу в органи травлення до утворення кінцевих продуктів розпаду, що видаляються з організму.
Хімічні перетворення харчових продуктів починаються в травному тракті, але білки, жири, вуглеводи розщеплюються на більш прості хімічні сполуки, здатні всмоктуватися через слизову оболонку шлунку і стати будівельним матеріалом в процесах асиміляції. Поступаючи в кров і лімфу, ці речовини приносять в клітини, де з ними в результаті процесів асиміляції і десиміляції проводять різні зміни. Утворені складні органічні речовини входять до складу клітин, а енергія, яка виділяється при розкладі речовин в клітинах, використовується для процесів життєдіяльності організму. Ті продукти обміну, які не використовуються організмом, виводяться з нього. Всі хімічні і біологічні процеси проходять у відповідності із законом збереження маси речовин – ні один атом не щезає при цьому і не з’являється із нічого. маси речовин — ні один атом не щезає при цьому і не з'являється із нічого.
Висновок. Фізик
Коли ми говоримо про збереження речовин у проц* есах, які відбуваються у біосфері, в географічній оболонці, ми маємо на увазі, що число атомів, котрі беруть участь у цих процесах, не змінюються, і маса кожного атому як вимір його інертних гравітаційних властивостей також залишається постійною. Можливо, ми, розв’язуючи задачі, не завжди згадуємо те, що при травленні, випарюванні, хімічних реакцій, деформації і інших подібних процесах, маса речовин залишається постійною, але цим положенням ми користуємося.
Це не суперечить практиці. Хоча ми знаємо, що всяка зміна енергії системи супроводжується зміною її маси. Але якщо ми обчислюємо зміну маси, наприклад, для реакції горіння і моль вуглецю С + О = СО + 4,02 х 10 ДЖ, то прийдемо до висновку, що ніякими терезами вирахувати це неможливо — вона дорівнює 4,4 х 10 кт.
В хімічних, біологічних, теплових, механічних, електричних, магнітних явищах, тобто в процесах, де не відбувається взаємоперетворення елементарних частинок, діє закон збереження маси речовин. У всіх процесах, зв’язаних з ядерними перетвореннями, потрібно враховувати зміну маси, відповідно енергії поля — збереження повної маси системи. І цей закон фізики об'єднують з законом збереження енергії, тому в природі діє закон збереження маси і енергії.
З А К Л Ю Ч Н Е С Л О В О В Ч И Т Е Л Я
В процесі пізнання людство відкриває все більш і більш загальні закони, немає абсолютної впевненості що цей закон є загальним на всі часи. Є тільки впевненість, що процес пізнання природи нескінчений.
До інтегрованих заходів належать і бінарні семінари. Прикладом цього є семінар з теми “Білки”. Методика проведення такого семінару типова, але втілює в себе виконання чотирьох типів завдань: усні і письмова відповіді, експериментальне завдання і коротке повідомлення про білок. Найкраще семінар відбувається тоді, коли його ведуть два учителі: учитель хімії і учитель біології. Але, на превеликий жаль у сучасній шкільній програмі дуже велика відстань у часі при вивчені цієї ж теми у курсі цих двох природних наук. І тому, коли мова іде про між предметні зв’язки, то аксіомою є те, що програми всіх природних наук повинні бути переглянуті учителем хімії і обов’язково введені у свій календарний план. Це надзвичайно важливий аспект актуалізації навчального процесу.
Хімія одна із абстрактних наук, що максимально наближена до життя. Одне із важливих її завдань — виховати людей, які б не становили загрозу ні собі, ні навколишньому середовищу.
Екологічна освіта школяра починається із вивчення і засвоєння ними правил техніки безпеки поведінки в хімічному кабінеті. Ця освіта удосконалюється і поглиблюється у процесі вивчення всього курсу хімії. Вершиною екологічної освіти є ви значення хімії. Саме органічні речовини як основний компонент їжі для гетеротрофів пояснюють живе існування. Водночас органічні сполуки, насамперед синтетичні: * пестициди, поверхнево-активні речовини (ПАР) та інші належать до найнебезпечніших забруднювачів довкілля.
Зважаючи на це, вивчення хімії, з особливо органічної хімії в середній школі має особливе значення для формування в учнів уявлення про цілісність навколишнього світу, тиску взаємодії живої і неживої природи, єдність фізичних, біологічних і хімічних процесів. Безперервне зростання економічної інформації, безмежність екології як науки, недосконалість системи економічних знань висовують на перший план питання про відбір та систематизацію екологічної інформації. Це неможливо без використання міжпредметних зв’язків, тобто без інтегрованого викладу теоретичного матеріалу на уроках хімії
Тому на уроках теми «Роль хімії в житті суспільства», зокрема, на уроках, «Хімія та екологія» ми намагаємося вирішити низку екологічних проблем.
Наш район сільськогосподарський, тому один із уроків є урок-конференція з теми «Хімізація сільського господарства, аргументи за і проти».
Для проведення цієї конференції передує значна робота учнів з довідниковим матеріалом. Вони зустрічаються з головними спеціалістами об'єднаного колективного господарства. Коли вони не в змозі прийти на конференцію, то виступають від їх імені.
ПЛАН УРОКУ
І. Вступне слово вчителя.
ІІ. Виступ учнів.
1. Застосування мінеральних добрив (аргументи за).
2. Застосування мінеральних добрив (аргументи за).
3. Дискусія за виступами.
4. Виступ агронома фермерського господарства.
5. Музична пауза.
6. Застосування отрутохімікатів (аргументи за).
7. Дискусія за виступами.
8. Виступ голови ф/г.
9. НОВИНКИ з екологізації с/г.
10. Запитання, що виникли в учнів до спеціалістів фермерського господарства.
11. Заключне слово вчителя
ДЕВІЗ УРОКУ «Будь господарем на землі»!
МЕТА: Повторити основні напрямки хімізації с/г, ознайомити учнів з екологічними проблемами, що виникають в результаті хімізації с/г.
Формувати в учнів поняття відповідальності за долю землі, збереження її
* родючості, здоров’я майбутніх поколінь.
ОБЛАДНАННЯ: Стенди що відображають застосування мінеральних добрив і отрутохімікатів у місцевому фермерському господарстві, таблиці що ілюструють вплив добрив на збільшення врожайності основних культур.
ДІАГРАМИ: Витрата пестицидів на урожай зернових по континентах. Фотографії поля, випаленого гербіцидом де густо, а де просто.
Малюнок із зображенням дощового черв’яка.
Друга група учнів готується до уроку, який висвітлює питання «Чи винна хімія» у всіх екологічних бідах, які часто супроводжують наше життя?
На цьому уроці учні дискутують, використовуючи факти з життєвого досвіду.
Це необхідно для того, щоб даний матеріал допоміг зруйнувати стеоретип мислення, який готує науково-технічний процес. Ось деякі дослідження учнів, на яких ґрунтується даний урок.
ЧИ ВИННА ХІМІЯ
Загальна хімізація народного господарства, в необхідності якої ще недавно ніхто не сумнівався, наштовхнулася в останні роки на серйозний опір широких мас населення. В цілому ряді центрів, де сконцентрована хімічка, нафтохімічна і мікробіологічна промисловість екологічна обстановка відкрито названа несприятливою.
Негативні явища, підсилені повідомленнями про аварії і катастрофи, які відбуваються на підприємствах хімічного профілю і при перевезенні хімічної продукції, обумовили виникнення серед широких мас населення хемофобії — заперечення необхідності хімізації промисловості і сільського господарства.
Щоб хоча б частково виправити становище, що склалося, розберемося в тому, які причини забруднення природи і в чому полягає вина хімії.
Безсумнівно, що наша держава повинна вживати серйозніших заходів по захисту природи від забруднення: будувати нові і реконструючи старі очисні споруди. Що на стадії проектування нові виробництва мають проходять екологічну експертизу. На охорону навколишнього середовища щорічно треба виділяти значні суми.
Так, капітальні витрати на захист навколишнього середовища становлять (6% від всіх капітальних вкладень) в металургійному комплексі складають 17,1%, в паливно-енергетичному комплексі — 16,8%, в хіміко-лісовому — 14,9%, в машинобудівному — 5%.
Приведемо цифри, що показують річний “вклад” підприємств різних галузей в забруднення навколишнього повітряного басейну млн.т енергетика 3,5 чорна металургія * 2,1 кольорова металургія 1,3
нафтова промисловість 1,1 хімічна промисловість 0,2 нафтопереробна і нафтохімічна промисловість 0,9
виробництво добрив 0,3 лісова, деревообробна і паперова др. 0,3 медична і мікробіологічна промисловості 0,04
Аналіз приведених даних,показує, що всі міністерства хіміко-лісового комплексу забруднюють повітря менше, ніж заводи чорної металургії. І набагато менше, ніж теплові електростанції. Така ж справа і з забрудненням водойм: із загальних 20 млрд. Метрів кубічних на частку хіміко-лісового комплексу припадає тільки 10%, або 2 млрд. метрів кубічних стічних вод. Звичайно, необхідно врахувати, що «букет» забруднень, який доповнюють хіміки, істотно більший, ніж «букет» металургів та енергетиків. Однак для неупередженої людини стає зрозумілим, що боротьба за чистоту природи пов’язана з підвищенням культури енергетичних і металургійних підприємств в більшій мірі, ніж хімічних.
Особлива увага приділяється завершеності процесу навчання хімії у школі. Все має початок і кінець. Початок і становлення учня-хіміка беруть від свята «Посвячення у хіміки», який готують для семикласників - одинадцятикласники.
На цьому святі звучать прекрасні слова про науку хімію, про важливість її вивчення, проходять конкурси по добуванню речовин, розділенню сумішей. Хто швидше? Хто кмітливіший? Тут і гра в «четвертого зайвого», загадки. Конкурси капітанів, конкурси болільників.
І ось підводяться підсумки і журі виносить вердикт «Звання юного хіміка заслуговують учні всіх чотирьох класів. Щиро вітаємо вас із присвоєнням цього звання і бажаємо вирости справжніми хіміками, які покращували б добробут нашого народу.
І все ж у цьому конкурсі найкращі знання виявили...» І тут вручаються призи, які так люблять учні, — прикраси з вирощених кристалів мідного купоросу.
А коли одинадцятикласники закінчують школу, проводиться жартівливий брейн- ринг між старшокласниками та учнями молодшої ланки. Готуються подарунки старшокласникам. Питання найрізноманітніші. Але всі задоволені. Як хіміки, старшокласники готові вирушити своїми життєвими стежками. А молодші учні думають: а ми будемо знати більше вас, однак любимо вас, заздримо вам у дечому і в майбутньому будемо намагатись перевищити вас у знаннях. Моя практика вчителя хімії показує, що:
1.Ефективність уроку залежить від того, як ви продумали, вникли в мету кожного уроку, в його навчальний, виховний і розвиваючий аспект. Ця тріада повинна бути органічно єдина і узгоджена;
2.До того часу, поки вчитель, що йде на урок, не буде чітко уявляти, чого конкре* тно він повинен навчити, що починати, а що продовжувати розвивати і виховувати у своїх учнів — говорити про повноту реалізації завдань навчання не доводиться.;
3.Зміст мети повинен бути орієнтованим не тільки на весь клас, але й на окремих учнів. Реальність досягнення мети залежить від злагодженої взаємодії, співробітництва як між учнем і учителем, так і між самими учнями;
4.Сам по собі навчальний матеріал мертвий. Він оживає і починає діяти на учнях при вірному виборі методів навчання. Навчальний матеріал повинен бути строго дозованим, доступним, послідовним, науковим.
5.Роль експерименту не тільки у розкритті єдності теорії і практики, він відіграє пояснюючу, прогнозуючу і розвиваючу функції у навчанні;
6.Урок узагальнення і систематизації знань має в собі діяльність учнів по включенню частини у єдине ціле і при цілому формує систему знань;
7.Контроль понад усе. Діяльність учнів повинна оцінюватись глибоко, різносторонньо і систематично;
8.Структури уроків різноманітні і практика уроку приводить до нових форм навчання, нової гнучкої їх структури.
Процес пізнання нескінченний.
*


про публікацію авторської розробки
Додати розробку
