Умови виникнення і припинення горіння
Тема. Умови виникнення та припинення горіння. Повільне окиснення
Мета: з’ясувати суть процесів горіння та окиснення; порівняти процес горіння та повільного окиснення; формувати уявлення про умови виникнення та припинення горіння, механізм дії засобів пожежогасіння;ознайомити із заходами протипожежної безпеки у побуті та на виробництві;з’ясувати значення реакцій окиснення;розширити уявлення про оксиди як продукти окиснення речовин;розвивати уміння складати рівняння реакцій взаємодії кисню з простими і складними речовинами;удосконалювати навички складання формул бінарних сполук.
Тип уроку: поглиблення знань.
«Вважаю нещасливим той день або той час, коли ти не засвоїв нічого нового і нічого не додав до своєї освіти».
Я.А.Коменський.
Хід уроку
І. Організація класу.
Клас поділяється на 4 групи, кожна група одержує завдання за вивченим матеріалом і опорні конспекти до уроку.
ІІ. Актуалізація опорних знань.
- Фронтальне розв’язування тестових завдань.
1. Вибрати трійку речовин, що складається лише з неметалів:
а) O2, N2, Al; б) O2, Fe, H2; в) O2, S, P.
2. Вибрати пару речовин, з яких в лабораторії можна добути кисень:
а) KMnO4 i CaCO3; б) KMnO4 i KClO3; в) H2O2 i NaOH.
3. Прізвище ученого, який добув кисень із селітри і назвав його «вогняним повітрям».
а) Шеєле, б) Ломоносов, в) Дальтон.
4. Вибрати формулу речовини, що утворюється при горінні сірки:
а) SO3; б) SO2; в) H2S.
5. Вибрати трійку речовин, що складається лише з оксидів:
а) Fe2O3, CaO, NaNO3;
б) NO2, ZnO, Cr2O3;
в) CuO, H2SO4, SiO2.
6. Вибрати формулу фосфор (V) оксиду:
а) P2O3; б) P2O5; в) PH3.
7. Встановити відповідність:
А). нітроген (IV) оксид 1). N2O
Б). нітроген (ІІ) оксид 2). NO2
В). нітроген (І) оксид 3). NO
8. Які речовини утворюються в результаті горіння етилового спирту?
а) CO i H2O; б) CO2 i H2O; в) CO2 i H2.
2. Робота у групах.
Завдання групам.
- Скласти рівняння реакції добування кисню.
- Скласти рівняння реакції кисню з простою речовиною.
- Знайти загальну суму коефіцієнтів у двох рівняннях і вибрати правильну відповідь.
1 Група: KMnO4 =
P + O2 =
Варіанти відповіді: А – 12, Б – 14, З - 16
2 Група: KClO3 =
Ca + O2 =
Варіанти відповіді: Е -12, К – 14, М - 16
3 Група: H2O2 =
S + O2 =
Варіанти відповіді: Л – 6, М – 8, О - 10
4 Група: H2O =
Al + O2 =
Варіанти відповіді: К – 12, Л – 14, М - 16
Учень біля дошки:HgO =
N2 + O2 =
Варіанти відповіді: О – 8, Я – 10, А – 12
Правильна відповідь: З -16, Е – 12, М – 8, Л – 14, Я – 10.
Гра «Так –ні»
1. Для дихання потрібен кисень.
2. До складу води входить кисень.
3. Під час горіння речовин витрачається кисень.
4. Оксиген – це проста речовина.
5. Кисень важчий за повітря.
6. Реакція горіння веде до утворення оксидів.
7. Каталізатори не впливають на швидкість реакції.
8. Лавуазьє створив кисневу теорію горіння.
9. Унаслідок горіння простих речовин утворюються оксиди.
10. Оксиди –це речовини, що складаються з атомів одного і того ж хімічного елемента.
11. У процесі фотосинтезу кисень поглинається.
12. У процесі дихання кисень виділяється.
13. У чистому кисні горіння відбувається швидше
ІІІ. Мотивація навчальної діяльності.
Запитання до учнів: 1. Який склад атмосфери Землі?
2. У яких процесах на Землі бере участь кисень?
Сьогодні ми доповнимо свої знання про хімічні явища, у яких бере участь кисень, а також про їх роль у житті людини. З’ясуємо суть процесів окиснення. Дізнаємось про те, що спільного і що відмінного між процесами горіння і повільного окиснення, які умови виникнення і припинення горіння. А також отримаємо відповідь на запитання:
«Що було б, якби вміст кисню в атмосфері Землі був інший?»
ІV. Вивчення нового матеріалу.
1. Горіння. Умови виникнення та припинення горіння.
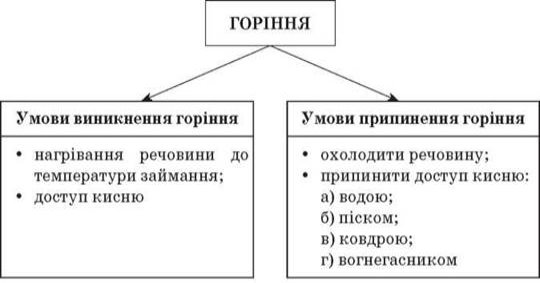
Дати відповіді на запитання.
- Які ознаки реакцій горіння?
- Що таке горіння?
- Які умови виникнення горіння?
- Назвати температури займання різних речовин.
- Як припинити процес горіння?
- Яке значення мають реакції горіння (позитивне і негативне).
Доповнення учителя.
Температури займання різних речовин відрізняються. Наприклад, для білого фосфору – 400С, азоту – 25000С.
Горіти можуть прості і складні речовини.
Кисневу теорію горіння створив А.Л.Лавуазьє (демонстрація портрета ученого).
Дослід 1. Горіння магнію.
Завдання: 1.Записати рівняння реакції горіння магнію в зошиті і на дошці.
2. Записати рівняння реакцій горіння складних речовин: MgS та C2H2
Демонстрація колекції «Паливо».
2. Причини виникнення пожеж. Засоби пожежогасіння.
Робота з підручником; доповнення учителя.
Пожежа – це неконтрольоване горіння. Пожежі бувають природні та антропогенні.
До природних належать пожежі, що виникають унаслідок прямих ударів блискавки (розрядів атмосферної електрики), виверження вулканів, самозаймання торфу, вугілля тощо. Кількість таких пожеж незначна - менше 1%.
Більшість пожеж в Україні (50-60%) виникає внаслідок необережного поводження з вогнем.
Переважна більшість пожеж виникає безпосередньо з вини людини (антропогенні) через необізнаність її з правилами та вимогами пожежної безпеки або внаслідок несвідомого, поверхового чи просто недбалого ставлення до них.
Основні джерела займання: (демонстрація таблиці)
|
Вид теплового впливу |
Реальне джерело займання |
|
Тління |
сигарета, головешка, вугілля, шлак |
|
Відкрите полум'я |
свічка, сірник, запальничка, факел, пальник, паяльна лампа, багаття |
|
Іскра |
іскра термічна, іскра електрична, іскра від тертя (висікання) |
|
Термічне нагрівання поверхні |
піч, сушарня, розігрівання від тертя |
|
Електричне нагрівання поверхні |
коротке замикання, перевантаження мережі, поганий контакт у проводах, електронагрівальний прилад, електромагнітне поле, освітлювальний прилад, розжарена частинка, електрична піч |
|
Інші |
сонячні промені, розряд атмосферної електрики (блискавка), нагрітий газ, лазер, самозаймання |
Основні засоби гасіння пожежі:
1) Вогнегасні речовини-це речовини, які при введенні в зону горіння припиняють його. Основними вогнегасними речовинами та матеріалами є: вода, водяна пара, хімічна та повітряно-механічна піни, водні розчини солі, негорючі гази, сухі вогнегасні порошки.
2) Пожежна техніка. Апарати пожежогасіння поділяють на пересувні (пожежні автомобілі), стаціонарні установки, вогнегасники і пожежне обладнання (водопровід, шланги).
3) Пожежна сигналізація. Своєчасне виявлення ознак займання й виклик пожежних підрозділів дає змогу швидко локалізувати осередки пожежі та вжити заходи щодо її ліквідації, а отже, створює можливість суттєво зменшити обсяги заподіяної шкоди. Найшвидшим та найнадійнішим засобом сповіщення про виникнення пожежі вважаються установки електричної пожежної сигналізації.
Запитання. 1. Які причини виникнення пожеж?
- Як запобігти пожежам?
- Як себе поводити під час пожеж?
- Які засоби пожежогасіння вам відомі?
- Чи завжди пожежу можна гасити водою?
3. Повільне окиснення.
Взаємодія речовин з киснем не завжди супроводжується горінням. Часто реакції відбуваються повільно, непомітно, без виділення тепла і без полум’я.
Дослід 2. Реакція кисню з міддю.
Завдання: 1.Записати рівняння реакції у зошитах і на дошці.
2. Навести приклади аналогічних реакцій.
Запитання: 1. Що таке повільне окиснення?
2. Які ознаки повільного окиснення?
3. Навести приклади повільного окиснення у природі.
4. Що спільного і чим відрізняються реакції горіння і повільного окиснення?
5. Що розуміють під поняттям окиснення?
6. Яке значення реакцій окиснення?
Доповнення учителя. Вплив вмісту кисню на горіння речовин та самопочуття людини.
17% - шахтарська лампа гасне; дихання людини нормальне;
14% - гасне свічка; 12% - гасне полум’я ацетилену; дихання глибше нормального;
10% - гасне полум’я спирту; людина починає задихатися;
5% - дихання ускладнене, запаморочення, а з часом, імовірно, смерть;
2% - раптова непритомність. Поки серце не перестало битися (до 10 хвилин), людину за допомогою штучного дихання ще можна повернути до життя.
30% - горіння було б складно загасити.
V. Домашнє завдання.
VІ. Підведення підсумків уроку.
Вправа «Мікрофон».
Запитання:
- Чи досягнули поставлених цілей на уроці?
- Що нового дізналися?
- Що найбільше запам’яталось?
Варіанти відповідей:
- Поставлених цілей досягнули.
- Довідались, що реакції взаємодії речовин з киснем можуть відбуватись у вигляді горіння і повільного окиснення.
- Вивчили умови виникнення і припинення горіння, причини виникнення пожеж і принцип роботи засобів пожежогасіння.
- Ознайомились із значенням реакцій окиснення у житті людини.
- Довідались багато цікавого про Сонце, сірники, застосування водню як альтернативного паливного ресурсу, паливні ресурси України.


про публікацію авторської розробки
Додати розробку
