Урок № 3 Тема. Основи, їх склад і назви. Класифікація основ, заходи безпеки під час роботи з основами. Використання основ
Тема. Основи, їх склад і назви. Класифікація основ, заходи безпеки під час роботи з основами. Використання основ.
Мета уроку:
-сформувати поняття про основи;
-визначити особливості їх складу та назв;
- розглянути фізичні властивості основ і ознайомитися з класифікацією основ по їх розчинності;
-сформувати вміння складати формули основ, давати їм назви та вміння виявляти луги за допомогою індикаторів;
-розглянути використання основ та правила техніки безпеки під час роботи з основами;
-розвивати вміння творчо використовувати отриману інформацію.
Основні класів неорганічних сполук. 8 клас
Урок № 3
Тема. Основи, їх склад і назви. Класифікація основ, заходи безпеки під час роботи з основами. Використання основ.
Мета уроку:
- сформувати поняття про основи;
- визначити особливості їх складу та назв;
- розглянути фізичні властивості основ і ознайомитися з класифікацією основ по їх розчинності;
- сформувати вміння складати формули основ, давати їм назви та вміння виявляти луги за допомогою індикаторів;
- розглянути використання основ та правила техніки безпеки під час роботи з основами;
- розвивати вміння творчо використовувати отриману інформацію.
Базові поняття та терміни: основи, луги, кислоти, індикатори.
Тип уроку: поглиблення і розширення знань.
Методи навчання: пояснювально-ілюстративні – бесіда, розповідь; наочні – демонстрації, лабораторний дослід; практичні – виконання завдань; репродуктивні; частково-пошукові, творчі, інтерактивні.
Матеріали: зразки миючих засобів, метилоранж, лакмус, фенолфталеїн, натрій гідроксид, кальцій гідроксид, пробірки, вода.
Обладнання: періодична система хімічних елементів Д.І.Менделєєва, таблиця розчинності.
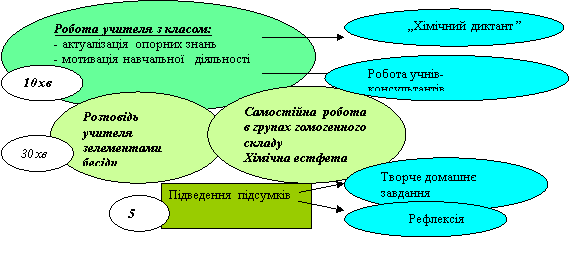
Хід уроку
І. Організаційний етап
Привітання, перевірка готовності учнів до уроку.
ІІ. Перевірка домашнього завдання.
Хімічний диктант за назвами кислот і оксидів.
- Купрум (ІІ) оксид 7) алюміній оксид
- хлоридна кислота 8) сульфітна кислота
- нітратна кислота 9) карбонатна кислота
- натрій оксид 10) ортофосфатна кислота
- сульфатна кислота 11) ферум (ІІІ) оксид
- сульфур (VІ) оксид
ІІІ. Актуалізація опорних знань
Завдання для розвитку творчого мислення
Учням-консультантам пропонується за 1-2 хв. підготувати запитання до класу за темою: «Оксиди. Кислоти» та провести опитування учнів.
Мотивація навчальної діяльності.
Кислоти входять до складу деяких миючих засобів (учитель демонструє зразки миючих засобів з етикетками). Але є миючи засоби (наприклад, для чищення поверхні кухонних плит), до складу яких входять не менш небезпечні їдкі речовини, ніж кислоти. На етикетках таких засобів написано, що до їх складу входять, наприклад, їдкий натр, їдке калі. Ці речовини є протилежними за своїми властивостями до кислот.
Як ви думаєте, до якого класу неорганічних сполук вони можуть належати?
Вчитель. Тема нашого уроку «Основи: їх склад, назви, визначення».
Учням пропонується сформулювати питання, які слід розглянути на уроці. Ці питання коригуються, записуються, можуть використовуватися як план уроку.
ІV. Вивчення нового матеріалу.
- Поняття про основи, їх склад і назви.
Основи за хімічними властивостями протилежні кислотам. Вони складають клас неорганічних сполук. Основи складаються з двох частин: атомів металу і гідроксогрупи ОН, тому вони мають назву – гідроксиди. Наприклад: NaOH, Ca(OH)2, Al(OH)3.
Основи – складні речовини, що складаються з атома металічного елемента і однієї або декількох гідроксидних груп (валентність І).
Загальна формула Ме(ОН)х, де х – кількість груп ОН, залежить від валентності металу. Назви основ складаються за схемою: назва металу (валентність, якщо вона змінна) + слово «гідроксид».
Наприклад:
NaOH – натрій гідроксид;
Fe(OH)2 – ферум (ІІ) гідроксид;
Al(OH)3 – алюміній гідроксид.
Завдання для закріплення.
Учитель пише на дошці формули гідроксидів, учні дають їм назви, і навпаки: за назвами гідроксидів учні складають формули.
- Фізичні властивості основ.
Розповідь учителя. Основи поділяються на розчинні та нерозчинні у воді (учитель звертає увагу на таблицю розчинності). Розчинні основи називають лугами.
Луги – тверді речовини білого кольору, без запаху, милкі на дотик, добре розчинні у воді й спирті. При розчиненні у воді лугів виділяється велика кількість теплоти і розчин розігрівається. Тверді гідроксиди Натрію і Калію настільки гігроскопічні (поглинають газувату воду з повітря), що на повітрі розпливаються. На відміну від всіх лугів, кальцій гідроксид (гашене вапно) малорозчинний у воді. Його насичений розчин називають вапняною водою, а суспензію у воді – вапняним молоком.
Нерозчинні гідроксиди – за звичайних умов, тверді речовини різного забарвлення, без запаху, не проводять електричний струм і не притягуються магнітом, звісно, у воді не розчиняються.
Демонстрація. Зразки основ: КОН, NaOH, Ca(OH)2, Cu(OH)2 (свіжоприготовлений), Al(OH)3. Учні самостійно роблять узагальнюючу схему у зошитах.
![]()

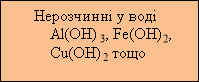
![]()
![]()
- Виявлення основ.
Розповідь учителя. Луги являються небезпечними для людини, тому при роботі з ними потрібно дотримуватися правил техніки безпеки. Які ми знаємо правила ІБЖ?
Луги, як і кислоти, виявляють за допомогою індикаторів.
У присутності лугу:
лакмус – синій;
метилоранж – жовтий;
фенолфталеїн (кращій на луги) – малиновий.
Лабораторний дослід. Дія розчину лугу на індикатори. Самостійна робота в групах гомогенного складу. За інструктивною карткою в підручнику.
Фізкультхвилинка
Встали дружненько ми классом- потягнулися направо ,
Подивилися на ліво, покрутилися навколо.
Потягнулись, посміхнулись, пальчики в замок зімкнулись.
Ми їх легко розімкнули і за партии знову сіли.
- Використання основ.
Розповідь учителя. На практиці здебільше використовуються тільки луги, в першу чергу натрій гідроксид та кальцій гідроксид. Кальцій гідроксид має технічну назву «негашене вапно». Його використовують здебільше у будівництві для приготування різних будівельних сумішей: штукатурка, шпаклівка тощо. Вапняним молоком (суспензією кальцій гідроксиду у воді) навесні фарбують низ стовбурів дерев, щоб застерегти від мурах. Також кальцій гідроксид використовують у цукровій промисловості, для виготовлення зубних паст. Натрій гідроксид використовується при виробництві мила, миючих засобів, ліків, у шкіряній промисловості, для очищення нафти тощо.
Луги є їдкими речовинами: вони роз`їдають шкіру, деревину, папір, спричиняють серйозні опіки шкіри і слизових оболонок. Недарма натрій гідроксид називають їдким натром, а калій гідроксид – їдким калі. Вовняна тканина, занурена в концентрований розчин натрій гідроксиду, набухає й перетворюється в драглеподібну масу. Якщо розчин лугу, що потрапив на руку, не змити водою, шкіру починає щипати, і незабаром утворюється виразка. При роботі з лугами потрібно особливо берегти очі, тому рекомендується надягати захисні окуляри.
5. Правила техніки безпеки
V. Закріплення та узагальнення знань
Завдання. Хімічна естафета
- Підкресліть основи в наведеному переліку: КОН, СаСО3, Са(ОН)2, Н2СО3, K2S, NaOH, HF, Ba(OH)2, SO2, H3PO4, Al(OH)3, HBr, FeO, Fe(OH)3, H2S, H2SO4, Zn(OH)2, CO2, LіOH.
- Складіть формули гідроксидів Калію, Магнію, Стануму (ІІ), Цинку, Алюмінію, Купруму (ІІ), Плюмбуму (ІV), Барію. Формули лугів підкресліть.
- Гідроксиди Феруму (ІІІ), Цинку при нагріванні розкладаються на відповідний оксид і воду. Напишіть рівняння реакцій.
- Дано дві пробірки з прозорими розчинами. Відомо, що в одній з них кислота, а в іншій луг. Як можна визначити зміст пробірок?
- Обчисліть масу, яку має порція ферум (ІІ) гідроксиду кількістю речовини 0,2 моль.
- Обчисліть кількість речовини гідроксидів, що містяться в: а) 20 г натрій гідроксиду; б) 10,3 г хром (ІІІ) гідроксиду.
VІ. Домашнє завдання.
Опрацювати ![]() 6 параграф. Виконати вправи: дост. рівень - №56-57 ст. 36.
6 параграф. Виконати вправи: дост. рівень - №56-57 ст. 36.
Високий рівень:
Творче завдання для роботи в малих групах по узагальненню матеріалу.
Складіть сенкен за темою «Основи».
Тема (іменник)
Опис (2 прикметники)
Дія (3 дієслова)
Ставлення (фраза – 4 слова)
Перефразування сутності, синонім (1 слово)
Рефлексія.
Для підведення підсумків цього уроку використовуємо інтерактивну технологію колективно-групового навчання «Незакінчене речення». Учитель пропонує учням продовжити речення: «Найважливішим відкриттям на цьому уроку для мене було…


про публікацію авторської розробки
Додати розробку
